
- •Министерство образования и науки
- •1 Растворы
- •1.1 Основные понятия и определения
- •1.2 Способы выражения состава раствора
- •1.3 Закон Рауля. Идеальные растворы
- •1.4 Следствия из закона Рауля
- •1.4.1 Повышение температуры кипения идеального раствора
- •1.4.2 Понижение температуры замерзания раствора
- •1.5 Осмотическое давление
- •1.6 Реальные растворы
- •1.6.1 Отклонения от закона Рауля
- •1.6.2 Активность. Коэффициент активности
- •1.7 Растворимость
- •1.7.1 Растворимость твердых веществ в жидкости
- •1.7.2 Растворимость газов в жидкости
- •1.7.3 Взаимная растворимость жидкостей
- •1.8 Равновесие жидкий раствор – насыщенный пар в различных жидких смесях
- •1.8.1 Неограниченно смешивающиеся жидкости
- •1.8.1.1 Состав пара и жидкости. Законы Коновалова
- •1.8.1.2 Разделение бинарных смесей путем перегонки
- •1.8.2 Равновесие жидкость - пар для практически несмеши-вающихся жидкостей
- •1.8.3 Равновесие жидкость – пар для ограниченно смешивающихся жидкостей
- •1.9 Закон распределения Нернста. Экстракция
- •1.10 Примеры решения задач
- •1.11 Вопросы для самоконтроля
- •2 Электрохимия
- •2.1 Электрическая проводимость растворов электролитов
- •2.1.1 Сильные и слабые электролиты
- •2.1.2 Удельная электрическая проводимость
- •2.1.3 Молярная и эквивалентная электрические проводимости
- •2.1.4 Числа переноса
- •2.2 Кондуктометрия
- •2.2.1 Определение растворимости труднорастворимой соли
- •2.2.2 Определение предельной эквивалентной электрической проводимости растворов сильных электролитов
- •2.2.3 Кондуктометрическое титрование
- •2.3 Электродные процессы
- •2.3.1 Основные понятия и определения
- •2.3.2 Классификация электродов
- •2.3.3 Типы гальванических элементов
- •2.3.4 Диффузионный потенциал
- •2.3.5 Потенциометрическое титрование
- •2.4 Скорость электрохимической реакции
- •2.4.1 Поляризационные кривые
- •2.4.2 Перенапряжение
- •2.4.3 Электролиз
- •2.4.3.1 Электролиз водного раствора CuCl2
- •2.4.3.2 Электролиз водного раствора к2sо4 с использованием инертных анодов
- •2.4.3.3 Законы Фарадея
- •2.5 Примеры решения задач
- •2.6 Вопросы для самоконтроля
- •Кинетика
- •3.1 Скорость химической реакции
- •3.2 Кинетическая классификация химических реакций
- •3.2.1 Молекулярность реакции
- •3.2.2 Порядок реакции
- •3.3 Влияние температуры на скорость реакции. Энергия активации
- •3.4 Методы определения порядка реакции
- •3.5 Сложные реакции
- •3.5.1 Параллельные реакции
- •3.5.2 Обратимые реакции
- •3.5.3 Последовательные реакции
- •3.5.4 Сопряженные реакции
- •3.5.5 Метод стационарных концентраций
- •3.6 Примеры решения задач
- •3.7 Вопросы для самоконтроля
- •Литература
3.5.2 Обратимые реакции
Обратимыми (двусторонними) в кинетике называют реакции, которые протекают одновременно, как в прямом, так и в обратном направлении.
В этом смысле почти все химические реакции являются двусторонними. В ходе их протекания исходные вещества образуют продукты, которые, вступая во взаимодействие между собой, образуют снова молекулы исходных веществ. Пока скорости этих процессов неодинаковы, происходят заметные изменения количества реагентов. Если скорости прямого и обратного процессов становятся равными, то наступает динамическое равновесие. В этом случае концентрации реагентов перестают изменяться и подчиняются термодинамическому закону действующих масс. Если же скорость обратной неизмеримо меньше скорости прямой реакции, то такая реакция считается кинетически необратимой. Это может произойти, если продукты быстро удаляются из зоны реакции и не успевают вступать во взаимодействие. Например, при выделении газа или выпадении осадка. Заметим, что обратимые (двусторонние) реакции в кинетике не соответствуют термодинамически обратимому процессу. В первом случае речь идет о направлении процесса, во втором – о способе его проведения.
Рассмотрим наиболее простой тип обратимых реакций с мономолекулярными стадиями. Задача состоит в определении констант прямой и обратной реакций.
k1
А
![]() В
В
k2
t = 0 a 0
t a - x x
t = ∞ a - xравн. xравн.
Составим дифференциальное кинетическое уравнение для А.
![]() .
(3.16)
.
(3.16)
В момент равновесия
![]()
![]()
![]() .
(3.17)
.
(3.17)
В любой момент времени t, заменив в уравнении (3.16) (k1+k2) из уравнения (3.17), и СА = (a – x)
![]() ,
,
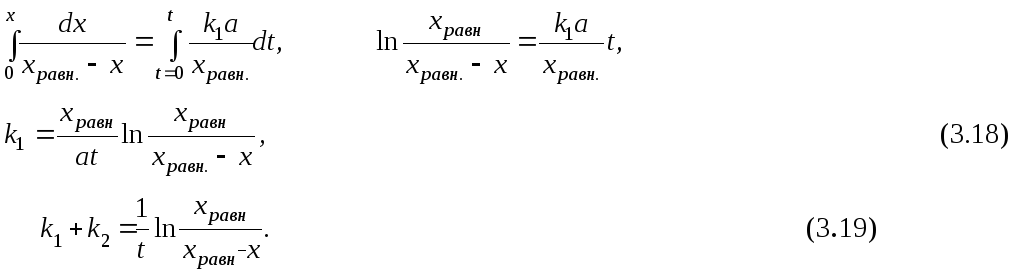
Таким образом, зная концентрации реагента в начальный момент времени и в момент времени t, а также в момент равновесия, можно определить k1 и k2 по уравнениям (3.18) и (3.19). хравн. может быть найдено по закону действующих масс, если известна константа равновесия.
При равновесии

то есть, отношение констант скоростей прямой и обратной реакций равно константе равновесия обратимой реакции. k1 и k2 можно найти, решая систему уравнений (3.19) и (3.20).
Можно получить уравнение для количества прореагировавшего вещества А в любой момент времени t.
Из уравнения (3.19)
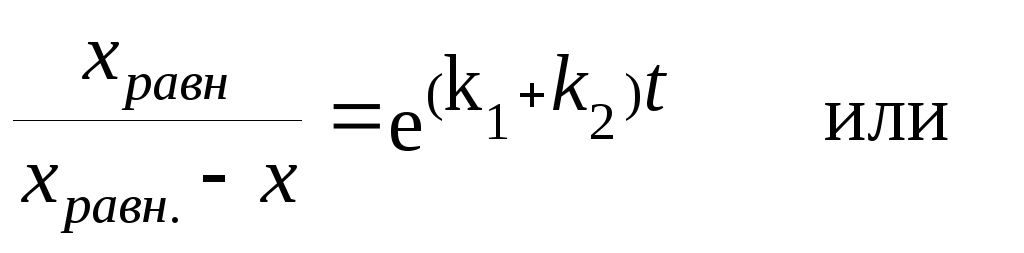
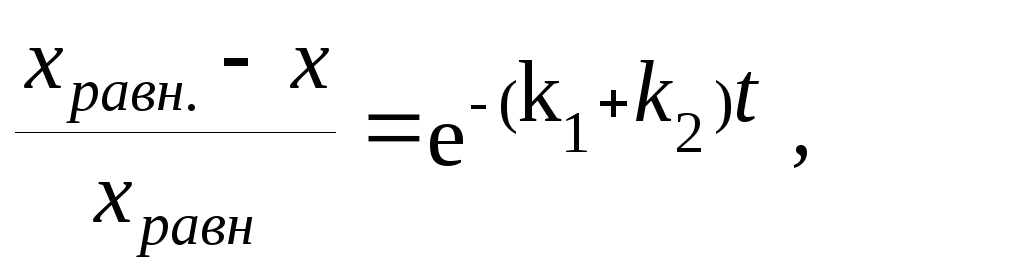
![]()
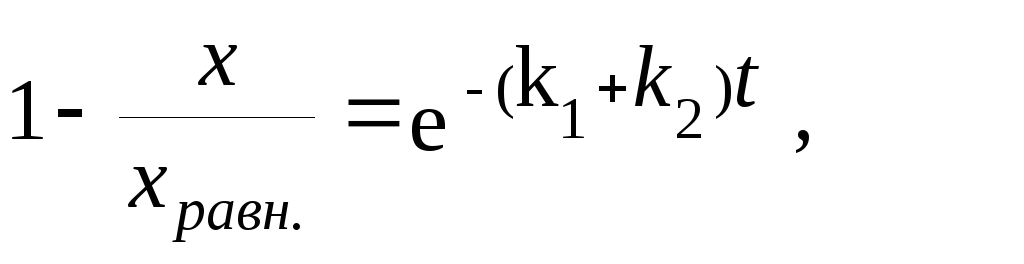 откуда
получаем
откуда
получаем
![]()
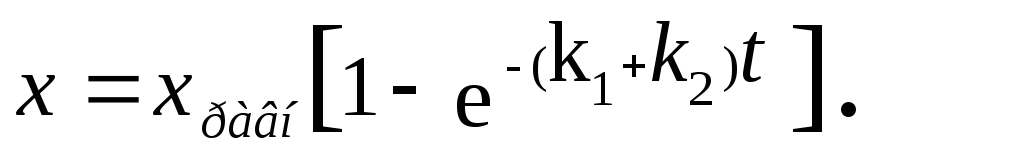 (3.21)
(3.21)
3.5.3 Последовательные реакции
Последовательные реакции состоят из нескольких стадий, следующих друг за другом. Примером является реакция гидролиза трисахаридов в кислой среде:
С18Н32О16
+ Н2О
→ С6Н12О6
+ С12Н22О11
![]() 3С6Н12О6
3С6Н12О6
Промежуточными продуктами могут быть обычные молекулы, свободные атомы или радикалы, обладающие повышенной химической активностью. Математическое решение уравнений для последовательных реакций является довольно сложным и целесообразно лишь для простейших случаев.
Рассмотрим реакцию, состоящую из двух простых мономолекулярных стадий:
![]()
t = 0 C0A 0 0
t C0A – x x – y y ,
где (х – у) и у – концентрации веществ В (CB) и D (CD) в момент времени t, соответственно.
Реакция превращения вещества А идет по первому порядку и текущая концентрация вещества А рассчитывается по уравнению (3.3)
СА = С0А e-k1t.
Приведем уравнение текущей концентрации вещества В (без вывода)
СВ=
![]() (
e-k1t
- e-k2t).
(3.22)
(
e-k1t
- e-k2t).
(3.22)
Ввиду того, что обе стадии мономолекулярны и расходование некоторого количества молекул А приводит к образованию точно такого же количества молекул В, а затем из В образуется D, выполняется равенство
С0А = СА + СВ + СD, откуда
СD
= С0А
- С0А
.
e-k1t
-
![]() (
e-k1t
- e-k2t).
(
e-k1t
- e-k2t).
Полученные зависимости могут быть представлены графически в виде кинетических кривых (рисунок 3.9).
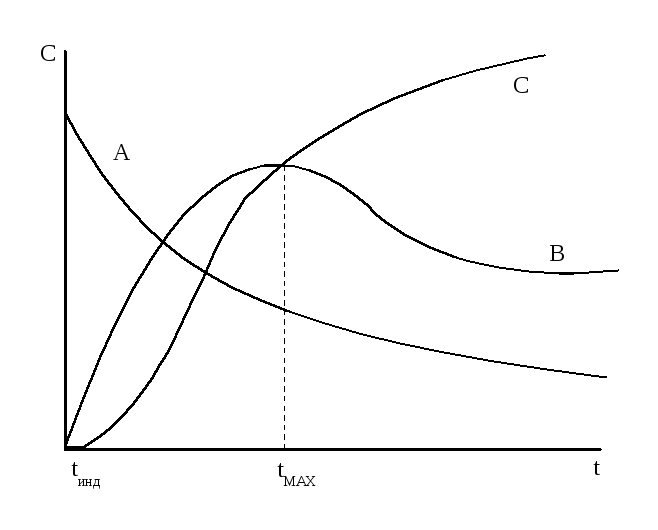
Рисунок 3.9 – Зависимость концентраций участников последовательной реакции от времени
Для вещества А
кривая представляет собой экспоненту.
Кривая вещества В
проходит через максимум. Время tmax
можно найти, если взять первую производную
![]() и приравнять
ее к нулю (условие экстремума).
и приравнять
ее к нулю (условие экстремума).
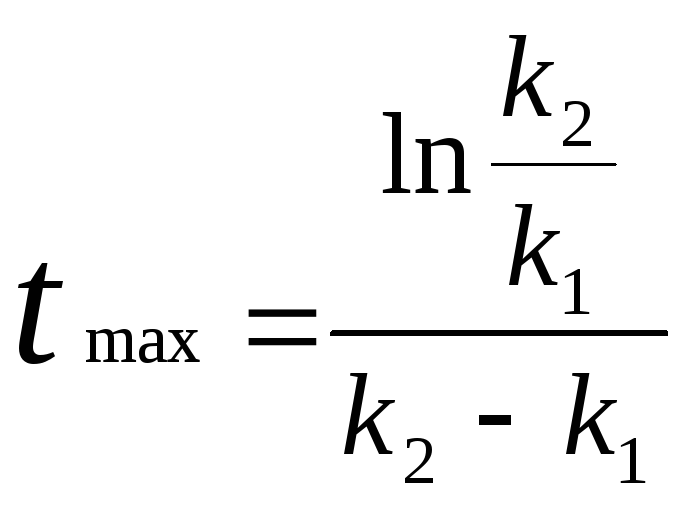 .
(3.23)
.
(3.23)
Из уравнения (3.23)
видно, что время, необходимое для
достижения максимального значения
СВ
зависит
от соотношения констант. Чем больше![]() k2
при данном постоянном значении k1,
тем скорее будет достигаться максимальная
концентрация СВ.
k2
при данном постоянном значении k1,
тем скорее будет достигаться максимальная
концентрация СВ.
Обратимся к
конечному продукту D.
Скорость его образования зависит от
концентрации вещества В:
![]() .
.
В начальный период, когда концентрация вещества В невелика, образование D идет с очень малой скоростью и аналитически не обнаруживается. Такой начальный период реакции называют периодом индукции, tинд.
Далее кривая имеет S-образный вид, максимальная скорость роста приходится на максимальную концентрацию В, то есть при tmax (B), здесь линия имеет перегиб и дальнейший рост концентрации D замедляется.
Любой процесс, состоящий из ряда последовательных стадий, определяется самой медленной стадией, тормозящей весь процесс. Эта стадия называется лимитирующей.
Выясним условия, когда одна стадия становится лимитирующей, определяющей выход продукта D. Запишем скорость образования D.
![]() (
e-k1t
- e-k2t).
(3.24)
(
e-k1t
- e-k2t).
(3.24)
Рассмотрим два крайних случая:
1. Если k1 « k2, то в уравнении (3.24) величиной k1 в знаменателе можно пренебречь. Поскольку e-k2t « e-k1t , то в скобках останется e-k1t. Таким образом,
![]() e-k1t
=
e-k1t
=
![]() ,
,
то есть скорость образования продукта определяется первой стадией, которая и будет в этих условиях лимитирующей.
2. Если k1 » k2, пренебрегаем в алгебраических суммах величинами k2 (в знаменателе) и e-k1t (в скобках).
![]() e-k2t,
e-k2t,
в данном случае лимитирующей стадией будет вторая.
