
- •Министерство образования и науки
- •1 Растворы
- •1.1 Основные понятия и определения
- •1.2 Способы выражения состава раствора
- •1.3 Закон Рауля. Идеальные растворы
- •1.4 Следствия из закона Рауля
- •1.4.1 Повышение температуры кипения идеального раствора
- •1.4.2 Понижение температуры замерзания раствора
- •1.5 Осмотическое давление
- •1.6 Реальные растворы
- •1.6.1 Отклонения от закона Рауля
- •1.6.2 Активность. Коэффициент активности
- •1.7 Растворимость
- •1.7.1 Растворимость твердых веществ в жидкости
- •1.7.2 Растворимость газов в жидкости
- •1.7.3 Взаимная растворимость жидкостей
- •1.8 Равновесие жидкий раствор – насыщенный пар в различных жидких смесях
- •1.8.1 Неограниченно смешивающиеся жидкости
- •1.8.1.1 Состав пара и жидкости. Законы Коновалова
- •1.8.1.2 Разделение бинарных смесей путем перегонки
- •1.8.2 Равновесие жидкость - пар для практически несмеши-вающихся жидкостей
- •1.8.3 Равновесие жидкость – пар для ограниченно смешивающихся жидкостей
- •1.9 Закон распределения Нернста. Экстракция
- •1.10 Примеры решения задач
- •1.11 Вопросы для самоконтроля
- •2 Электрохимия
- •2.1 Электрическая проводимость растворов электролитов
- •2.1.1 Сильные и слабые электролиты
- •2.1.2 Удельная электрическая проводимость
- •2.1.3 Молярная и эквивалентная электрические проводимости
- •2.1.4 Числа переноса
- •2.2 Кондуктометрия
- •2.2.1 Определение растворимости труднорастворимой соли
- •2.2.2 Определение предельной эквивалентной электрической проводимости растворов сильных электролитов
- •2.2.3 Кондуктометрическое титрование
- •2.3 Электродные процессы
- •2.3.1 Основные понятия и определения
- •2.3.2 Классификация электродов
- •2.3.3 Типы гальванических элементов
- •2.3.4 Диффузионный потенциал
- •2.3.5 Потенциометрическое титрование
- •2.4 Скорость электрохимической реакции
- •2.4.1 Поляризационные кривые
- •2.4.2 Перенапряжение
- •2.4.3 Электролиз
- •2.4.3.1 Электролиз водного раствора CuCl2
- •2.4.3.2 Электролиз водного раствора к2sо4 с использованием инертных анодов
- •2.4.3.3 Законы Фарадея
- •2.5 Примеры решения задач
- •2.6 Вопросы для самоконтроля
- •Кинетика
- •3.1 Скорость химической реакции
- •3.2 Кинетическая классификация химических реакций
- •3.2.1 Молекулярность реакции
- •3.2.2 Порядок реакции
- •3.3 Влияние температуры на скорость реакции. Энергия активации
- •3.4 Методы определения порядка реакции
- •3.5 Сложные реакции
- •3.5.1 Параллельные реакции
- •3.5.2 Обратимые реакции
- •3.5.3 Последовательные реакции
- •3.5.4 Сопряженные реакции
- •3.5.5 Метод стационарных концентраций
- •3.6 Примеры решения задач
- •3.7 Вопросы для самоконтроля
- •Литература
2.4.3.2 Электролиз водного раствора к2sо4 с использованием инертных анодов
В этом растворе имеются катионы К+ и Н+ анионы SО42- и ОН-. Изобразим схематически отрезки суммарных поляризационных кривых реакций на катоде и аноде в нейтральной среде, исходя из значений их равновесных потенциалов (рисунок 2.9).
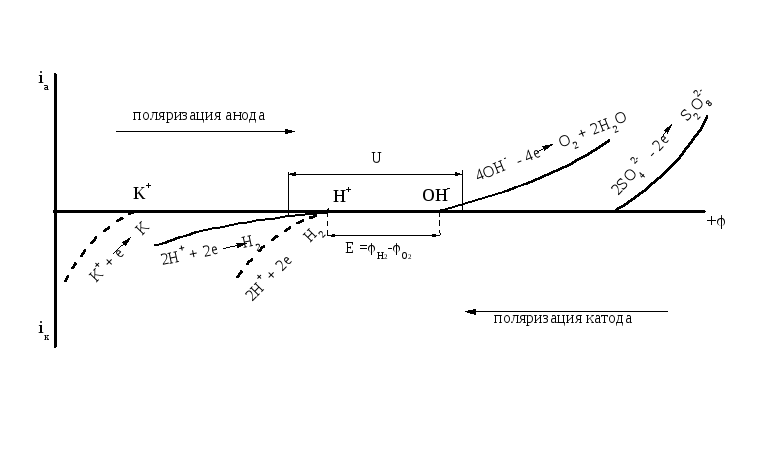
Рисунок 2.9 - Схематические поляризационные кривые реакций электролиза водного раствора К2SО4
Из рисунка 2.9 видно, что наименьшего отрицательного потенциала на катоде требует восстановление водорода: 2 Н+ + 2e → H2.
Восстановление ионов калия возможно при столь высоком отрицательном потенциале, что он практически недостижим в водном растворе.
Наименьшего положительного потенциала требует окисление ионов ОН- с образованием кислорода
4ОН- - 4e → O2 + 2H2O.
Окисление же аниона SО42-
2 SО42- - 2e → S2О82-,
при котором образуется анион надсерной кислоты, требует значительно большего сдвига потенциала и в обычных условиях электролиза не наблюдается.
Таким образом, при электролизе водного раствора К2SО4 на электродах выделяется водород и кислород, то есть происходит разложение воды.
Раствор в прикатодном пространстве называется католитом, в прианодном – анолитом.
Из прикатодного пространства исчезают ионы Н+ за счет восстановления и уходят к аноду ионы SО42-, таким образом в католите накапливаются ионы К+ и ОН-, то есть щелочь КОН.
Из прианодного пространства исчезают за счет окисления ионы ОН-, в анолите накапливаются Н+ и SО42-, то есть Н2SО4.
Если в электролизере установить пористые диафрагмы, отделяющие католит и анолит от средней части объема раствора, то можем получить эти вещества. При отсутствии диафрагмы они перемешиваются с образованием соли.
Обратимся к рисунку
2.9. Если внешняя ЭДС равна разности
потенциалов равновесных электродов
![]() ,
то на электродах не смогут протекать
реакции с образованием
Н2
и О2.
Для этого нужно чтобы ЭДС стала несколько
больше разности
,
то на электродах не смогут протекать
реакции с образованием
Н2
и О2.
Для этого нужно чтобы ЭДС стала несколько
больше разности
![]() ,
то естьU
(рисунок
2.9). Величина U
называется напряжением разложения.
На рисунке
даны две кривые для восстановления Н+:
сплошная – с большим перенапряжением
реакции, пунктирная – с малым
перенапряжением. Это зависит от выбора
материала катода. Как уже было отмечено
выше, на Pt
реакция восстановления Н+
идет с
малым перенапряжением, на других анодах
– с большим.
,
то естьU
(рисунок
2.9). Величина U
называется напряжением разложения.
На рисунке
даны две кривые для восстановления Н+:
сплошная – с большим перенапряжением
реакции, пунктирная – с малым
перенапряжением. Это зависит от выбора
материала катода. Как уже было отмечено
выше, на Pt
реакция восстановления Н+
идет с
малым перенапряжением, на других анодах
– с большим.
2.4.3.3 Законы Фарадея
Фарадеем установлены количественные законы электролиза.
Первый закон: «количество прореагировавшего при электролизе вещества пропорционально количеству прошедшего через раствор электричества»:
![]() ,
,
где m – масса вещества; Q - количество электричества;
К – электрохимический эквивалент.
![]() ,
,
![]() .
.
где i- плотность тока; S – площадь; t – время, с; М – молярная масса; F – число Фарадея, 96485 Кл; n – число электронов участвующих в электродной реакции.
Тогда первый закон Фарадея примет вид:
![]() .
(2.15)
.
(2.15)
Следует иметь в
виду, что масса вещества, рассчитанная
по уравнению (2.15) является теоретической.
На практике эта величина бывает больше
или меньше рассчитанной, то есть mфакт.
(масса фактическая). В связи с этим
вводится понятие – выход
по току,
анодный или катодный,
![]() или
или![]() .
.
![]() .
.
При умножении на 100 выход по току будет представлен в процентах, %.
Электрохимический эквивалент для сплавов рассчитывается по формуле:
![]() ,
,
где К1, К2 - электрохимические эквиваленты компонентов сплава;
W1, W2, …- массовые доли компонентов сплава.
Второй закон: «при определенном количестве прошедшего электричества отношение масс прореагировавших веществ равно отношению их химических эквивалентов, Э»:
![]() ,
,
![]() .
.
