
- •Министерство образования и науки
- •1 Растворы
- •1.1 Основные понятия и определения
- •1.2 Способы выражения состава раствора
- •1.3 Закон Рауля. Идеальные растворы
- •1.4 Следствия из закона Рауля
- •1.4.1 Повышение температуры кипения идеального раствора
- •1.4.2 Понижение температуры замерзания раствора
- •1.5 Осмотическое давление
- •1.6 Реальные растворы
- •1.6.1 Отклонения от закона Рауля
- •1.6.2 Активность. Коэффициент активности
- •1.7 Растворимость
- •1.7.1 Растворимость твердых веществ в жидкости
- •1.7.2 Растворимость газов в жидкости
- •1.7.3 Взаимная растворимость жидкостей
- •1.8 Равновесие жидкий раствор – насыщенный пар в различных жидких смесях
- •1.8.1 Неограниченно смешивающиеся жидкости
- •1.8.1.1 Состав пара и жидкости. Законы Коновалова
- •1.8.1.2 Разделение бинарных смесей путем перегонки
- •1.8.2 Равновесие жидкость - пар для практически несмеши-вающихся жидкостей
- •1.8.3 Равновесие жидкость – пар для ограниченно смешивающихся жидкостей
- •1.9 Закон распределения Нернста. Экстракция
- •1.10 Примеры решения задач
- •1.11 Вопросы для самоконтроля
- •2 Электрохимия
- •2.1 Электрическая проводимость растворов электролитов
- •2.1.1 Сильные и слабые электролиты
- •2.1.2 Удельная электрическая проводимость
- •2.1.3 Молярная и эквивалентная электрические проводимости
- •2.1.4 Числа переноса
- •2.2 Кондуктометрия
- •2.2.1 Определение растворимости труднорастворимой соли
- •2.2.2 Определение предельной эквивалентной электрической проводимости растворов сильных электролитов
- •2.2.3 Кондуктометрическое титрование
- •2.3 Электродные процессы
- •2.3.1 Основные понятия и определения
- •2.3.2 Классификация электродов
- •2.3.3 Типы гальванических элементов
- •2.3.4 Диффузионный потенциал
- •2.3.5 Потенциометрическое титрование
- •2.4 Скорость электрохимической реакции
- •2.4.1 Поляризационные кривые
- •2.4.2 Перенапряжение
- •2.4.3 Электролиз
- •2.4.3.1 Электролиз водного раствора CuCl2
- •2.4.3.2 Электролиз водного раствора к2sо4 с использованием инертных анодов
- •2.4.3.3 Законы Фарадея
- •2.5 Примеры решения задач
- •2.6 Вопросы для самоконтроля
- •Кинетика
- •3.1 Скорость химической реакции
- •3.2 Кинетическая классификация химических реакций
- •3.2.1 Молекулярность реакции
- •3.2.2 Порядок реакции
- •3.3 Влияние температуры на скорость реакции. Энергия активации
- •3.4 Методы определения порядка реакции
- •3.5 Сложные реакции
- •3.5.1 Параллельные реакции
- •3.5.2 Обратимые реакции
- •3.5.3 Последовательные реакции
- •3.5.4 Сопряженные реакции
- •3.5.5 Метод стационарных концентраций
- •3.6 Примеры решения задач
- •3.7 Вопросы для самоконтроля
- •Литература
3.5 Сложные реакции
Сложная реакция состоит из нескольких элементарных стадий, связанных друг с другом определенным образом через исходные вещества и промежуточные продукты.
В отношении сложных реакций в кинетике возникают две задачи.
Прямая задача. Известны механизм и константы скорости каждой элементарной стадии. Необходимо для конкретных условий (Т, Сi) описать кинетическое поведение каждого молекулярного продукта. Это достигается составлением и решением системы дифференциальных уравнений. Зная (вычислив) кинетические кривые для всех веществ, можно рассчитать скорость отдельных стадий для разных моментов времени протекания реакции.
Обратная задача. Экспериментально получают набор кинетических кривых и на основании полученных результатов проверяют предполагаемую схему реакции, определяют порядок и константу скорости каждой из стадий.
В сложных реакциях действует принцип независимости реакций, согласно которому: если в системе одновременно протекает несколько реакций, каждая из них независима от других реакций и будет протекать со скоростью, определяющейся своим дифференциальным уравнением и своей константой скорости.
Из этого принципа следует условие материального баланса: если в результате протекания химических реакций исчезает или появляется какой-либо компонент, то скорость изменения концентрации этого вещества будет равна алгебраической сумме скоростей его образования и расходования во всех стадиях, то есть
![]() (3.11)
(3.11)
где n – число элементарных стадий, в которых участвует i компонентов; νi – стехиометрический коэффициент i-го компонента в данной стадии, для исходных веществ νi < 0, для продуктов νi > 0; υ – скорость реакции в единичном объеме в данной стадии, определяется кинетическим уравнением
υ = k СаАСвВ
(А и В – исходные вещества в данной системе).
Рассмотрим пример.
k1
A
+ 1/2B
![]() C
+ 2D
C
+ 2D
![]() E.
E.
k2
Эта сложная реакция может быть расписана в две строчки
k1
A
+ 1/2B
![]() C
+ 2D,
C
+ 2D,
k2
C
+ 2D
![]() E.
E.
Обе записи тождественны.
Запишем условие материального баланса для компонента D. Он участвует в трех стадиях (n = 3) с константами скоростей k1, k2 и k3
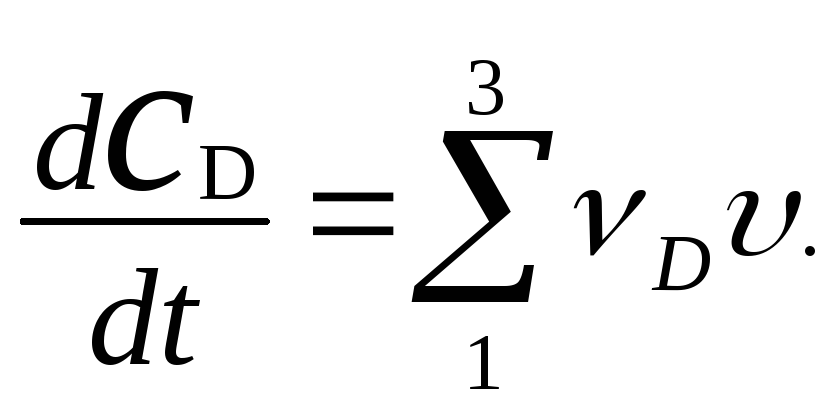
Таким образом, произведений νD . υ будет три. νD в реакции 1, где D является продуктом, равна +2; а в реакциях 2 и 3, где D является исходным веществом, νD = -2.
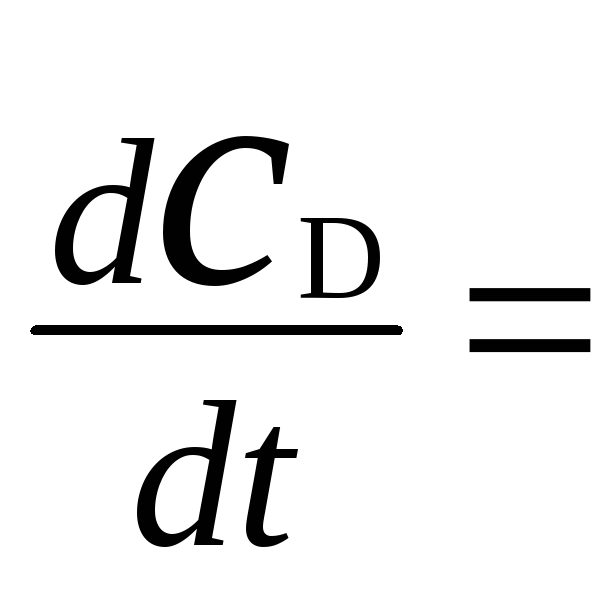 2k1CAC
2k1CAC![]() –
2k2CC
C
–
2k2CC
C![]() – 2k3CC
C
– 2k3CC
C![]() .
.
Аналогично для вещества В:
![]() = -
1/2 k1CAC
= -
1/2 k1CAC![]() + 1/2 k2CC
C
+ 1/2 k2CC
C![]() .
.
3.5.1 Параллельные реакции
При параллельных реакциях одно и то же вещество (или вещества) участвует в нескольких реакциях, давая различные продукты. Например, разложение бертолетовой соли возможно по двум реакциям
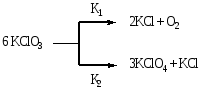
Рассмотрим простейший случай – две параллельные реакции первого порядка. Получим уравнения для расчета констант реакции k1 и k2:
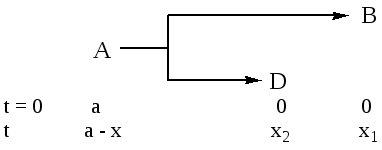
В начальный момент (t = 0) в системе присутствует только вещество А с концентрацией a, к моменту времени t концентрация a уменьшилась на x, появилось x1 вещества В и х2 вещества D.
Составим дифференциальное уравнение для вещества А. Решая его, найдем k1 и k2.
![]()
![]()
![]()
![]()

Составим дифференциальные уравнения для веществ В и D.
![]() (3.13)
(3.13)
![]() (3.14)
(3.14)
Разделив уравнение (3.13) на (3.14), получим
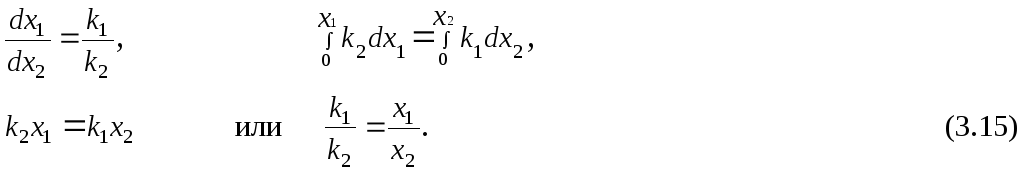
Решая систему уравнений (3.12) и (3.15), находим k1 и k2.
Поскольку взята реакция мономолекулярная, следовательно, количество израсходованного вещества А равно сумме получившихся веществ В и D, то есть х = х1 + х2
