
- •Министерство образования и науки
- •1 Растворы
- •1.1 Основные понятия и определения
- •1.2 Способы выражения состава раствора
- •1.3 Закон Рауля. Идеальные растворы
- •1.4 Следствия из закона Рауля
- •1.4.1 Повышение температуры кипения идеального раствора
- •1.4.2 Понижение температуры замерзания раствора
- •1.5 Осмотическое давление
- •1.6 Реальные растворы
- •1.6.1 Отклонения от закона Рауля
- •1.6.2 Активность. Коэффициент активности
- •1.7 Растворимость
- •1.7.1 Растворимость твердых веществ в жидкости
- •1.7.2 Растворимость газов в жидкости
- •1.7.3 Взаимная растворимость жидкостей
- •1.8 Равновесие жидкий раствор – насыщенный пар в различных жидких смесях
- •1.8.1 Неограниченно смешивающиеся жидкости
- •1.8.1.1 Состав пара и жидкости. Законы Коновалова
- •1.8.1.2 Разделение бинарных смесей путем перегонки
- •1.8.2 Равновесие жидкость - пар для практически несмеши-вающихся жидкостей
- •1.8.3 Равновесие жидкость – пар для ограниченно смешивающихся жидкостей
- •1.9 Закон распределения Нернста. Экстракция
- •1.10 Примеры решения задач
- •1.11 Вопросы для самоконтроля
- •2 Электрохимия
- •2.1 Электрическая проводимость растворов электролитов
- •2.1.1 Сильные и слабые электролиты
- •2.1.2 Удельная электрическая проводимость
- •2.1.3 Молярная и эквивалентная электрические проводимости
- •2.1.4 Числа переноса
- •2.2 Кондуктометрия
- •2.2.1 Определение растворимости труднорастворимой соли
- •2.2.2 Определение предельной эквивалентной электрической проводимости растворов сильных электролитов
- •2.2.3 Кондуктометрическое титрование
- •2.3 Электродные процессы
- •2.3.1 Основные понятия и определения
- •2.3.2 Классификация электродов
- •2.3.3 Типы гальванических элементов
- •2.3.4 Диффузионный потенциал
- •2.3.5 Потенциометрическое титрование
- •2.4 Скорость электрохимической реакции
- •2.4.1 Поляризационные кривые
- •2.4.2 Перенапряжение
- •2.4.3 Электролиз
- •2.4.3.1 Электролиз водного раствора CuCl2
- •2.4.3.2 Электролиз водного раствора к2sо4 с использованием инертных анодов
- •2.4.3.3 Законы Фарадея
- •2.5 Примеры решения задач
- •2.6 Вопросы для самоконтроля
- •Кинетика
- •3.1 Скорость химической реакции
- •3.2 Кинетическая классификация химических реакций
- •3.2.1 Молекулярность реакции
- •3.2.2 Порядок реакции
- •3.3 Влияние температуры на скорость реакции. Энергия активации
- •3.4 Методы определения порядка реакции
- •3.5 Сложные реакции
- •3.5.1 Параллельные реакции
- •3.5.2 Обратимые реакции
- •3.5.3 Последовательные реакции
- •3.5.4 Сопряженные реакции
- •3.5.5 Метод стационарных концентраций
- •3.6 Примеры решения задач
- •3.7 Вопросы для самоконтроля
- •Литература
2.3.4 Диффузионный потенциал
На границе двух растворов электролитов произвольного состава возникает скачок потенциала, называемый диффузионным потенциалом. Причиной его возникновения является различная подвижность ионов в растворах.
Рассмотрим два наиболее простых случая.
Граница растворов одного и того же электролита с различной концентрацией.
![]()
![]() ,
где a1
>
a2;
,
где a1
>
a2;
Граница растворов различных электролитов с одинаковой концентрацией.
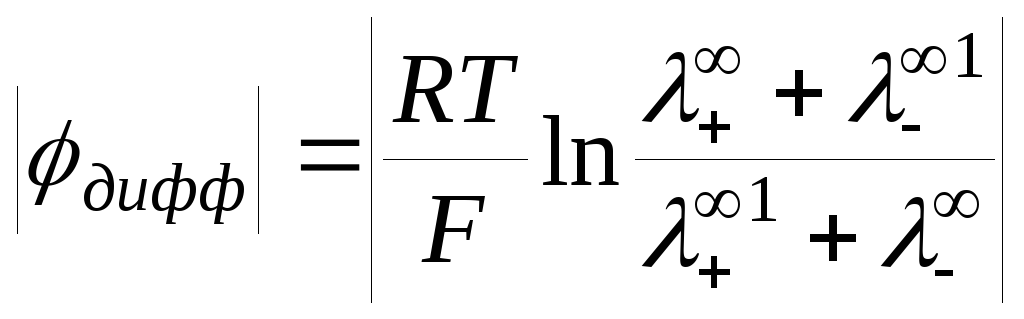 ,
,
где
![]() и
и![]() -
предельные подвижности ионов одного
электролита;
-
предельные подвижности ионов одного
электролита;![]() и
и![]() - предельные подвижности ионов другого
электролита.
- предельные подвижности ионов другого
электролита.
По этим формулам рассчитывается численное значение φдифф, но не его знак.
Выбор знака φдифф зависит от взаимного направления полей: 1) на границе двух растворов; 2) электродов.
Если направление полей совпадает, то φдифф > 0; если не совпадает, то φдифф < 0 (смотри раздел 2.5 задачи 4, 5).
На практике для того, чтобы снизить величину φдифф до пренебрежимо малой величины, граничащие растворы соединяют солевым мостиком с насыщенным раствором KCl или NH4NO3. Катионы и анионы этих солей обладают примерно равными подвижностями. В цепи наличие мостика обозначается двумя вертикальными чертами:
Zn │ ZnSO4 || CuSO4 │ Cu
2.3.5 Потенциометрическое титрование
Под потенциометрическим титрованием понимают метод определения эквивалентной точки на основе зависимости потенциала от объема добавленного титранта в исследуемую систему. По сравнению с индикаторным титрованием этот метод дает бóльшую точность, а также позволяет производить титрование окрашенных растворов и смеси веществ.
Для проведения потенциометрического титрования составляется электрохимическая цепь, состоящая из двух электродов: электрода сравнения и индикаторного электрода. Электрод сравнения должен иметь в процессе титрования постоянное значение потенциала, точно известное и легко воспроизводимое.
Таблица 2.1 - Электроды сравнения
|
Электрод сравнения |
|
|
H+ | H2, Pt |
0 |
|
Cl- | Hg2Cl2, Hg |
0,268 |
|
Cl- | AgCl, Ag |
0,222 |
|
SO42- | HgSO4, Hg |
-0,359 |
|
OH- | HgO, Hg |
0,098 |
Тип индикаторного электрода выбирается в зависимости от определяемых ионов. Индикаторный электрод должен быть обратимым относительно определяемого иона, тогда потенциал его будет чувствителен к изменению концентрации титруемого раствора.
При титровании используются реакции нейтрализации, осаждения, комплексообразования, окислительно – восстановительные. Рассмотрим некоторые из них.
Реакции нейтрализации используются для определения концентрации ионов Н+ или ОН-. Суть реакции нейтрализации состоит в уменьшении количества ионов Н+ (при титровании кислоты) или ОН- (при титровании щелочи):
Н+ + ОН- = Н2О.
В качестве индикаторного электрода следует брать электрод, обратимый относительно ионов Н+ (водородный):
![]() .
.
При титровании
кислоты
![]() будет уменьшаться, следовательно
будет уменьшаться, следовательно![]() тоже будет уменьшаться. Вблизи точки
эквивалентности это уменьшение происходит
особенно резко. При титровании следует
брать титрант по возможности
концентрированным, чтобы достичь более
резкого скачка (рисунок 2.5).
тоже будет уменьшаться. Вблизи точки
эквивалентности это уменьшение происходит
особенно резко. При титровании следует
брать титрант по возможности
концентрированным, чтобы достичь более
резкого скачка (рисунок 2.5).
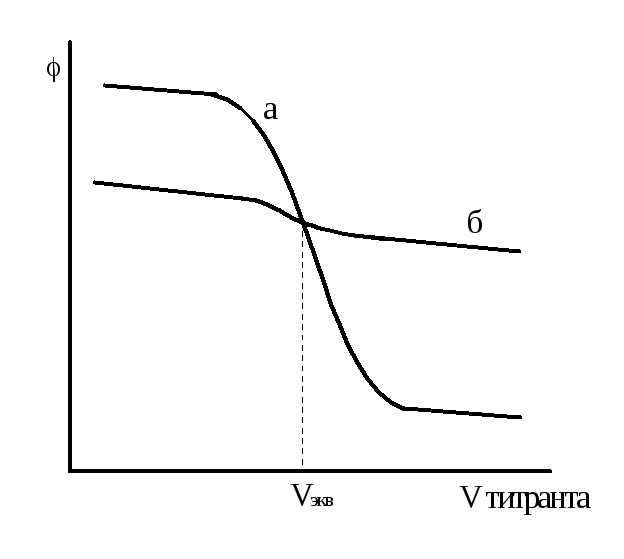
Рисунок 2.5 - Кривые титрования сильной кислоты: а) для концентрированных растворов кислоты и основания (скачок резкий); б) для разбавленных растворов (скачок слабый)
При титровании
щелочи уменьшается
![]() ,
которая связана ионным произведением
воды с
,
которая связана ионным произведением
воды с![]() :
:
![]() (при 298 К)
(при 298 К)
Таким образом,
уменьшение
![]() приводит к росту
приводит к росту![]() и потенциал водородного электрода будет
увеличиваться, давая резкий скачок в
точке эквивалентности.
и потенциал водородного электрода будет
увеличиваться, давая резкий скачок в
точке эквивалентности.
Реакции окисления – восстановления. При окислительно – восстановительном титровании в качестве индикаторного электрода берется редокс – электрод, потенциал которого изменяется по мере добавления титранта. Например, при титровании ионов Sn2+ раствором KMnO4 идет реакция:
5Sn2+ + 2MnO4- + 16H+ → 5 Sn4+ + 2Mn2+ + 8H2O.
До точки эквивалентности потенциал определяется исходной системой, то есть электродом Sn4+, Sn2+│Pt
Sn4+
+ 2e
![]() Sn2+
Sn2+
![]() .
.
Когда
![]() (оттитрована половина исходного
количестваSn2+)
(оттитрована половина исходного
количестваSn2+)
![]() .
По мере титрования появляются ионыMn2+,
а ионы MnO4-
исчезают. После точки эквивалентности
ионов Sn2+
нет, но появляются ионы MnO4-,
то есть образуется новый редокс –
электрод MnO4-,
Mn2+,
H+
│ Pt
.
По мере титрования появляются ионыMn2+,
а ионы MnO4-
исчезают. После точки эквивалентности
ионов Sn2+
нет, но появляются ионы MnO4-,
то есть образуется новый редокс –
электрод MnO4-,
Mn2+,
H+
│ Pt
MnO4-
+ 8H+
+ 5e
→ Mn2+
+ 4H2O
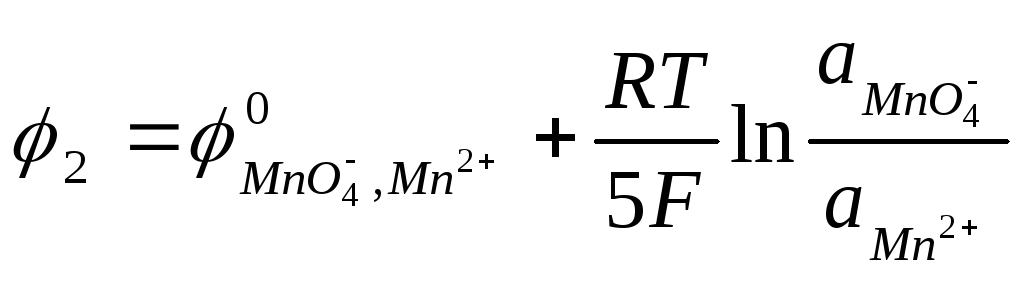 .
.
Когда
![]() (после точки эквивалентности добавлен
избытокKMnO4
в количестве, равном объему, израсходованному
до точки эквивалентности)
(после точки эквивалентности добавлен
избытокKMnO4
в количестве, равном объему, израсходованному
до точки эквивалентности)
![]() (
рисунок 2.6).
(
рисунок 2.6).
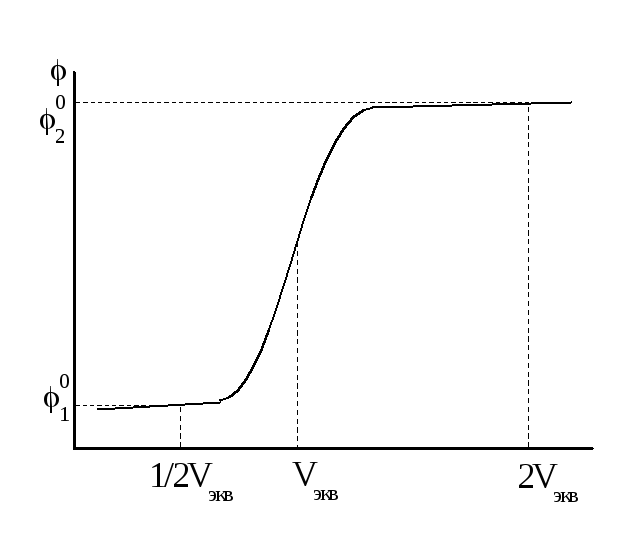
Рисунок 2.6 - Кривая окислительно – восстановительного титрования
