
- •Министерство образования и науки
- •1 Растворы
- •1.1 Основные понятия и определения
- •1.2 Способы выражения состава раствора
- •1.3 Закон Рауля. Идеальные растворы
- •1.4 Следствия из закона Рауля
- •1.4.1 Повышение температуры кипения идеального раствора
- •1.4.2 Понижение температуры замерзания раствора
- •1.5 Осмотическое давление
- •1.6 Реальные растворы
- •1.6.1 Отклонения от закона Рауля
- •1.6.2 Активность. Коэффициент активности
- •1.7 Растворимость
- •1.7.1 Растворимость твердых веществ в жидкости
- •1.7.2 Растворимость газов в жидкости
- •1.7.3 Взаимная растворимость жидкостей
- •1.8 Равновесие жидкий раствор – насыщенный пар в различных жидких смесях
- •1.8.1 Неограниченно смешивающиеся жидкости
- •1.8.1.1 Состав пара и жидкости. Законы Коновалова
- •1.8.1.2 Разделение бинарных смесей путем перегонки
- •1.8.2 Равновесие жидкость - пар для практически несмеши-вающихся жидкостей
- •1.8.3 Равновесие жидкость – пар для ограниченно смешивающихся жидкостей
- •1.9 Закон распределения Нернста. Экстракция
- •1.10 Примеры решения задач
- •1.11 Вопросы для самоконтроля
- •2 Электрохимия
- •2.1 Электрическая проводимость растворов электролитов
- •2.1.1 Сильные и слабые электролиты
- •2.1.2 Удельная электрическая проводимость
- •2.1.3 Молярная и эквивалентная электрические проводимости
- •2.1.4 Числа переноса
- •2.2 Кондуктометрия
- •2.2.1 Определение растворимости труднорастворимой соли
- •2.2.2 Определение предельной эквивалентной электрической проводимости растворов сильных электролитов
- •2.2.3 Кондуктометрическое титрование
- •2.3 Электродные процессы
- •2.3.1 Основные понятия и определения
- •2.3.2 Классификация электродов
- •2.3.3 Типы гальванических элементов
- •2.3.4 Диффузионный потенциал
- •2.3.5 Потенциометрическое титрование
- •2.4 Скорость электрохимической реакции
- •2.4.1 Поляризационные кривые
- •2.4.2 Перенапряжение
- •2.4.3 Электролиз
- •2.4.3.1 Электролиз водного раствора CuCl2
- •2.4.3.2 Электролиз водного раствора к2sо4 с использованием инертных анодов
- •2.4.3.3 Законы Фарадея
- •2.5 Примеры решения задач
- •2.6 Вопросы для самоконтроля
- •Кинетика
- •3.1 Скорость химической реакции
- •3.2 Кинетическая классификация химических реакций
- •3.2.1 Молекулярность реакции
- •3.2.2 Порядок реакции
- •3.3 Влияние температуры на скорость реакции. Энергия активации
- •3.4 Методы определения порядка реакции
- •3.5 Сложные реакции
- •3.5.1 Параллельные реакции
- •3.5.2 Обратимые реакции
- •3.5.3 Последовательные реакции
- •3.5.4 Сопряженные реакции
- •3.5.5 Метод стационарных концентраций
- •3.6 Примеры решения задач
- •3.7 Вопросы для самоконтроля
- •Литература
2.4 Скорость электрохимической реакции
В отличие от обычной гомогенной химической реакции, протекающей во всех точках объема раствора, где есть реагирующие вещества, электрохимическая реакция идет на границе раздела между электродом и раствором, то есть является гетерогенной реакцией. Как и всякая гетерогенная реакция, она является многостадийной. Из множества последовательных стадий выделим три главные стадии: 1) подвод вещества к электроду; 2) собственно электрохимическая стадия, связанная с переносом электронов или ионов через границу раздела фаз (стадия разряда - ионизации); 3) образование конечного продукта процесса (образование и удаление молекул газа, образование кристаллической решетки твердого тела, отвод иона от поверхности в глубь раствора).
Первая и третья стадии имеют одинаковые закономерности и называются стадиями массопереноса.
Скорость многостадийного процесса определяется скоростью самой медленной стадии, которая называется лимитирующей. В данном разделе будем рассматривать электродный процесс, где лимитирующей стадией является вторая стадия, то есть стадия разряда – ионизации.
Рассмотрим сначала скорость электрохимической реакции, протекающей на металлическом электроде, погруженном в раствор его собственной соли. При установлении равновесия при равновесном потенциале протекание реакций окисления (анодный процесс) и восстановления (катодный процесс) не прекращается, но скорости этих реакций равны. При этом не происходит макроскопических изменений состава и массы отдельных фаз системы. Протекание процесса, приводящего к макроскопическим изменениям, возможно лишь при потенциале отличном от равновесного, когда скорости окисления и восстановления не равны друг другу. Разность этих скоростей и будет общей скоростью процесса, которая тем больше, чем больше смещен потенциал от равновесного.
Скорость гетерогенной реакции на единице поверхности может быть выражена уравнением
![]() ,
,
где К – константа скорости; Е – энергия активации; С – концентрация реагирующего вещества в слое жидкости, прилегающем к поверхности.
Скорость процесса измеряется числом ионов, переходящих из фазы в фазу с единицы поверхности в единицу времени. Поэтому скорость окисления (υа ) и восстановления (υk) можно измерять плотностью тока.
Скорость восстановления, катодный процесс:
![]() (2.15)
(2.15)
Скорость окисления, анодный процесс:
![]() (2.16)
(2.16)
В уравнение (2.16) в явном виде не входит концентрация раствора, так как активность твердого металла равна единице и во времени не меняется (в случае растворения металла).
2.4.1 Поляризационные кривые
В уравнениях (2.15 и 2.16) энергия активации электрохимических реакций зависит от сдвига потенциала от равновесного. В этом заключается важнейшая особенность электродных реакций по сравнению с обычными химическими. Изменяя потенциал, можно плавно изменить энергию активации и скорость реакции. В обычных же химических реакциях невозможно непосредственно влиять на энергию активации.
Учитывая связь энергии активации и сдвига потенциала, можно получить уравнения зависимости скорости реакции от сдвига потенциала от равновесного:
![]()
Эти величины можно представить графически в виде, так называемых, частных поляризационных кривых. По оси абсцисс отложен потенциал, отсчитанный от водородного нуля. По оси ординат - плотность тока анодного и катодного, то есть скорости анодного и катодного процессов.
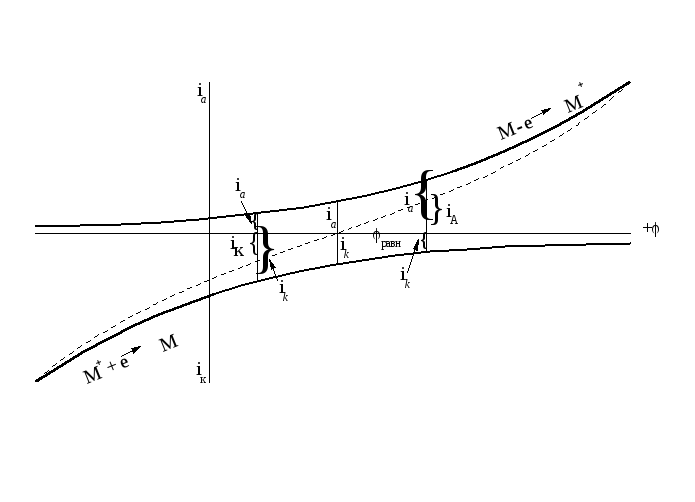
Рисунок 2.6 - Поляризационные кривые: частные (сплошные линии) и суммарная (пунктирная линия)
При φ = φравн. ik = ia = io (ток обмена).
Суммарная скорость равна 0. При сдвиге потенциала от равновесного в положительную сторону ia > ik, суммарный процесс будет анодным со скоростью iA = ia - ik. При сдвиге потенциала в отрицательную сторону от равновесного преобладать будет катодный процесс, и суммарная скорость будет iK = ik - ia.
Суммарные скорости дают суммарную поляризационную кривую (пунктир на рисунке 2.6).
Замерить катодный и анодный токи ik и ia невозможно. Амперметр замеряет суммарный анодный, iA, или катодный, iK, ток. При φ = φравн. амперметр покажет отсутствие тока.
