
- •Министерство образования и науки
- •1 Растворы
- •1.1 Основные понятия и определения
- •1.2 Способы выражения состава раствора
- •1.3 Закон Рауля. Идеальные растворы
- •1.4 Следствия из закона Рауля
- •1.4.1 Повышение температуры кипения идеального раствора
- •1.4.2 Понижение температуры замерзания раствора
- •1.5 Осмотическое давление
- •1.6 Реальные растворы
- •1.6.1 Отклонения от закона Рауля
- •1.6.2 Активность. Коэффициент активности
- •1.7 Растворимость
- •1.7.1 Растворимость твердых веществ в жидкости
- •1.7.2 Растворимость газов в жидкости
- •1.7.3 Взаимная растворимость жидкостей
- •1.8 Равновесие жидкий раствор – насыщенный пар в различных жидких смесях
- •1.8.1 Неограниченно смешивающиеся жидкости
- •1.8.1.1 Состав пара и жидкости. Законы Коновалова
- •1.8.1.2 Разделение бинарных смесей путем перегонки
- •1.8.2 Равновесие жидкость - пар для практически несмеши-вающихся жидкостей
- •1.8.3 Равновесие жидкость – пар для ограниченно смешивающихся жидкостей
- •1.9 Закон распределения Нернста. Экстракция
- •1.10 Примеры решения задач
- •1.11 Вопросы для самоконтроля
- •2 Электрохимия
- •2.1 Электрическая проводимость растворов электролитов
- •2.1.1 Сильные и слабые электролиты
- •2.1.2 Удельная электрическая проводимость
- •2.1.3 Молярная и эквивалентная электрические проводимости
- •2.1.4 Числа переноса
- •2.2 Кондуктометрия
- •2.2.1 Определение растворимости труднорастворимой соли
- •2.2.2 Определение предельной эквивалентной электрической проводимости растворов сильных электролитов
- •2.2.3 Кондуктометрическое титрование
- •2.3 Электродные процессы
- •2.3.1 Основные понятия и определения
- •2.3.2 Классификация электродов
- •2.3.3 Типы гальванических элементов
- •2.3.4 Диффузионный потенциал
- •2.3.5 Потенциометрическое титрование
- •2.4 Скорость электрохимической реакции
- •2.4.1 Поляризационные кривые
- •2.4.2 Перенапряжение
- •2.4.3 Электролиз
- •2.4.3.1 Электролиз водного раствора CuCl2
- •2.4.3.2 Электролиз водного раствора к2sо4 с использованием инертных анодов
- •2.4.3.3 Законы Фарадея
- •2.5 Примеры решения задач
- •2.6 Вопросы для самоконтроля
- •Кинетика
- •3.1 Скорость химической реакции
- •3.2 Кинетическая классификация химических реакций
- •3.2.1 Молекулярность реакции
- •3.2.2 Порядок реакции
- •3.3 Влияние температуры на скорость реакции. Энергия активации
- •3.4 Методы определения порядка реакции
- •3.5 Сложные реакции
- •3.5.1 Параллельные реакции
- •3.5.2 Обратимые реакции
- •3.5.3 Последовательные реакции
- •3.5.4 Сопряженные реакции
- •3.5.5 Метод стационарных концентраций
- •3.6 Примеры решения задач
- •3.7 Вопросы для самоконтроля
- •Литература
1 Растворы
1.1 Основные понятия и определения
Раствор – это многокомпонентная, гомогенная, термодинамически равновесная система, образованная за счет всех возможных сил взаимодействия между всеми составляющими ее частицами.
Раствор образуется из компонентов самопроизвольно. Поэтому, его образование при постоянных температуре и давлении, идет с уменьшением энергии Гиббса. Величина энергии Гиббса одного моля раствора зависит от состава (рисунок 1.1)
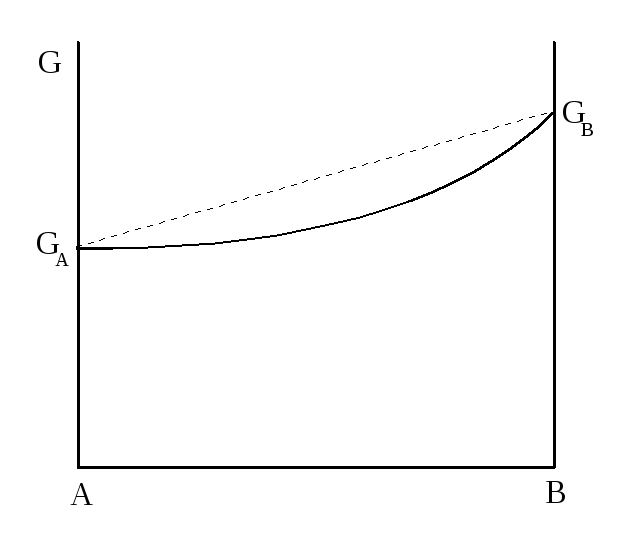
Рисунок 1.1 - Энергия Гиббса бинарного раствора
Пунктирная линия - энергия Гиббса системы из несмешивающихся компонентов А и В. Кривая линия - энергия Гиббса гомогенной системы, все ее точки лежат ниже прямой линии.
1.2 Способы выражения состава раствора
Состав раствора выражается различными способами:
а) в виде долей или процентов.
Массовая доля Wi и массовый процент Wi, (%)
![]() ,
,
![]() ,
,
где
![]() -
массаi-го
компонента и масса всего раствора.
-
массаi-го
компонента и масса всего раствора.
Объемная
доля
![]() и объемный процент
и объемный процент
![]() ,
(%)
,
(%)
![]()
![]()
![]() ,
,
где Vi, Vобш – объем i-гo компонента и общий объем раствора.
Молярная доля Xi и молярный процент Xi, (%)
![]()
![]() ,
,
где
![]() -
количество i-гo
компонента и общее количество всех
компонентов раствора;
-
количество i-гo
компонента и общее количество всех
компонентов раствора;
б) в виде концентраций.
Молярная концентрация, С, моль/м3; моль/л - это количество вещества в единице объема раствора:
![]() .
.
Примеры обозначения: С(Н2SO4) = 0,1 моль/л; C(NH4+) = 20 моль/л;
Молярная концентрация эквивалента (нормальность) - то же, что и молярная концентрация, но в качестве структурной единицы взят эквивалент.
В некоторых реакциях, в частности, нейтрализации, окисления-восстановления, ионного обмена, принимает участие не целая частица, а лишь ее часть, называемая эквивалентом. Эквивалент есть 1/Z часть молекулы. При Z = 1 эквивалент идентичен самой частице. Число Z называется числом эквивалентности.
Пример обозначения:
С(![]() Н2SO4)
= 0,1 моль/л.
Н2SO4)
= 0,1 моль/л.
Молярная концентрация
эквивалента больше или равна молярной
концентрации. Так, С(![]() Н2SO4)
= 2С(Н2SO4);
С(НСl)
= С(НСl).
В первом случае число эквивалентности
равно двум, во втором случае - единице.
Н2SO4)
= 2С(Н2SO4);
С(НСl)
= С(НСl).
В первом случае число эквивалентности
равно двум, во втором случае - единице.
Массовая концентрация - масса данного вещества в единице объема раствора (не путать с плотностью):
![]() ,
кг/м3;
,
кг/м3;
![]() .
.
Моляльность - количество вещества в 1 кг растворителя:
bi![]() .
.
Пример обозначения: b(H2S04 /H20) = 0,1 моль/кг. Часто в литературе моляльность обозначается "m". Однако, согласно ГОСТ 8.417-2002, моляльность (в отличие от массы) должна обозначаться b.
1.3 Закон Рауля. Идеальные растворы
Свойства
растворов являются сложной функцией
состава, температуры, давления
и в значительной мере определяются
характером межмолекулярных взаимодействий,
главным образом, соотношением энергий
взаимодействия между
одно- и разнородными частицами![]() .
Предсказать свойстварастворов,
зная их состав и свойства компонентов,
удается лишь для простейших случаев -
идеальных растворов. Они получаются из
веществ с одинаковыми размерами молекул
и энергиями межчастичных взаимодействий:
.
Предсказать свойстварастворов,
зная их состав и свойства компонентов,
удается лишь для простейших случаев -
идеальных растворов. Они получаются из
веществ с одинаковыми размерами молекул
и энергиями межчастичных взаимодействий:
![]() .
.
При
этом смешение не сопровождается тепловым
эффектом, Нсмеш
= 0,
изменением
объема при смешении
![]()
![]() .
.
При анализе результатов измерений давления насыщенного пара растворов нелетучих веществ Ф. Рауль обнаружил, что:
«Парциальное давление насыщенного пара растворителя над раствором пропорционально его молярной доле в растворе»:
![]() ,
,
где К
- коэффициент пропорциональности, равный
![]() -
давлению пара чистого растворителя.
-
давлению пара чистого растворителя.
![]() .
(1.1)
.
(1.1)
Эта закономерность получила название закона Рауля.
Примечание: в термодинамике принято цифрой 1 обозначать растворитель; цифрой 2 – растворенное вещество.
Растворы, в которых оба компонента летучи и каждый из них подчиняется закону Рауля, являются идеальными.
Линейная зависимость парциального давления от состава приводит к линейной зависимости и общего давления от состава (рисунок 1.2). Так, для системы А - В:
![]()
![]() ;
;
![]() .
(1.2)
.
(1.2)
Поскольку ХА + Хв = 1,
![]() .
.
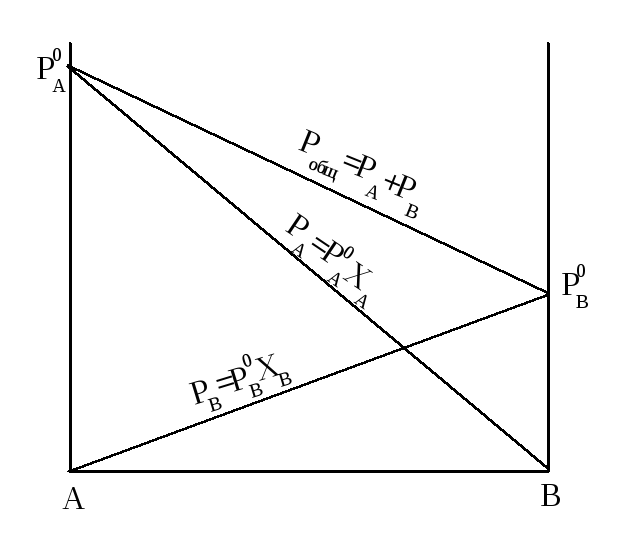
Рисунок 1.2-Зависимость парциальных и общего давления паров от состава идеального раствора
Часто закон Рауля используется в виде уравнения:
![]()
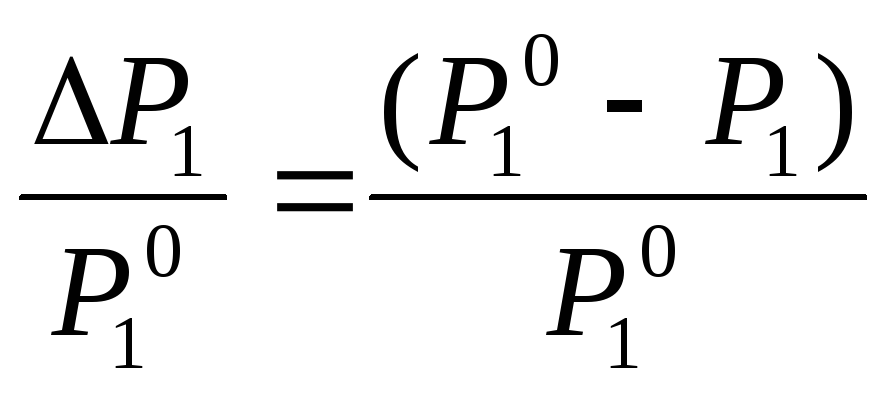 = Х2,
(1.3)
= Х2,
(1.3)
что отвечает формулировке:
«Относительное понижение давления пара растворителя над раствором равно молярной доле растворенного вещества».
