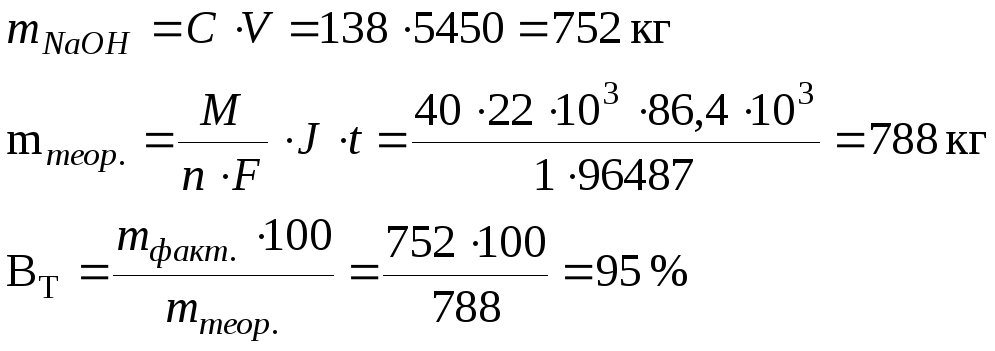- •Министерство образования и науки
- •1 Растворы
- •1.1 Основные понятия и определения
- •1.2 Способы выражения состава раствора
- •1.3 Закон Рауля. Идеальные растворы
- •1.4 Следствия из закона Рауля
- •1.4.1 Повышение температуры кипения идеального раствора
- •1.4.2 Понижение температуры замерзания раствора
- •1.5 Осмотическое давление
- •1.6 Реальные растворы
- •1.6.1 Отклонения от закона Рауля
- •1.6.2 Активность. Коэффициент активности
- •1.7 Растворимость
- •1.7.1 Растворимость твердых веществ в жидкости
- •1.7.2 Растворимость газов в жидкости
- •1.7.3 Взаимная растворимость жидкостей
- •1.8 Равновесие жидкий раствор – насыщенный пар в различных жидких смесях
- •1.8.1 Неограниченно смешивающиеся жидкости
- •1.8.1.1 Состав пара и жидкости. Законы Коновалова
- •1.8.1.2 Разделение бинарных смесей путем перегонки
- •1.8.2 Равновесие жидкость - пар для практически несмеши-вающихся жидкостей
- •1.8.3 Равновесие жидкость – пар для ограниченно смешивающихся жидкостей
- •1.9 Закон распределения Нернста. Экстракция
- •1.10 Примеры решения задач
- •1.11 Вопросы для самоконтроля
- •2 Электрохимия
- •2.1 Электрическая проводимость растворов электролитов
- •2.1.1 Сильные и слабые электролиты
- •2.1.2 Удельная электрическая проводимость
- •2.1.3 Молярная и эквивалентная электрические проводимости
- •2.1.4 Числа переноса
- •2.2 Кондуктометрия
- •2.2.1 Определение растворимости труднорастворимой соли
- •2.2.2 Определение предельной эквивалентной электрической проводимости растворов сильных электролитов
- •2.2.3 Кондуктометрическое титрование
- •2.3 Электродные процессы
- •2.3.1 Основные понятия и определения
- •2.3.2 Классификация электродов
- •2.3.3 Типы гальванических элементов
- •2.3.4 Диффузионный потенциал
- •2.3.5 Потенциометрическое титрование
- •2.4 Скорость электрохимической реакции
- •2.4.1 Поляризационные кривые
- •2.4.2 Перенапряжение
- •2.4.3 Электролиз
- •2.4.3.1 Электролиз водного раствора CuCl2
- •2.4.3.2 Электролиз водного раствора к2sо4 с использованием инертных анодов
- •2.4.3.3 Законы Фарадея
- •2.5 Примеры решения задач
- •2.6 Вопросы для самоконтроля
- •Кинетика
- •3.1 Скорость химической реакции
- •3.2 Кинетическая классификация химических реакций
- •3.2.1 Молекулярность реакции
- •3.2.2 Порядок реакции
- •3.3 Влияние температуры на скорость реакции. Энергия активации
- •3.4 Методы определения порядка реакции
- •3.5 Сложные реакции
- •3.5.1 Параллельные реакции
- •3.5.2 Обратимые реакции
- •3.5.3 Последовательные реакции
- •3.5.4 Сопряженные реакции
- •3.5.5 Метод стационарных концентраций
- •3.6 Примеры решения задач
- •3.7 Вопросы для самоконтроля
- •Литература
2.5 Примеры решения задач
При решении задач мы используем справочные значения констант диссоциации, Кдисс; произведения растворимости солей, ПР; водородный показатель, рН; ионное произведение воды, Кw.
При расчете этих величин были взяты концентрации, единицей измерения которых является моль/л, а не моль/м3 (не в системе СИ). Поэтому концентрации, полученные из этих значений, следует, если это необходимо, перевести в систему СИ.
Задача 1
Константа диссоциации уксусной кислоты равна 1,8·10-5. Чему равен рН раствора, если к 1 л раствора кислоты (С = 1 моль/л) добавить 8,2·10-3 кг ацетата натрия? Считать, что объем раствора не изменится при добавлении соли.
Дано:
Кд = 1,8·10-5
Vраствора= 1 л
Скислоты = 1 моль/л
mсоли =8,2·10-3 кг
рН - ?
Решение
В системе имеется кислота, которая диссоциирует частично, и соль, которая диссоциирует нацело.
СН3СООН
![]() СН3СОО-
+ Н+
СН3СОО-
+ Н+
С до реакции 1 0 0
С при равновесии 1-х х х
СН3СООNa
![]() СН3СОО-
+ Na+
СН3СОО-
+ Na+
С до реакции 0,10 0 0
С после диссоциации 0 0,10 0,10
![]() моль
моль
В условии дана константа диссоциации термодинамическая, то есть Ка. Без большой погрешности можно считать а = с и Ка = Кс.
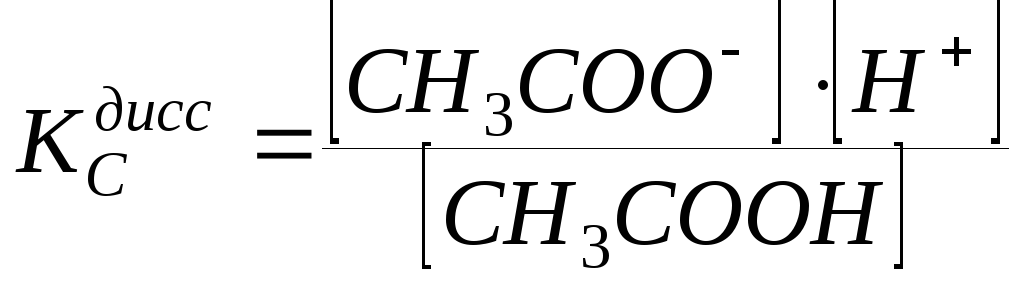
Ацетат ион, СН3СОО-,
образуется за счет диссоциации как
кислоты так и соли, то есть
![]() ,
,
![]() .
.
Поскольку электролит является слабым, то количество продиссоциированного электролита, х, мало, и в алгебраических суммах им с небольшой погрешностью можно пренебречь. Тогда:
![]()
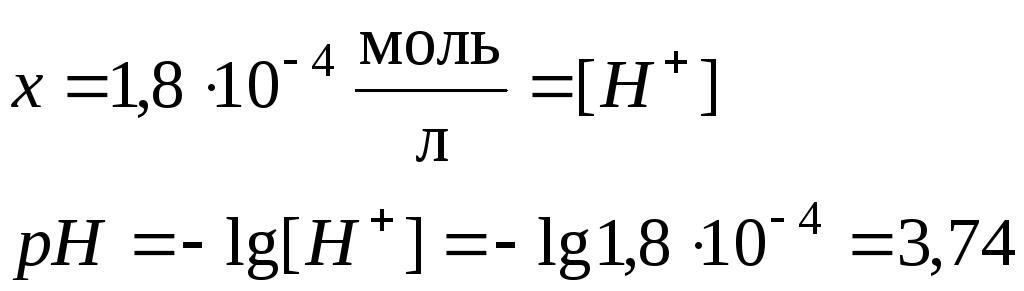
Задача 2
Предельная
электрическая проводимость водного
раствора NH4Cl
равна 130·10-4
![]() .
Подвижности ионовОН-
и
Cl-
соответственно равны 174·10-4
и 65,4·10-4
.
Подвижности ионовОН-
и
Cl-
соответственно равны 174·10-4
и 65,4·10-4
![]() .
Вычислить предельную электрическую
проводимостьNH4ОН
и число переноса иона NH4+
в растворе NH4Cl
при бесконечном разведении.
.
Вычислить предельную электрическую
проводимостьNH4ОН
и число переноса иона NH4+
в растворе NH4Cl
при бесконечном разведении.
Дано:
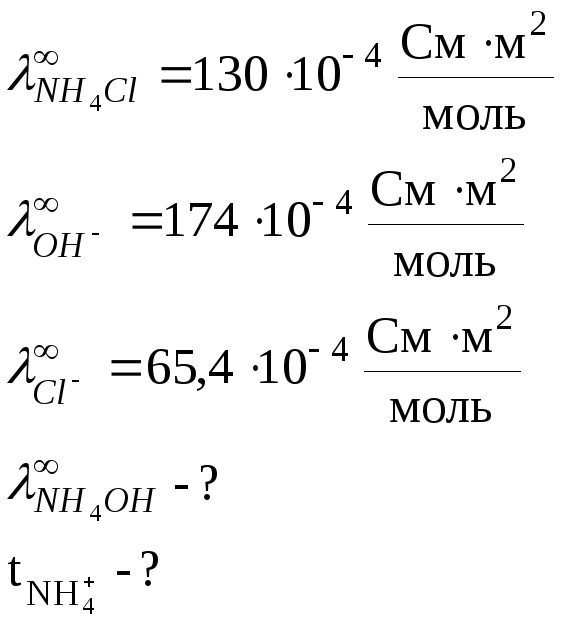
Решение:
Согласно
закону Кольрауша:
![]() .
.
Для
нахождения
![]() запишем закон Кольрауша дляNH4Cl:
запишем закон Кольрауша дляNH4Cl:
![]() .
.
Откуда
![]() .
.
Таким образом,
![]()
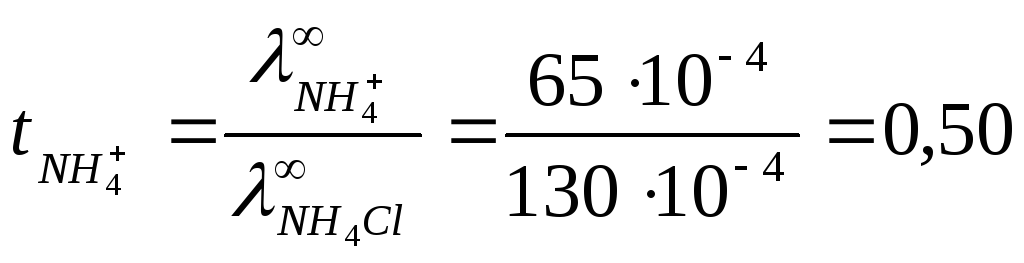 .
.
Задача 3
Определить теплоту диссоциации уксусной кислоты, если удельное сопротивление раствора кислоты (С = 0,01 моль/л) при 298 К равно 61,0 Ом·м, а при 288 К равно 83,7 Ом·м.
Дано:
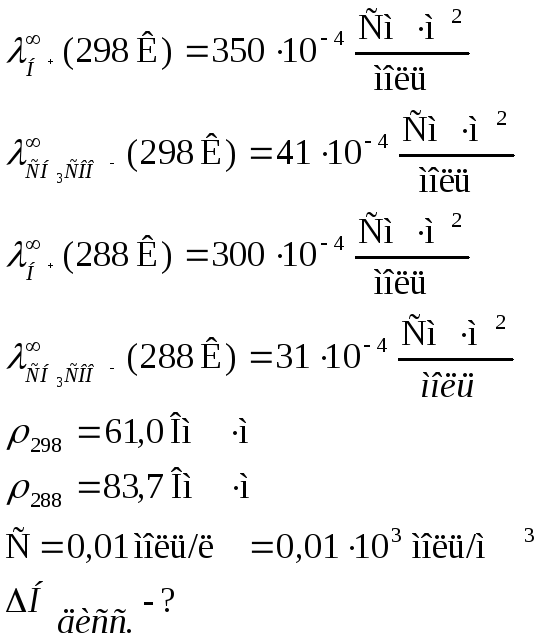
Решение:
Теплота реакции диссоциации кислоты определяется из уравнения изобары Вант Гоффа в интегральном виде:
![]()
Для решения надо рассчитать константы диссоциации при двух температурах, используя уравнения:
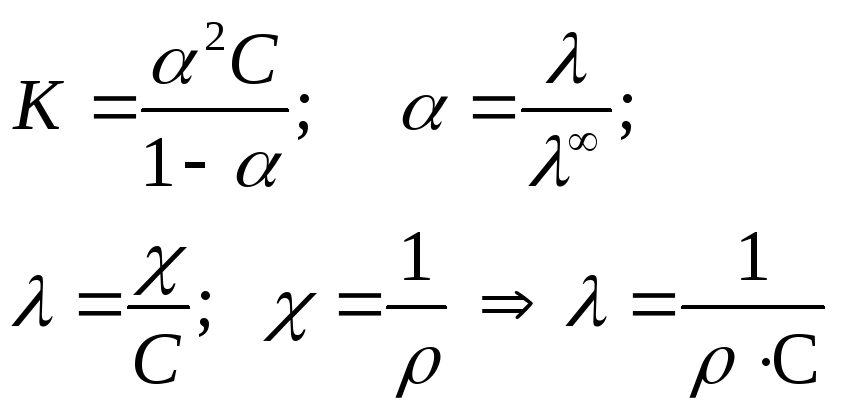
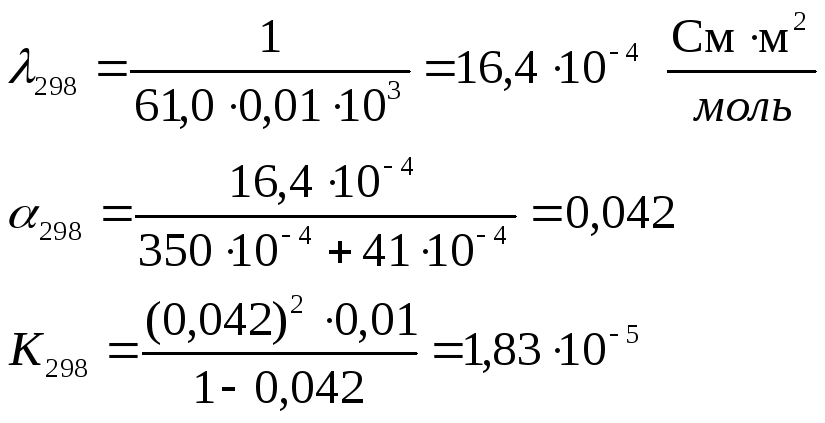
Аналогично рассчитываем для 288 К:
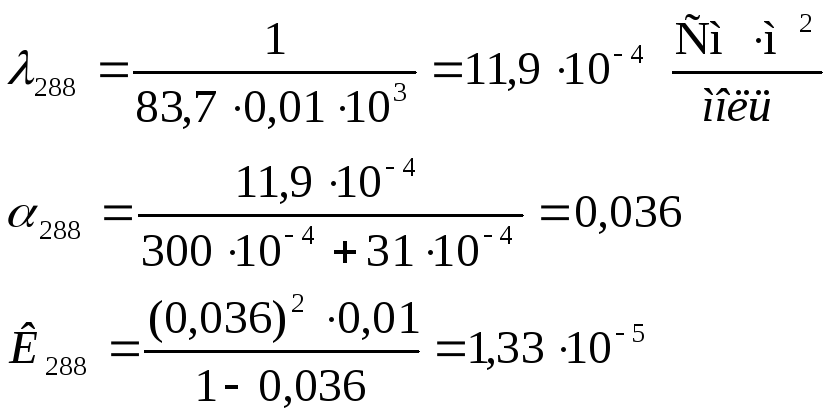
![]()
Задача 4
Вычислить ЭДС элемента, составленного из хлорсеребряного электрода в растворе НСl (С = 0,01 моль/л) и водородного электрода в растворе НСl (С = 0,50 моль/л), с учетом диффузионного потенциала при 25 0С.
Дано:
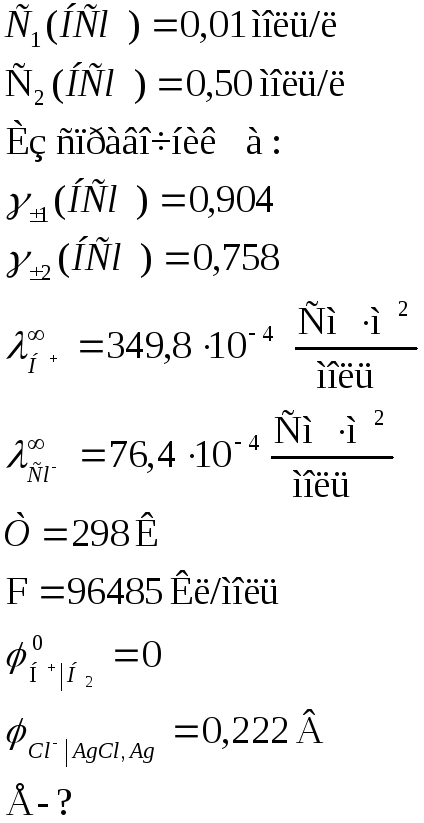
Решение:
Составляем
гальваническую цепь из газового
электрода, и электрода второго рода.
Определяем знаки электродов из сравнения
значений
![]() .
Записываем реакции на электродах
согласно их знакам:
.
Записываем реакции на электродах
согласно их знакам:
![]()
![]()
![]() = 0
= 0
![]() = 0,222 В
= 0,222 В
С2=0,50 С1=0,01
Н2 – 2е → 2Н+ 2AgCl + 2e → 2Ag+ + 2Cl-
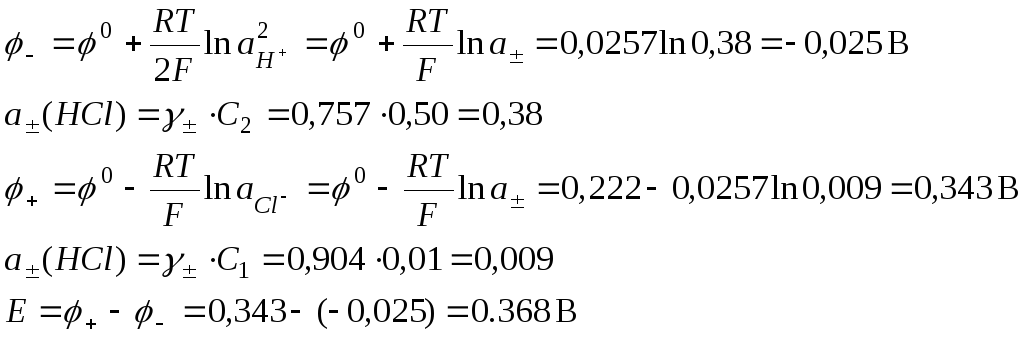
Это значение ЭДС без учета диффузионного потенциала.
В данном случае φдифф возникает на границе двух растворов электролитов одинаковых по химической природе, но с различными концентрациями.
![]()
Полученная величина - значение φдифф по модулю.
Для определения
знака φдифф
рассмотрим направление электрического
поля на границе растворов (см. гальваническую
цепь). Поскольку С2
> С1,
диффузия HCl
будет идти слева направо, при этом ионы
Н+,
имеющие большую подвижность,
![]() ,
будут опережать ионыСl-,
образуя двойной электрический слой
(ДЭС) на границе растворов с положительной
правой обкладкой (см. цепь) и отрицательной
левой. Таким образом, направление поля
ДЭС и направление поля электродов
совпадает и φдифф
> 0.
,
будут опережать ионыСl-,
образуя двойной электрический слой
(ДЭС) на границе растворов с положительной
правой обкладкой (см. цепь) и отрицательной
левой. Таким образом, направление поля
ДЭС и направление поля электродов
совпадает и φдифф
> 0.
![]()
Задача 5
Рассчитать диффузионный потенциал гальванической цепи и определить его знак.
![]()
если СКСl = 0,01, CCuSO4 = 0,01 моль/л.
Справочные данные:

Решение:
Поскольку граничащие растворы различаются по химической природе, а их концентрации одинаковы, то расчет φдифф производится по формуле:
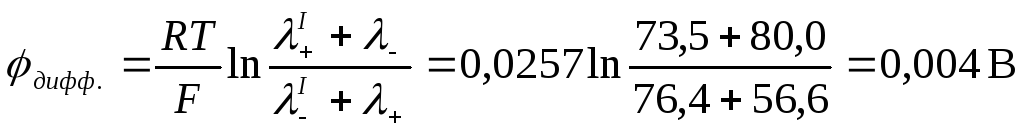
Определим знак φдифф.
Так как концентрация
обоих электролитов одинакова, то диффузия
ионов будет происходить и слева направо
и справа налево. Движение К+
и Сu2+
происходит в противоположных направлениях,
но у К+
подвижность больше на
![]() и с правой стороны границы накапливается
положительный заряд. При движенииСl-
и SO42-
и с правой стороны границы накапливается
положительный заряд. При движенииСl-
и SO42-
![]() ,
то есть за счет большей подвижностиSO42-,
слева накапливается отрицательный
заряд, но
,
то есть за счет большей подвижностиSO42-,
слева накапливается отрицательный
заряд, но
![]() >
>![]() ,
что дает в итоге положительный потенциал
,
что дает в итоге положительный потенциал![]() справа,
. Направление полей ДЭС и
электродов совпадает,
справа,
. Направление полей ДЭС и
электродов совпадает,
![]() >
0.
>
0.
Задача 6
При электролизе
раствора, содержащего Pb2+,
через 70 минут на поверхности 1,2 дм2
получено покрытие толщиной 108 мкм при
плотности тока 3,0 А/дм2.
При этом выделилось некоторое количество
водорода. Рассчитать выход по току для
свинца и объем выделившегося водорода
при н.у.,
![]() .
.
Дано:
t = 70 мин = 4200 с
S = 1,2 дм2
h = 108 мкм = 108·10-5 дм
i = 3,0 А/дм2
![]() = 11,34 кг/дм3
= 11,34 кг/дм3
ВТ (Pb)-?
![]() - ?
- ?
Решение
![]()
По первому закону Фарадея:
![]()
![]()
Фактическая масса
свинца меньше теоретической за счет
того, что часть количества электричества
расходуется на восстановление водорода.
Недополученное количество свинца равно
16,2 – 14,7 = 1,5 г. Вместо него выделился
водород, масса которого может быть
рассчитана по второму закону Фарадея:
![]()
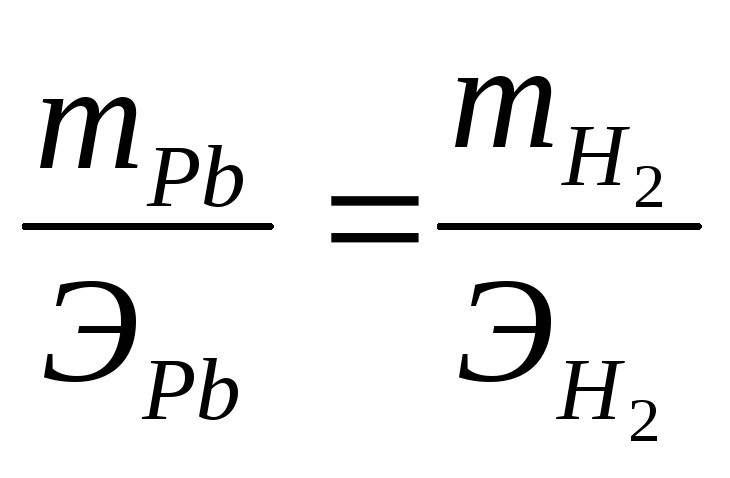 ;
;
![]()
Объем водорода при нормальных условиях (Р = 1 атм., Т = 273 К) определяется по уравнению идеального газового состояния:
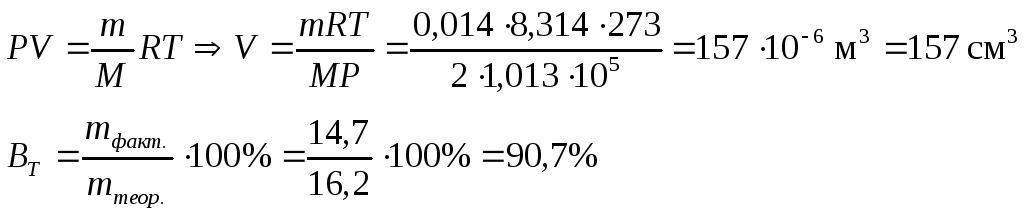
Задача 7
В цианистую ванну исправления брака завешены бракованные омедненные стальные детали с общей поверхностью 522 дм2 и средней толщиной медного покрытия 17 мкм.
Сколько времени необходимо для полного снятия медного слоя с деталей, если плотность тока 0,96 А/дм2, выход по току 95 %? Плотность меди 8,9 г/см3.
Дано:
S = 522 дм2
h = 17 мкм = 17∙10-5 дм
i = 0,96 А/дм2
ρ(Cu) = 8,9 г/см3= 8,9∙103 г/дм3
![]() =0,95
=0,95
t - ?
Решение
Медь в цианистом растворе одновалентна, Сu+, n = 1. Запишем развернутое уравнение Фарадея:
![]() ,
откуда
,
откуда
![]() ,
,
где m
– теоретическая масса меди, которая
может быть найдена через выход по току:![]() .
.
Подсчитаем массу фактически осажденной меди.
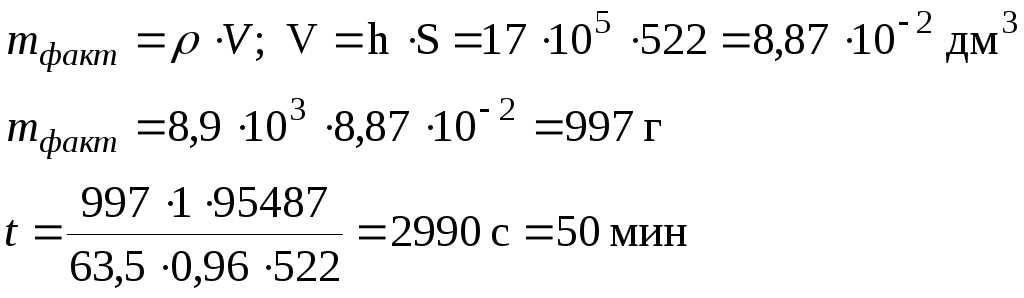
Задача 8
Определить выход по току для щелочи, если при работе хлорного электролизера нагрузкой 22 кА за 24 часа получено 5450 л электролитической щелочи, содержащей 138 г/л NaOH.
Дано:
I = 22 кА = 22∙103 А
t = 24 час = 86,4∙103 с
Vр-ра = 5450 л
СNaOH = 138 г/л
![]()
Решение
В хлорном электролизере электролизу подвергается водный раствор NaCl. Изобразим схематично поляризационные кривые всех возможных процессов окисления и восстановления в процессе электролиза:
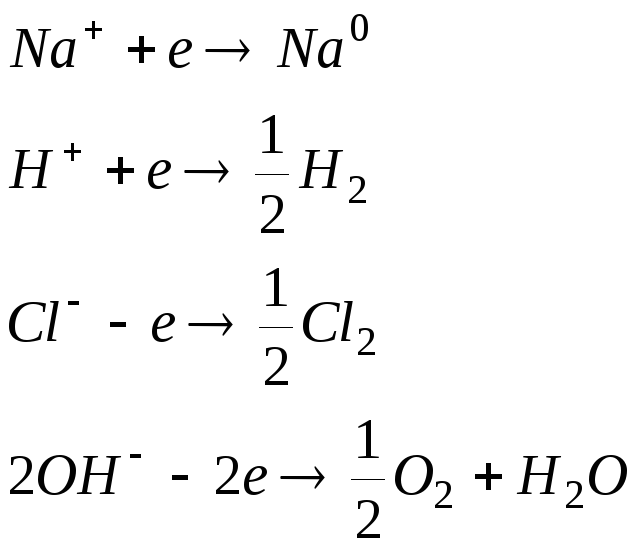
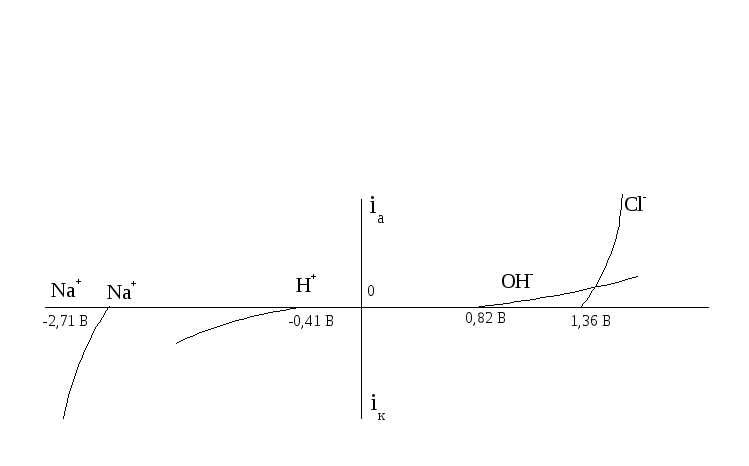
Из рисунка видно, что повышение катодного потенциала приводит к единственно возможной катодной реакции – восстановлению водорода.
На аноде первым достигается потенциал разряда ОН-, но из-за малой скорости реакции (большого перенапряжения) кислород не образуется, и возможно дальнейшее увеличение потенциала анода и достижение потенциала разряда Cl- с образованием хлора.
Таким образом, продуктами электролиза будут Н2 и Cl2.
Однако, в прикатодном пространстве при расходовании Н+ образуется избыточное количество ионов ОН-, которые образуют с имеющимися в растворе ионами Nа+ щелочь NаОН.
Рассчитаем фактическое количество NаОН: