- •Министерство образования и науки
- •1 Растворы
- •1.1 Основные понятия и определения
- •1.2 Способы выражения состава раствора
- •1.3 Закон Рауля. Идеальные растворы
- •1.4 Следствия из закона Рауля
- •1.4.1 Повышение температуры кипения идеального раствора
- •1.4.2 Понижение температуры замерзания раствора
- •1.5 Осмотическое давление
- •1.6 Реальные растворы
- •1.6.1 Отклонения от закона Рауля
- •1.6.2 Активность. Коэффициент активности
- •1.7 Растворимость
- •1.7.1 Растворимость твердых веществ в жидкости
- •1.7.2 Растворимость газов в жидкости
- •1.7.3 Взаимная растворимость жидкостей
- •1.8 Равновесие жидкий раствор – насыщенный пар в различных жидких смесях
- •1.8.1 Неограниченно смешивающиеся жидкости
- •1.8.1.1 Состав пара и жидкости. Законы Коновалова
- •1.8.1.2 Разделение бинарных смесей путем перегонки
- •1.8.2 Равновесие жидкость - пар для практически несмеши-вающихся жидкостей
- •1.8.3 Равновесие жидкость – пар для ограниченно смешивающихся жидкостей
- •1.9 Закон распределения Нернста. Экстракция
- •1.10 Примеры решения задач
- •1.11 Вопросы для самоконтроля
- •2 Электрохимия
- •2.1 Электрическая проводимость растворов электролитов
- •2.1.1 Сильные и слабые электролиты
- •2.1.2 Удельная электрическая проводимость
- •2.1.3 Молярная и эквивалентная электрические проводимости
- •2.1.4 Числа переноса
- •2.2 Кондуктометрия
- •2.2.1 Определение растворимости труднорастворимой соли
- •2.2.2 Определение предельной эквивалентной электрической проводимости растворов сильных электролитов
- •2.2.3 Кондуктометрическое титрование
- •2.3 Электродные процессы
- •2.3.1 Основные понятия и определения
- •2.3.2 Классификация электродов
- •2.3.3 Типы гальванических элементов
- •2.3.4 Диффузионный потенциал
- •2.3.5 Потенциометрическое титрование
- •2.4 Скорость электрохимической реакции
- •2.4.1 Поляризационные кривые
- •2.4.2 Перенапряжение
- •2.4.3 Электролиз
- •2.4.3.1 Электролиз водного раствора CuCl2
- •2.4.3.2 Электролиз водного раствора к2sо4 с использованием инертных анодов
- •2.4.3.3 Законы Фарадея
- •2.5 Примеры решения задач
- •2.6 Вопросы для самоконтроля
- •Кинетика
- •3.1 Скорость химической реакции
- •3.2 Кинетическая классификация химических реакций
- •3.2.1 Молекулярность реакции
- •3.2.2 Порядок реакции
- •3.3 Влияние температуры на скорость реакции. Энергия активации
- •3.4 Методы определения порядка реакции
- •3.5 Сложные реакции
- •3.5.1 Параллельные реакции
- •3.5.2 Обратимые реакции
- •3.5.3 Последовательные реакции
- •3.5.4 Сопряженные реакции
- •3.5.5 Метод стационарных концентраций
- •3.6 Примеры решения задач
- •3.7 Вопросы для самоконтроля
- •Литература
2.1.4 Числа переноса
При прохождении электрического тока через раствор электролита катионы движутся к катоду, а анионы – к аноду. Благодаря разной подвижности катионы и анионы будут переносить неодинаковую часть тока.
Доля электричества, перенесенная ионами одного вида, называется числом переноса иона. Обозначается t+ и t- - для катионов и анионов соответственно.
Количество электричества, перенесенное ионами данного вида через единицу времени поверхности за 1 секунду, равно:
для катионов q+ = z+ν+ CU+F,
для анионов q- = z-ν- CU-F,
где z+, z- - заряд ионов; ν+, ν- - число ионов; U+, U- - абсолютная скорость движения ионов; С – молярная концентрация электролита.
Общее количество электричества равно сумме ( q+ + q-).
Тогда, согласно определению чисел переноса с учетом равенства z+ν+ = z-ν- (вследствие электронейтральности раствора), получаем выражение для чисел переноса:
![]()
![]()
Практически удобно рассматривать не целые ионы, а их части с зарядом, равным единице (например, Na+, ½ SО42-).
Тогда z+ и z- = 1; ν+ и ν- = 1;
U+F
= λ+;
U-F
= λ- -
эквивалентные электропроводности
катионов и анионов или подвижности
ионов
![]() ;
;![]() .
.
Очевидно, что t+ + t- = 1.
2.2 Кондуктометрия
Измерение электрической проводимости – кондуктометрия широко применяется в лабораторной практике для определения физико-химических характеристик электролитов и растворов.
2.2.1 Определение растворимости труднорастворимой соли
По величине удельной
электрической проводимости насыщенного
раствора труднорастворимой соли можно
найти ее концентрацию, а следовательно,
вычислить растворимость и произведение
растворимости. Поскольку в насыщенном
растворе такой соли концентрация очень
мала, его эквивалентная электрическая
проводимость совпадает с
![]() ,
тогда из уравнения (2.7) получаем:
,
тогда из уравнения (2.7) получаем:
![]() .
(2.12)
.
(2.12)
Ввиду малой удельной
электрической проводимости раствора
необходимо вводить поправку на
![]() воды, поэтому:
воды, поэтому:
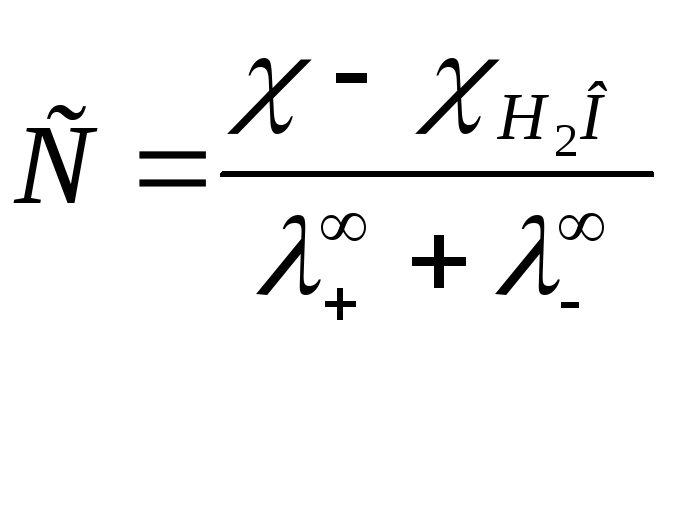 .
.
Если электролит одновалентный, то произведение растворимости, равное произведению активностей ионов в насыщенном растворе, будет равно (с некоторым приближением):
![]() .
.
Для более сложных электролитов произведение растворимости находится аналогично, но с учетом диссоциации электролита.
Так, для соли Ag2S с молярной концентрацией С (моль/л):
Ag2S
![]() 2Ag+
+ S2-,
2Ag+
+ S2-,
![]()
2.2.2 Определение предельной эквивалентной электрической проводимости растворов сильных электролитов
Непосредственное
экспериментальное измерение
![]() невозможно. Для растворов сильных
электролитов наиболее пригоден метод
экстраполяции, с использованием уравнение
(2.11). Для этого найденные значения
невозможно. Для растворов сильных
электролитов наиболее пригоден метод
экстраполяции, с использованием уравнение
(2.11). Для этого найденные значения![]() наносят на график в виде функции от
наносят на график в виде функции от![]() Полученная прямая экстраполируется до
С = 0, и отрезок на оси ординат даст
Полученная прямая экстраполируется до
С = 0, и отрезок на оси ординат даст![]() .
.
В случае слабых
электролитов хорошие результаты дает
способ, основанный на применении закона
Кольрауша, уравнение (2.9), по
![]() для сильных электролитов. Например, для
уксусной кислоты, типичного слабого
электролита,
для сильных электролитов. Например, для
уксусной кислоты, типичного слабого
электролита,
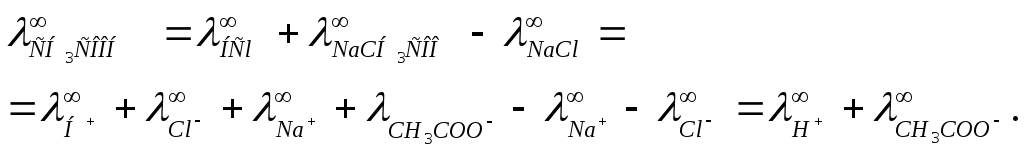
Величины
![]() определяются методом экстраполяции.
определяются методом экстраполяции.
2.2.3 Кондуктометрическое титрование
Это один из физико–химических методов анализа, основанный на измерении электропроводности системы. Он с успехом применяется в случаях, когда между анализируемым раствором и титрантом могут протекать обменные ионные или окислительно – восстановительные реакции, в результате которых изменяется электропроводящая способность раствора. Зависимость электрической проводимости раствора от объема добавляемого титранта изображают графически. Полученный график называется кривой кондуктометрического титрования. Кривые имеют излом, соответствующий точке эквивалентности.
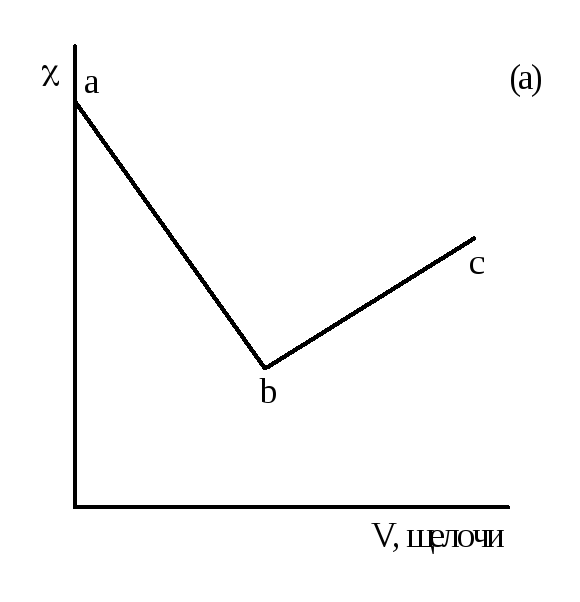
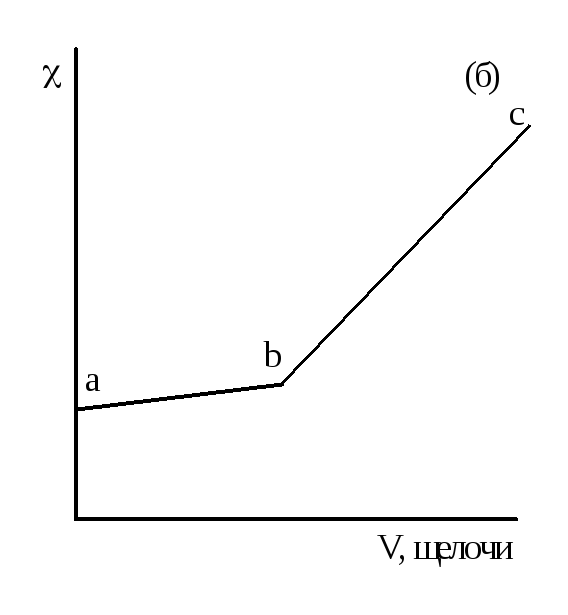
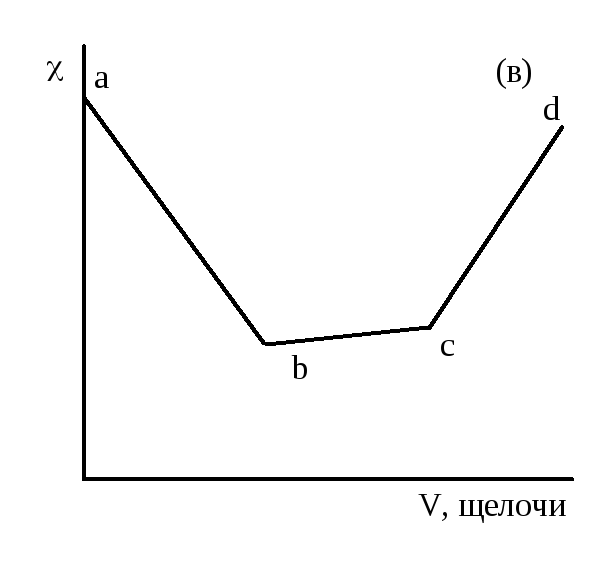
На рисунке 2.3 даны примеры кривых титрования кислот щелочью. В ходе титрования объем раствора не должен значительно изменяться, для чего концентрация титранта должна быть значительно выше концентрации титруемого раствора.
|
|
|
|
Рисунок 2.3 – Кривые кондуктометрического титрования сильной кислоты (а), слабой (б) и смеси сильной и слабой кислот (в) сильным основанием
Следует отметить, что подвижность ионов Н+ и ОН- является аномально высокой по сравнению с другими ионами:
![]()
![]()
![]()
![]() ).
).
При титровании сильной кислоты щелочью (рисунок 2.3 а) сначала происходит снижение электрической проводимости раствора за счет замены подвижного иона водорода менее подвижным катионом металла (участок аb). При добавлении к системе, после точки эквивалентности, избытка щелочи электрическая проводимость растет за счет появления ионов ОН- (свободной щелочи).
При титровании слабой кислоты (например, СН3СООН) щелочью (NaOH) (рисунок 2.3 б) малая электропроводность кислоты растет за счет появления свободных ионов соли (сильного электролита). После точки эквивалентности в системе появляются избыточные ионы ОН-, имеющие бóльшую подвижность, что приводит к резкому возрастанию электропроводности.
При титровании
смеси кислот (рисунок 2.3 в) сначала
оттитровывается сильная кислота (участок
аb),
а затем начинается нейтрализация слабой,
малодиссоциированной кислоты. При этом
образуется хорошо диссоциированная
соль, что приводит к повышению
![]() (участокbс)
до точки эквивалентности (с).
(участокbс)
до точки эквивалентности (с).
Дальнейшее
приливание избытка щелочи приводит к
более резкому возрастанию
![]() за счет ионовОН-
щелочи (cd).
за счет ионовОН-
щелочи (cd).
Этим методом можно проводить титрование солей, если выпадает осадок, понижающий концентрацию ионов, обусловливающих электропроводность раствора, например, при титровании MgSO4 раствором Ва(ОН)2:
MgSO4 + Ва(ОН)2 = Mg(ОН)2 ↓ + Ва SO4 ↓.