
- •Министерство образования и науки
- •1 Растворы
- •1.1 Основные понятия и определения
- •1.2 Способы выражения состава раствора
- •1.3 Закон Рауля. Идеальные растворы
- •1.4 Следствия из закона Рауля
- •1.4.1 Повышение температуры кипения идеального раствора
- •1.4.2 Понижение температуры замерзания раствора
- •1.5 Осмотическое давление
- •1.6 Реальные растворы
- •1.6.1 Отклонения от закона Рауля
- •1.6.2 Активность. Коэффициент активности
- •1.7 Растворимость
- •1.7.1 Растворимость твердых веществ в жидкости
- •1.7.2 Растворимость газов в жидкости
- •1.7.3 Взаимная растворимость жидкостей
- •1.8 Равновесие жидкий раствор – насыщенный пар в различных жидких смесях
- •1.8.1 Неограниченно смешивающиеся жидкости
- •1.8.1.1 Состав пара и жидкости. Законы Коновалова
- •1.8.1.2 Разделение бинарных смесей путем перегонки
- •1.8.2 Равновесие жидкость - пар для практически несмеши-вающихся жидкостей
- •1.8.3 Равновесие жидкость – пар для ограниченно смешивающихся жидкостей
- •1.9 Закон распределения Нернста. Экстракция
- •1.10 Примеры решения задач
- •1.11 Вопросы для самоконтроля
- •2 Электрохимия
- •2.1 Электрическая проводимость растворов электролитов
- •2.1.1 Сильные и слабые электролиты
- •2.1.2 Удельная электрическая проводимость
- •2.1.3 Молярная и эквивалентная электрические проводимости
- •2.1.4 Числа переноса
- •2.2 Кондуктометрия
- •2.2.1 Определение растворимости труднорастворимой соли
- •2.2.2 Определение предельной эквивалентной электрической проводимости растворов сильных электролитов
- •2.2.3 Кондуктометрическое титрование
- •2.3 Электродные процессы
- •2.3.1 Основные понятия и определения
- •2.3.2 Классификация электродов
- •2.3.3 Типы гальванических элементов
- •2.3.4 Диффузионный потенциал
- •2.3.5 Потенциометрическое титрование
- •2.4 Скорость электрохимической реакции
- •2.4.1 Поляризационные кривые
- •2.4.2 Перенапряжение
- •2.4.3 Электролиз
- •2.4.3.1 Электролиз водного раствора CuCl2
- •2.4.3.2 Электролиз водного раствора к2sо4 с использованием инертных анодов
- •2.4.3.3 Законы Фарадея
- •2.5 Примеры решения задач
- •2.6 Вопросы для самоконтроля
- •Кинетика
- •3.1 Скорость химической реакции
- •3.2 Кинетическая классификация химических реакций
- •3.2.1 Молекулярность реакции
- •3.2.2 Порядок реакции
- •3.3 Влияние температуры на скорость реакции. Энергия активации
- •3.4 Методы определения порядка реакции
- •3.5 Сложные реакции
- •3.5.1 Параллельные реакции
- •3.5.2 Обратимые реакции
- •3.5.3 Последовательные реакции
- •3.5.4 Сопряженные реакции
- •3.5.5 Метод стационарных концентраций
- •3.6 Примеры решения задач
- •3.7 Вопросы для самоконтроля
- •Литература
3.5.4 Сопряженные реакции
Химическая индукция – такое явление, когда одна химическая реакция вызывает (индуцирует) протекание в системе другой, неосуществимой в отсутствие первой.
Две реакции, из которых одна индуцирует протекание другой, называются сопряженными.
Схема сопряженной реакции в простейшем случае:
1. А
+ С
![]() ≠
Р (реакция
не идет самостоятельно);
≠
Р (реакция
не идет самостоятельно);
2. А + J → В (реакция идет самостоятельно);
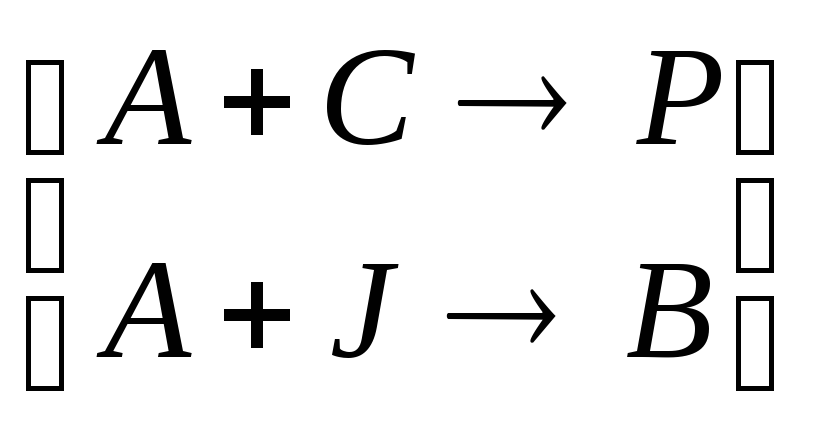 реакции идут
совместно в одной системе
реакции идут
совместно в одной системе
Часто в обеих реакциях принимает участие одно и то же вещество, которое самопроизвольно реагирует во второй реакции. Это вещество называется актором (в нашем случае вещество А).
Компонент, который реагируя с актором, индуцирует превращение другого вещества в другой реакции, называется индуктором (вещество J).
Компонент, который вступает в реакцию с актором только в присутствии индуктора, называется акцептором (вещество С).
Например, реакция
2СО + О2→2СО2
Идет только при достаточно высоких температурах. Но если в системе протекает реакция окисления водорода
2Н2 + О2 → 2Н2О, то в этой системе окисляется и СО при невысоких температурах. В этих сопряженных реакциях кислород О2 является актором, Н2 – индуктором, а СО – акцептором.
Явление химической индукции было подробно исследовано Н.А.Шиловым. Им было дано объяснение этому явлению, согласно которому химическая индукция обусловлена тем, что сопряженные реакции протекают через общие активные промежуточные вещества. Такими активными промежуточными продуктами могут быть свободные радикалы, промежуточные окисленные формы ионов, лабильные комплексы и так далее.
Тогда схема простейших сопряженных реакций будет содержать активное промежуточное вещество R и примет вид:
A + J
![]() R
R
R + J
![]() B
B
R
+ C
![]() P
P
Таким образом, в сопряженных реакциях образующиеся активные промежуточные вещества взаимодействуют как с индуктором, так и с акцептором, вызывая расходование последнего.
В приведенном выше примере индукция обусловлена образованием радикала гидроксила НО∙ в цепной реакции окисления водорода, который окисляет и СО
НО∙ + СО → СО2 + Н∙
Количественной
мерой химической индукции служит фактор
индукции Ф,
который представляет собой отношение
скорости расходования акцептора,
![]() ,к скорости
расходования
индуктора,
,к скорости
расходования
индуктора,
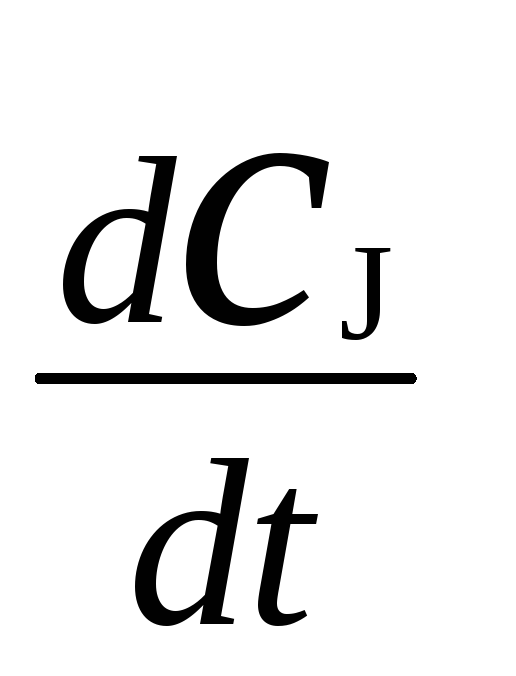 ,то есть
,то есть
![]() .
.
![]() =
- k3СR
СC
,
=
- k3СR
СC
,
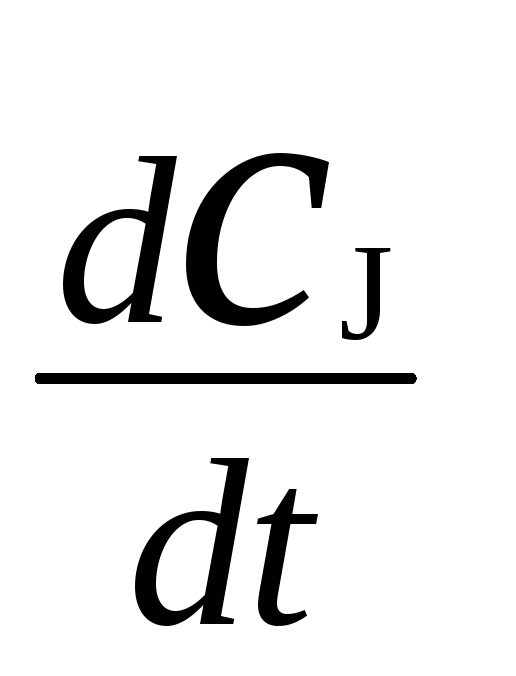 =
-k1СА
СJ
- k2СR
СJ.
=
-k1СА
СJ
- k2СR
СJ.
![]() .
(3.25)
.
(3.25)
Однако, полученное уравнение не может быть рассчитано практически, поскольку в формулу входит СR – концентрация неустойчивого промежуточного продукта, которая не может быть определена аналитически. Для такого типа реакций предложен приближенный метод стационарных концентраций, позволяющий избежать использования концентрации СR.
Рассмотрим этот метод подробнее.
3.5.5 Метод стационарных концентраций
Точное рассмотрение кинетики сложных реакций связано с решением дифференциальных уравнений. При увеличении числа стадий и для более высоких порядков стадий математические сложности сильно возрастают. Поэтому становятся целесообразными приближенные методы. К их числу относится метод стационарных концентраций М. Боденштейна. Он применим для рассмотрения стационарного течения процессов, в которых образуются промежуточные частицы со столь высокой реакционной способностью, что не могут накапливаться в системе в концентрациях, соизмеримых с концентрациями исходных веществ и продуктов реакции. Такими частицами являются промежуточные соединения в гомогенных каталитических реакциях, свободные радикалы, в ряде случаев – молекулы или ионы.
За малый промежуток времени после начала реакции скорость образования промежуточного продукта приблизительно равна скорости его расходования. При этом устанавливается стационарная концентрация неустойчивого промежуточного продукта, сохраняющаяся в течение значительной части всего времени хода реакции.
Это условие позволяет перейти к рассмотрению алгебраических уравнений вместо дифференциальных и заменить неопределимые концентрации неустойчивых промежуточных продуктов концентрациями устойчивых веществ, аналитически определимых.
Вернемся к
сопряженным реакциям, где для определения
фактора индукции (3.25) необходимо знать
концентрацию промежуточного неустойчивого
продукта СR.
При стационарном состоянии концентрация
СR
не меняется, то есть
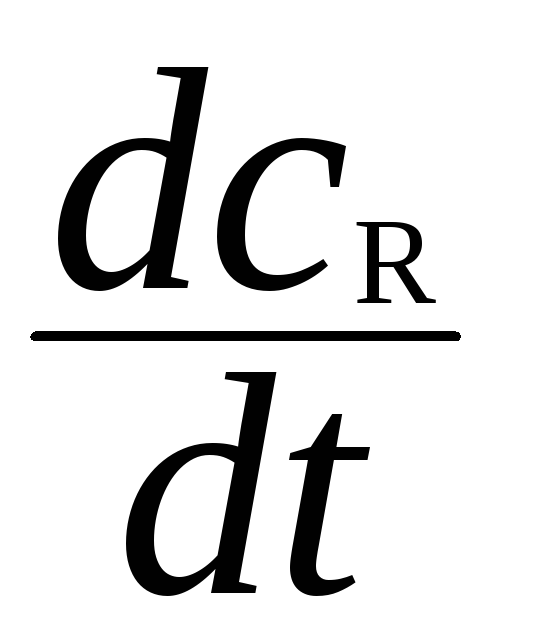 =0.
=0.
Исходя из механизма течения реакции (с. 95 «Схема сопряженной реакции»)
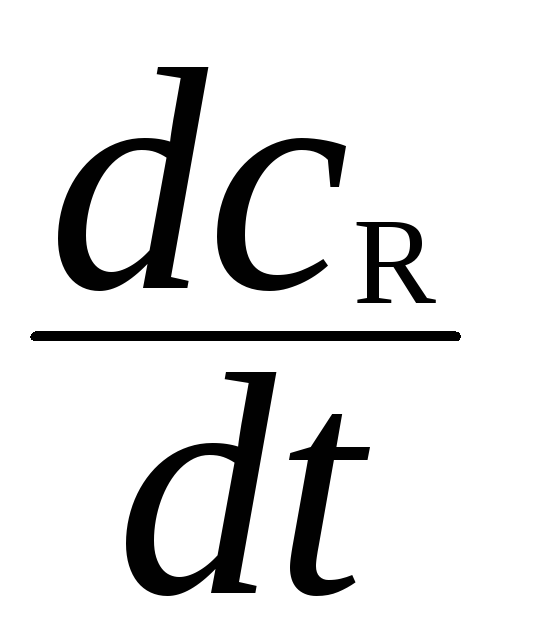 =
k1СА
СJ
- k2СR
СJ
– k3СR
СС
= 0,
=
k1СА
СJ
- k2СR
СJ
– k3СR
СС
= 0,
откуда
![]() .
.
Подставляя полученные значения СR в уравнение (3.25), можно получить величину Ф, в которую будут входить только концентрации устойчивых веществ.
Обратимся к рассмотренным выше последовательным реакциям, а именно к случаю, когда k2»k1, то есть вещество В – неустойчивое, значит можно применить метод стационарных концентраций.
A
![]() В
В![]() D,
D,
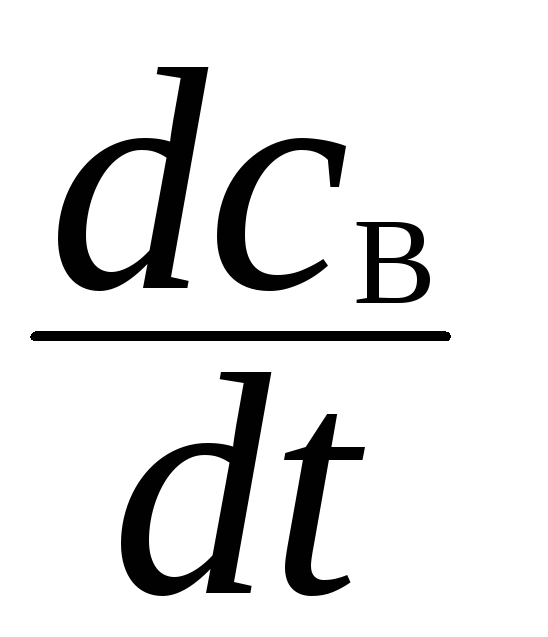 =
k1СА
- k2СB
= 0,
=
k1СА
- k2СB
= 0,
![]() .
.
Скорость образования продукта D равна
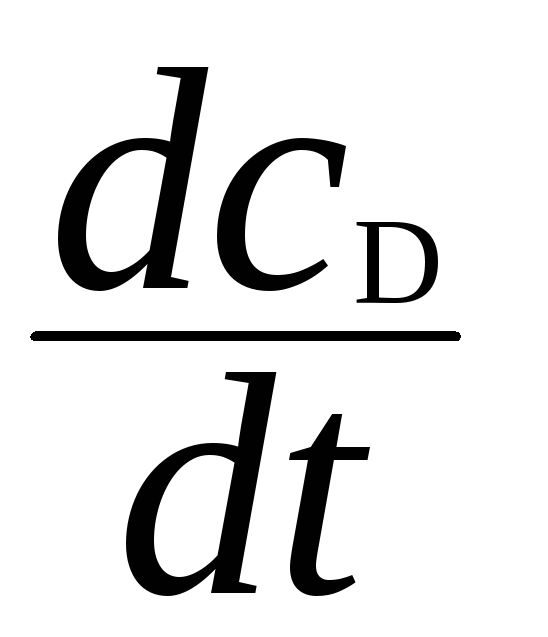 =
k2СB
=
k2
=
k2СB
=
k2
![]()
![]() =
k1СА
=
k1
=
k1СА
=
k1![]() .
e-k1t.
.
e-k1t.
Таким образом, результат получился тот же, но гораздо проще и без решения сложных дифференциальных уравнений для получения СВ ( вывод был опущен из-за его сложности).
Кинетические различия между простой и сложной реакциями
Одна из задач, которая возникает при кинетическом исследовании, заключается в выяснении, является реакция простой или сложной. Ниже перечислены кинетические признаки, по которым можно отличить простую реакцию от сложной. Следует иметь ввиду, что для признания реакции сложной достаточно проявления у нее хотя бы одного из нижеперечисленных признаков.
Таблица 3.1 - Кинетические признаки простых и сложных реакций
|
Простая реакция |
Сложная реакция |
|
Состав продуктов сравнительно прост и не зависит от условий ее протекания (температуры, исходных концентраций и так далее) |
Состав продуктов может изменяться в зависимости от исходных концентраций, длительности опыта, температуры и так далее) |
|
Порядок реакции может быть только целочисленным (n = 1, 2, 3) |
Порядок реакции может быть целочисленным, дробным и даже отрицательным. Зависимость скорости реакции от концентрации может описываться более сложной формулой. Формальный порядок может оказаться переменным. Например, скорость реакции
Н2
+ Br2
описывается формулой υ = k[Н2][Вr2]1/2∙(1 +K´[HBr]/[Br2]-1.
|
|
Порядок по данному веществу и стехиометрический коэффициент всегда совпадают. Например, для реакции Cl∙ + H2 →HCl + Н∙ νCl = nCl = 1 νH2 = n H2 = 1
|
Порядок и стехиометрический коэффициент могут различаться
|
|
Добавки веществ, практически не меняющих свойств среды (диэлектрической постоянной, давления, ионной силы и так далее) не влияют на скорость реакции |
Небольшие добавки соединений могут ускорить (катализаторы, инициаторы) или замедлить (ингибиторы) протекание реакции |
|
Скорость реакции не зависит от материала и размеров реакционного сосуда |
Материал и размеры сосуда могут влиять на скорость реакции (катализ, инициирование, обрыв цепей на стенке сосуда) |
|
Энергия активации всегда положительна (Еa ≥ 0) |
Энергия активации может быть положительной, отрицательной и переменной (при измерении в широком интервале температур) |
|
При изменении условий проведения реакции, таких как давление, концентрация, температура скорость реакции изменяется плавно (пропорционально xn, где х – параметр, n – не очень большая величина, то есть 0, 1, 2) |
В некоторых случаях (для цепных, автокаталитических процессов) наблюдаются критические явления, когда при незначительном изменении условий проведения опыта скорость изменяется очень сильно (на несколько порядков) – процесс или переходит во взрыв, или, наоборот, останавливается |
