
- •Министерство образования и науки
- •1 Растворы
- •1.1 Основные понятия и определения
- •1.2 Способы выражения состава раствора
- •1.3 Закон Рауля. Идеальные растворы
- •1.4 Следствия из закона Рауля
- •1.4.1 Повышение температуры кипения идеального раствора
- •1.4.2 Понижение температуры замерзания раствора
- •1.5 Осмотическое давление
- •1.6 Реальные растворы
- •1.6.1 Отклонения от закона Рауля
- •1.6.2 Активность. Коэффициент активности
- •1.7 Растворимость
- •1.7.1 Растворимость твердых веществ в жидкости
- •1.7.2 Растворимость газов в жидкости
- •1.7.3 Взаимная растворимость жидкостей
- •1.8 Равновесие жидкий раствор – насыщенный пар в различных жидких смесях
- •1.8.1 Неограниченно смешивающиеся жидкости
- •1.8.1.1 Состав пара и жидкости. Законы Коновалова
- •1.8.1.2 Разделение бинарных смесей путем перегонки
- •1.8.2 Равновесие жидкость - пар для практически несмеши-вающихся жидкостей
- •1.8.3 Равновесие жидкость – пар для ограниченно смешивающихся жидкостей
- •1.9 Закон распределения Нернста. Экстракция
- •1.10 Примеры решения задач
- •1.11 Вопросы для самоконтроля
- •2 Электрохимия
- •2.1 Электрическая проводимость растворов электролитов
- •2.1.1 Сильные и слабые электролиты
- •2.1.2 Удельная электрическая проводимость
- •2.1.3 Молярная и эквивалентная электрические проводимости
- •2.1.4 Числа переноса
- •2.2 Кондуктометрия
- •2.2.1 Определение растворимости труднорастворимой соли
- •2.2.2 Определение предельной эквивалентной электрической проводимости растворов сильных электролитов
- •2.2.3 Кондуктометрическое титрование
- •2.3 Электродные процессы
- •2.3.1 Основные понятия и определения
- •2.3.2 Классификация электродов
- •2.3.3 Типы гальванических элементов
- •2.3.4 Диффузионный потенциал
- •2.3.5 Потенциометрическое титрование
- •2.4 Скорость электрохимической реакции
- •2.4.1 Поляризационные кривые
- •2.4.2 Перенапряжение
- •2.4.3 Электролиз
- •2.4.3.1 Электролиз водного раствора CuCl2
- •2.4.3.2 Электролиз водного раствора к2sо4 с использованием инертных анодов
- •2.4.3.3 Законы Фарадея
- •2.5 Примеры решения задач
- •2.6 Вопросы для самоконтроля
- •Кинетика
- •3.1 Скорость химической реакции
- •3.2 Кинетическая классификация химических реакций
- •3.2.1 Молекулярность реакции
- •3.2.2 Порядок реакции
- •3.3 Влияние температуры на скорость реакции. Энергия активации
- •3.4 Методы определения порядка реакции
- •3.5 Сложные реакции
- •3.5.1 Параллельные реакции
- •3.5.2 Обратимые реакции
- •3.5.3 Последовательные реакции
- •3.5.4 Сопряженные реакции
- •3.5.5 Метод стационарных концентраций
- •3.6 Примеры решения задач
- •3.7 Вопросы для самоконтроля
- •Литература
2.3 Электродные процессы
2.3.1 Основные понятия и определения
При погружении
металлического электрода в раствор,
содержащий ионы этого же металла,
устанавливается равновесие на границе
металл - раствор. Разность химических
потенциалов в растворе и электроде
приводит к тому, что электрод растворяется
и посылает ионы в раствор, если
![]() >
>![]() .
Если же
.
Если же![]() <
<![]() ,
то происходит осаждение катионов из
раствора на электроде. Таким образом,
на границе фаз образуется электрическая
разность потенциалов, называемаягальвани –
потенциалом.
,
то происходит осаждение катионов из
раствора на электроде. Таким образом,
на границе фаз образуется электрическая
разность потенциалов, называемаягальвани –
потенциалом.
Экспериментальному определению доступна лишь электрическая разность потенциалов между точками, которые находятся в одинаковых по химическому составу фазах. Если же точки расположены в различных по химическому составу фазах, то электрическую разность потенциалов измерить невозможно. Такой разностью потенциалов между электродом и раствором является гальвани-потенциал.
Если же соединить два металлических электрода, погруженных в растворы, содержащие ионы этих металлов, тогда можно замерить разность потенциалов между этими электродами. При этом концы электрохимической цепи должны заканчиваться одинаковыми по своему составу металлами. Такая цепь называется правильно разомкнутой (рисунок 2.4).
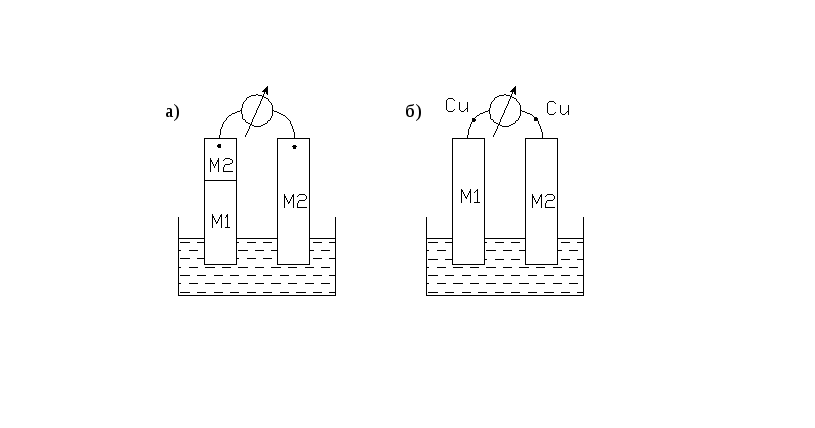
Рисунок 2.4 - Правильно разомкнутые электрохимические цепи
На практике это обычно достигается простым подключением медных проводов к обоим электродам (рисунок 2.4 б).
Электрохимическая цепь является равновесной, если процессы на электродах протекают бесконечно медленно.
Разность потенциалов на концах правильно разомкнутой равновесной электрохимической цепи называется электродвижущей силой (ЭДС). Обозначается ЭДС - Е.
Электрохимическую цепь можно представить схематически. Например:
Cu
| Zn
| ZnS04
![]() CuS04
| Cu
CuS04
| Cu
Вертикальной
сплошной чертой показывается наличие
скачка потенциала на границе металл-металл,
металл-раствор, а пунктирной - на границе
двух растворов, так называемый диффузионный
потенциал.
Часто при записи цепи опускается
повторение металла, предполагая, что
цепь является правильно разомкнутой:
Zn
| ZnS04
![]() CuS04
| Cu.
CuS04
| Cu.
Разность потенциалов Е на концах этой цепи складывается из четырех гальвани-потенциалов, каждый из которых отдельно замерен быть не может:
![]()
Рассмотрим, как
определяется величина и знак ЭДС.
Полезная работа обратимого процесса
(в данном случае электрическая) равна
убыли энергии Гиббса, то есть
![]()
Для реакций, самопроизвольно протекающих в гальваническом элементе, (∆G < 0), ЭДС - положительна. Этому соответствует запись гальванического элемента так, чтобы правый электрод был более электроположителен, чем левый, движение электронов при этом происходит от левого электрода к правому, на котором и идет реакция восстановления.
На положительном электроде идет реакция восстановления, на отрицательном - окисления. Электрод, на котором идет восстановление, называется катодом, а на котором идет окисление – анодом. В гальваническом элементе катод имеет положительный знак (в отличие от электролиза, где восстановление идет на отрицательном электроде, то есть катод будет отрицательным, см. раздел 2.4).
ЭДС гальванического элемента можно рассчитывать по формуле Нернста:
![]() ,
(2.13)
,
(2.13)
где
Е0-
стандартная ЭДС цепи при активностях
всех компонентов, равных единице;
n
-
число электронов, участвующих в реакции;
![]() - произведение
активностей всех участников
окислительно-восстановительной реакции
в гальваническом элементе с учетом
стехиометрических
коэффициентов, которые для исходных
веществ берутся со знаком
«минус», а для продуктов со знаком
«плюс».
- произведение
активностей всех участников
окислительно-восстановительной реакции
в гальваническом элементе с учетом
стехиометрических
коэффициентов, которые для исходных
веществ берутся со знаком
«минус», а для продуктов со знаком
«плюс».
Так, для приведенной выше гальванической цепи, где протекает реакция
CuS04 + Zn →ZnS04 + Сu,
ЭДС можно рассчитать по уравнению (2.13):
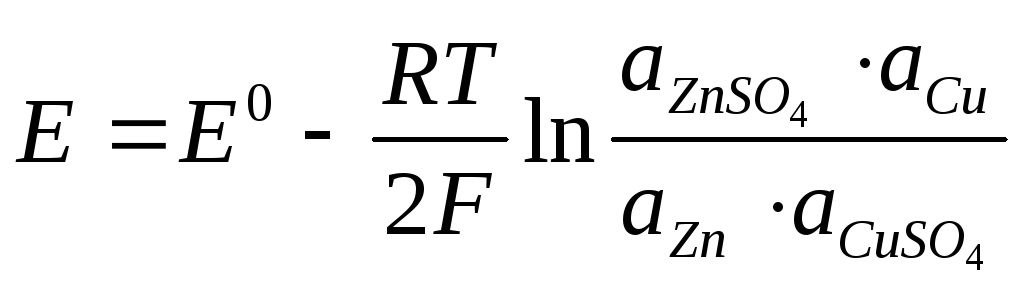 .
.
Комбинируя различные электроды между собой, можно получить множество электрохимических цепей. Поскольку измерить гальвани-потенциал невозможно, то за величину, характеризующую процесс на отдельном электроде, принимают электродный потенциал.
Электродным потенциалом называют ЭДС электрохимической цепи, построенной из стандартного водородного электрода и электрода окислительно - восстановительной полуреакции.
Стандартный
водородный
электрод
представляет собой платинированный
платиновый электрод в растворе кислоты
с активностью, равной единице,
который омывается током водорода под
давлением 1 атм. (1,013·105
Па), то есть aН+
= 1;
![]() .
При записи cхемы
гальванического элемента стандартный
водородный электрод всегда располагается
слева.
.
При записи cхемы
гальванического элемента стандартный
водородный электрод всегда располагается
слева.
![]()
![]()
При обозначении электрода водородный электрод не записывается, а подразумевается, и запись электрода выглядит так:
CuSO4 | Cu,
ZnSO4 | Zn.
Знак
электродного потенциала определяется
знаком ЭДС
при
движении электронов от левого электрода
(водородного) к правому. Если этот процесс
самопроизволен, ∆G
< 0, то
![]() > 0, значит и
> 0, значит и![]() > 0.
> 0.
Электродный
потенциал нередко обозначается знаком
Е. Мы принимаем обозначение
![]() ,
чтобы различать электродный потенциал
иЭДС
суммарной
цепи.
,
чтобы различать электродный потенциал
иЭДС
суммарной
цепи.
Величины электродных потенциалов зависят от концентрации всех компонентов, участвующих в окислительно-восстановительной полуреакции. Зависимость эта выражается уравнением Нернста. Так, величина электродного потенциала Сu2+ |Сu равна ЭДС цепи, где протекает реакция:
Н2
+ Сu2+
→ Сu
+ 2Н+.
Учитывая, что
![]() а
а![]() = 1;а
= 1;а![]() =
1, получим:
=
1, получим:
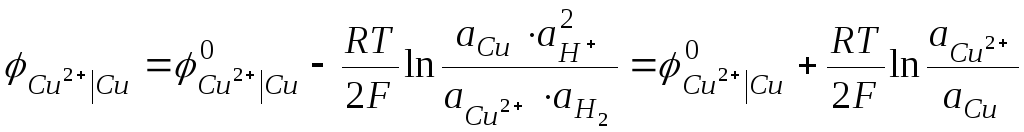
В общем случае уравнение Нернста для электродного потенциала имеет вид :
![]() ,
(2.14)
,
(2.14)
где аокисл, авосст - активности окисленных и восстановленных форм участников реакции.
Если активности участников полуреакции равны единице, то ЭДС цепи типа (А) и (В) будет называться стандартным электродным потенциалом. Величина потенциала стандартного водородного электрода равна нулю.
