- •Розділ 1. Організація вірусологічних лабораторій.
- •Обладнання вірусологічних лабораторій
- •Правила роботи в учбових вірусологічних лабораторіях
- •Практична частина
- •Контрольні питання та контрольні завдання
- •Література
- •Тема 1: Використання лабораторних тварин у вірусологічних дослідженнях
- •Природні інфекційні хвороби деяких лабораторних тварин, збудники яких є патогенними для людини
- •Індикаторні тварини
- •Гнотобіотичні тварини
- •Показники мікроклімату в приміщеннях для лабораторних тварин
- •Густота посадки в клітках лабораторних тварин та птахів
- •Причини канібалізму та заходи його профілактики
- •Основні показники нормальної життєдіяльності різних видів тварин
- •Зв’язок тропізму вірусу зі способом ураження чутливого організму та видом патологічного матеріалу
- •Допустимі дози досліджуваного матеріалу, що вводиться лабораторним тваринам, мл
- •Методи зараження через травний тракт
- •Перкутанне (нашкірне) зараження
- •Кутанне (шкірне) зараження
- •Субкутанне (підшкірне) зараження
- •Інтракутанне (внутрішньошкірне) зараження
- •Інтравенозне (внутрішньовенне) та інтракардіальне (внутрішньосерцеве) зараження
- •Інтрамускулярне (внутрішньом’язеве) зараження
- •Інтраперітонеальне (внутрішньочеревинне) зараження
- •Субокципітальне (каркове) зараження
- •Інтрацеребральне (внутрішньомозкове) зараження
- •Зараження в периферичний нерв
- •Інтратестикулярне (внутрішньосім’яникове) зараження
- •Інтраокулярне зараження
- •Корнеальне зараження
- •Інтракорнеальне зараження
- •Кон’юнктивальне зараження
- •Забір крові
- •Антикоагулянти
- •Лабораторне заняття
- •Тема 2. Курячі ембріони та їх використання у вірусології
- •Теоретична частина
- •Практична частина
- •Будова курячого ембріону
- •Практична частина Лабораторне заняття
- •Тема 3. Клітинні культури у вірусології
- •Теоретична частина
- •Класифікація тваринних культур клітин
- •Одношарові культури клітин
- •Чутливість первинних культур клітин до вірусів людини
- •Характеристика деяких із відомих клітинних ліній
- •Переваги та недоліки використання постійних культур клітин
- •Чутливість постійних клітинних культур до вірусів
- •Суспензійні культури клітин
- •Зберігання культур клітин
- •Умови культивування клітин in vitro
- •Поживні середовища
- •Середовище 199 (Морган, Мортон, Паркер; 1950 р.)
- •Контамінація культур клітин
- •Взаємодія вірусів із клітинами
- •Методи виявлення та ідентифікації вірусів у клітинних культурах
- •Цитопатична дія
- •Внутрішньоклітинні включення
- •Титрування вірусів у одношарових культурах клітин
- •Практична частина Лабораторне заняття
- •Хід роботи
- •Контрольні завдання
- •Контрольні запитання
- •Література
- •Розділ 3. Віруси бактерій
- •Теоретична частина Загальна характеристика вірусів бактерій
- •Практична частина Методи титрування бактеріофагів
- •Титрування фагу за методом Аппельмана (рідке середовище)
- •Хід роботи:
- •Практична робота: Виділення фагів із лізогенних культур
- •Розділ 4. Дослідження вірусів рослин
- •Теоретична частина
- •Практична частина
- •Тема. Способи передачі вірусів рослин. Рослини-індикатори.
- •Практична частина Лабораторне заняття
- •Тема. 2. Виділення, очистка та концентрування вірусів рослин
- •Практична частина
- •Теоретична частина
- •Розділ 5. Використання електронної мікроскопії у вірусологічних дослідженнях.
- •Практична частина Хід роботи
- •Розділ. 6. Методи діагностики вірусних інфекцій та ідентифікації вірусів
- •Тема 1. Серологічні методи досліджень
- •Теоретична частина Реакція гемаглютинації
- •Імунологічні методи дослідження
- •Імунодифузійні тести.
- •Радіоімунологічний аналіз (ріа)
- •Імунофлуоресцентний аналіз (іф)
- •Імуноферментний аналіз
- •Практична частина Практична робота №1
- •Хід роботи
- •Практична робота №2
- •Хід роботи
- •Список літератури
- •Тема 2. Застосування полімеразної ланцюгової реакції у вірусологчних дослідженнях
- •Обладнання для плр
- •Компоненти реакції.
- •Параметри температурних циклів
- •Аналіз плр-ампліфікованої днк
- •Real-time pcr (прл у реальному часі) та її застосування у вірусологічних дослідженнях.
- •Словник використаних термінів
- •Верхній агар
- •Нижній агар
- •Цитратний буфер, 0,1м, рН 3,0 –6,2
- •Ацетатний буфер,0,1м , рН 3.6-5,6 Розчин а
- •0,1М оцтова кислота
- •С) Солі та інші речовини, г/л
Основні показники нормальної життєдіяльності різних видів тварин
|
Вид тварини |
Частота пульсу за 1хв. |
Число дихальних рухів за 1хв. |
Коливання нормальної температури (C) |
Вага дорослої тварини, кг |
Тривалість життя, роки |
|
Мавпа
Собака Кішка Кролик Мурчак Пацюк Миша Хом’як |
140-240 (60-70) 90-140 120-180 140-360 250-355 286-500 520-780 120-220 |
15-30
10-30 20-30 50-100 80-130 110-150 140-210 110-140 |
37,5-39,0
37,5-39,0 38,0-39,5 37,7-39,8 37,3-39,5 37,5-39,5 37,0-39,0 |
5-30
30-40 3,5-4,5 2,5-6,0 0,5-1,0 0,3-0,45 0,02-0,05 0,15-0,18 |
дуже варіює
12-20 11-15 8-12 7-8 3-4 2-3 1-5 |
-
Татуювання вух у злегка наркотизованих тварин, що мають достатньо великі непігментовані вушні раковини (кролики, собаки, тхорі) голландською сажею чи китайською тушшю з допомогою спеціальних татуювальних щипців або голок. Татуювання використовують також для мічення мавп на внутрішньому боці верхньої третини стегна.
-
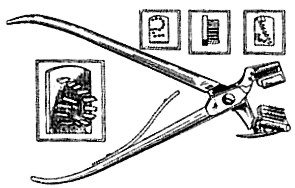
Таврування шляхом нанесення надрізів та насічок на достатньо великих вушних раковинах з допомогою ножиць та проколів компостерними щипцями (кролі, мурчаки, свині) (рис.2.1, 2.2.).
-
Вистригання шерсті на спині та стегнах у мавп, кроликів, тхорів, хом’яків, кішок. Цей спосіб непрактичний, тому що може використовуватись тільки при короткочасному досліді (шерсть через тиждень відростає).
-
Мітка описом характерних природних плям на поверхні тіла, коли за забарвленням шерсті одна тварина відрізняється від іншої того ж виду (мурчаки).
-
Клеймування тварин з використанням металевих жетонів, бляшок, кілець з м’якої білої жерсті зі штампованими номерами, які наносяться штампом, чи спеціальними чорнилами (до 10 мл насиченого розчину мідного купоросу додається 2 мл концентрованої сірчаної кислоти). Бляшки надягають кроликам на корінь вуха та вставляють мурчакам, як сережку, у вушну раковину. Куркам прикріплюють кільце на лапу або бирку на крило. Великим тваринам одягають нашийник з номерами на металевих жетонах. При використанні цього методу клеймування потрібно слідкувати за поведінкою тварин. Якщо предмет, застосований для мітки, дратує тварину, і протягом тривалого часу вона намагається його зняти, то це необхідно зробити експериментатору, а надалі використовувати інший спосіб маркування. У іншому разі ці тварини відгризають лапку разом з бляшкою чи кільцем.
-
Для маркування ембріонів багатоплідних тварин (мишей, пацюків) використовують введення під шкіру спеціальної забарвленої маркувальної маси (до 10 г безводного ланоліну додається 3 г чорної туші та 0,5 мл розчину антибіотику (пеніцилін або інший 5000 ОД)), яка шприцом з гострою голкою та жорстким мандреном (для штовхання маси через голку) вводять під шкіру ембріону на спині. Мітка після народження дитинчати добре помітна у вигляді плями чи смуги.
-
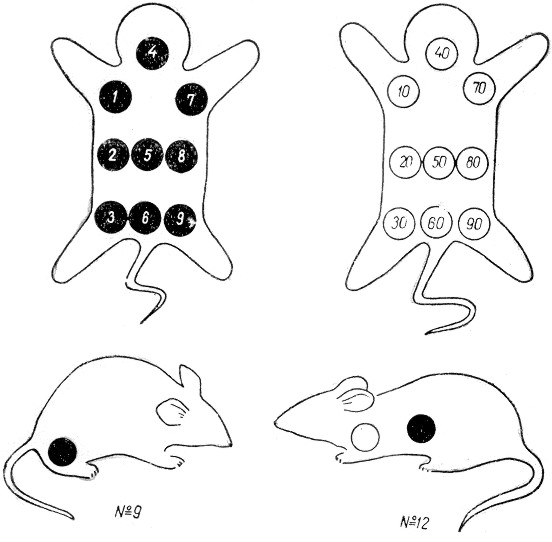
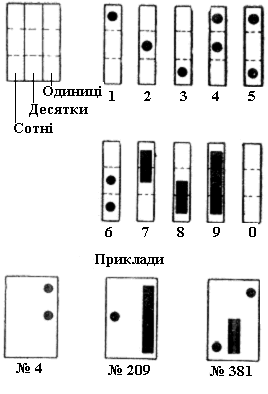
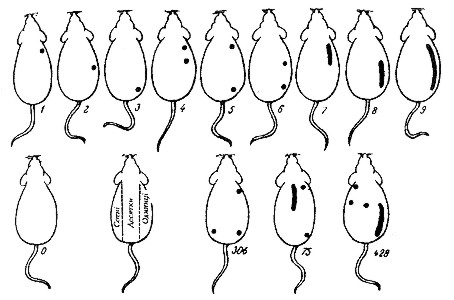
Кольорове маркування здійснюють шляхом нанесення різнокольорових плям на ділянки тіла тварини (альбіноси мишей, пацюків та кролів) за певними схемами (приклади схем наведені на рис.2.3 та 2.5). Використовують анілінові барвники: 0,5% розчин карболового фуксину (червоний колір означає одиниці), насичений розчин пікринової кислоти (жовтий колір означає десятки), 0,5% розчин малахітового зеленого (зелений колір означає сотні), 0,5% розчин генціану фіолетового (фіолетовий колір означає тисячі). Однією фарбою можна помітити 9 тварин, двома – до 100, трьома – до 1 000, чотирма – до 10 000. Фарби наносять на непігментовану шерсть у вигляді крапель, кружечків чи смуг на спину та по боках тварини.
Для кольорового маркування за методом Тойффеля потрібний тільки один барвник для позначки 1 000 тварин. Подумки треба уявити спину тварини, розділену на 9 рівних частин, утворених трьома поздовжніми та трьома поперечними смугами. Ліва смуга використовується для позначення сотень, середня - для позначки десятків, а права - одиниць. Позначки у вигляді плям та смуг наносяться за певною схемою (рис.2.4, 2.5).
Загальним недоліком методів кольорового позначення є нестійкість барвників під час тривалих дослідів – вони знебарвлюються. Найкращим є пікринова кислота, що тримається на шерсті тварин протягом 2-3 місяців.
|
|
|
Рис.2.1. Компостерні щипці для таврування вушних раковин тварин. |
Наркоз тварин
Перед зараженням тварин застосовують загальний наркоз або місцеве знеболювання. Для наркозу мишей, хом’яків, мурчаків, тхорів, курей, кроликів та собак використовують ефір та хлороформ, для пацюків та котів – ефір (внаслідок того, що вони погано переносять хлороформ). Техніка введення наркотизуючих речовин полягає в інгаляції в замкненому просторі, або ж безпосередньо змоченим ватно-марльовим тампоном поблизу носової чи ротової порожнини.
Перед ефірним наркозом собакам та іншим великим тваринам необхідно заздалегідь ввести анальгетик для зняття переднаркотичного збудження, наприклад, 1%-й розчин пропафеніну в дозі 0,2 мл на 1 кг живої ваги інтрамускулярно. Через 30 хв інтравенозно вводять тіопентал в кількості 20 мг на 1 кг живої ваги.
Для більш тривалого наркозу (30-45 хв) можна використовувати 10%-й розчин хлоралгідрату. Метод введення для мурчаків – інтраперітонеальний у дозі 0,5 - 0,75 мл, для курей, котів та кроликів – інтравенозний в дозах 0,2-0,4 мл та 3мл, відповідно.
Мавп наркотизують тіопенталом у вигляді 5%-го розчину інтрамускулярно в дозі 1-2 мл на тварину або у вигляді 2,5%-го розчину в кількості 1,5-2 мл на тварину.
Місцеву анестезію
проводять 1%-м розчином кокаїну, 5%-м
розчином новокаїну по 0,5 г. Для збільшення
тривалості анестезії до розчину
новокаїну чи кокаїну додають 2-5 крапель
розчину адреналіну у концентрації
1:1000. Для анестезії слизових
Рис.2.2.
Схема нанесення мітки надрізами,
насічками та проколами вушних раковин
тварин.

Потрібно пам’ятати, що пацюки погано переносять хлороформ; тхорі – надто чутливі до ефіру, і незначне передозування веде до їхньої загибелі.
При використанні наркотизуючих речовин треба дотримуватися обережності: у дрібних лабораторних тварин після наркозу часто спостерігається набряк легень і загибель.
Депіляція
Тварини, призначені у дослід, повинні бути підготовлені до нього за день. Одним з етапів підготовки тварин є депіляція (епіляція) – видалення волосся зі шкіри, коли це необхідно за умовами експерименту. Депіляцію не можна робити бритвою, тому що після гоління залишаються дрібні ураження шкіри, в які можуть попасти збудники раневих інфекцій.
Для видалення волосся існують різні депіляційні засоби : 30-36%-й водний розчин односірчистого натрію, суміш сірчистого барію та оксиду цинку у співвідношенні 1:2; 10%-на мазь сульфату кальцію на ланоліні; сульфгідрат кальцію; сульфіт стронцію, сірчистий барій та пшеничне борошно у співвідношенні 1:1 з невеликою кількістю води до пастоподібного стану та інші. Вони зберігаються в скляному посуді з притертими пробками. Депілятор змішують з водою до утворення кашоподібної маси, яку наносять дерев’яною лопаточкою на потрібну ділянку шкіри. Через 10-15 хв. її разом з шерстю знімають, оголену шкіру ретельно змивають водою та змащують вазеліном для запобігання сильного подразнення шкіри.
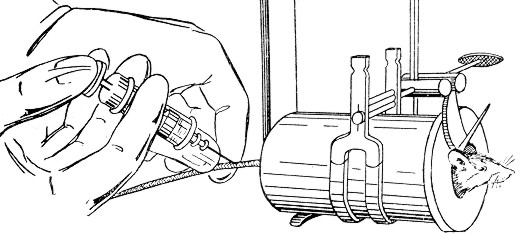
Фіксація тварин
Для уникнення травм (подряпин чи укусів) при проведенні дослідів лабораторних тварин потрібно фіксувати у певному положенні. Для іммобілізації тварин використовують спеціальні станки, циліндри з металу або плексигласу, утримувачі, ящики, де можна закріпити мордочки, лапки або саму тварину, фіксування руками, обгортання рушником, тощо (рис.2.6). Тварину можна фіксувати на спині або на животі.
За відсутності спеціальних пристроїв використовують підручні засоби – корнцанги, пінцети, рушники, рукавички та ін. Мишу беруть рукою, анатомічним пінцетом чи корнцангом за хвіст, а великим та вказівним пальцями іншої руки захоплюють складку шкіри біля потилиці. Пацюка фіксують з допомогою двох корнцангів, захоплюючи шкіру на потилиці одним, а шкіру хвоста іншим і
|
|
|
Рис.2.3. Схема нанесення барвників для кольорового маркірування тварин. |
|
|
|
Рис.2.4. Схема нанесення фарб на тіло тварини за Тойффелем. |
притиснувши його щільно до столу. Хом’яка ловлять ззаду так, щоб він не бачив руки, охоплюючи його за грудну клітину. Не слід брати його в гнізді – він може укусити. Кроликів беруть за верхню частину шкіри на спині, піднімаючи догори і підтримуючи іншою рукою задню частину тіла. У собак при проведенні досліджень необхідно фіксувати морду міцною вузькою стрічкою, яка зав’язується вузлом на потилиці.
|
|
|
Рис.2.5. Маркірування лабораторних тварин за Тойффелем. |
|
|
|
Рис.2.6. Фіксація дрібних лабораторних тварин за допомогою циліндру. |
Курей фіксують руками, однією тримають ноги, а другою – крила. Мавп з клітки ловлять сітками. Передні кінцівки зв’язують за спиною. Для захисту від сильних укусів використовують товсті шкіряні рукавички. Потрібно мати на увазі, що мавпи макаки-резуси з Південно-Східної Азії є носіями вірусу В, смертельного для людини, який відноситься до ІІ групи висококонтагіозних небезпечних вірусів.
Зараження лабораторних тварин. Методи.
Вибір методу ураження визначається тропізмом вірусу. Під тропізмом розуміють здатність вірусу реплікуватися в певних типах клітин організму. Віруси, що репродукуються у нервових клітинах, називають нейротропними (наприклад, вірус сказу), у клітинах шкіри – дерматропними (вірус віспи), в клітинах легень та дихальних шляхів – пневмотропними (вірус грипу), в клітинах шлунково-кишкового тракту – ентеротропними (вірус гепатиту А). Віруси, які здатні реплікуватися в декількох типах клітин, називають політропними (вірус інфекційного ринотрахеїту великої рогатої худоби – клітини органів дихання та розмноження), а в усіх типах клітин – пантропними (вірус чуми собак). Така класифікація вірусів за тропізмом називається класифікацією вірусів людини та тварин за Хюбнером.
Знаючи тропізм вірусу, матеріал вводять в органи, які містять чутливі до даного вірусу клітини (табл.2.6.). Наприклад, вірус грипу вводять в дихальні шляхи інтраназально (через ніс), вірус віспи у шкіру – субкутанно, кутанно або перкутанно (підшкірно, внутрішньошкірно та нашкірно, відповідно), вірус сказу у мозок – інтрацеребрально. Пантропні віруси швидше поширюються по організму при їх введенні внутрішньовенно або внутрішньочеревинно. Якщо тропізм вірусу невідомий, то використовують декілька груп тварин для ураження різними методами.
При цьому в залежності від способу зараження тварини одним і тим самим вірусом використовується різний об’єм вірусовмісної суспензії (табл.2.7).
Таблиця 2.6.