
- •Розділ 1. Організація вірусологічних лабораторій.
- •Обладнання вірусологічних лабораторій
- •Правила роботи в учбових вірусологічних лабораторіях
- •Практична частина
- •Контрольні питання та контрольні завдання
- •Література
- •Тема 1: Використання лабораторних тварин у вірусологічних дослідженнях
- •Природні інфекційні хвороби деяких лабораторних тварин, збудники яких є патогенними для людини
- •Індикаторні тварини
- •Гнотобіотичні тварини
- •Показники мікроклімату в приміщеннях для лабораторних тварин
- •Густота посадки в клітках лабораторних тварин та птахів
- •Причини канібалізму та заходи його профілактики
- •Основні показники нормальної життєдіяльності різних видів тварин
- •Зв’язок тропізму вірусу зі способом ураження чутливого організму та видом патологічного матеріалу
- •Допустимі дози досліджуваного матеріалу, що вводиться лабораторним тваринам, мл
- •Методи зараження через травний тракт
- •Перкутанне (нашкірне) зараження
- •Кутанне (шкірне) зараження
- •Субкутанне (підшкірне) зараження
- •Інтракутанне (внутрішньошкірне) зараження
- •Інтравенозне (внутрішньовенне) та інтракардіальне (внутрішньосерцеве) зараження
- •Інтрамускулярне (внутрішньом’язеве) зараження
- •Інтраперітонеальне (внутрішньочеревинне) зараження
- •Субокципітальне (каркове) зараження
- •Інтрацеребральне (внутрішньомозкове) зараження
- •Зараження в периферичний нерв
- •Інтратестикулярне (внутрішньосім’яникове) зараження
- •Інтраокулярне зараження
- •Корнеальне зараження
- •Інтракорнеальне зараження
- •Кон’юнктивальне зараження
- •Забір крові
- •Антикоагулянти
- •Лабораторне заняття
- •Тема 2. Курячі ембріони та їх використання у вірусології
- •Теоретична частина
- •Практична частина
- •Будова курячого ембріону
- •Практична частина Лабораторне заняття
- •Тема 3. Клітинні культури у вірусології
- •Теоретична частина
- •Класифікація тваринних культур клітин
- •Одношарові культури клітин
- •Чутливість первинних культур клітин до вірусів людини
- •Характеристика деяких із відомих клітинних ліній
- •Переваги та недоліки використання постійних культур клітин
- •Чутливість постійних клітинних культур до вірусів
- •Суспензійні культури клітин
- •Зберігання культур клітин
- •Умови культивування клітин in vitro
- •Поживні середовища
- •Середовище 199 (Морган, Мортон, Паркер; 1950 р.)
- •Контамінація культур клітин
- •Взаємодія вірусів із клітинами
- •Методи виявлення та ідентифікації вірусів у клітинних культурах
- •Цитопатична дія
- •Внутрішньоклітинні включення
- •Титрування вірусів у одношарових культурах клітин
- •Практична частина Лабораторне заняття
- •Хід роботи
- •Контрольні завдання
- •Контрольні запитання
- •Література
- •Розділ 3. Віруси бактерій
- •Теоретична частина Загальна характеристика вірусів бактерій
- •Практична частина Методи титрування бактеріофагів
- •Титрування фагу за методом Аппельмана (рідке середовище)
- •Хід роботи:
- •Практична робота: Виділення фагів із лізогенних культур
- •Розділ 4. Дослідження вірусів рослин
- •Теоретична частина
- •Практична частина
- •Тема. Способи передачі вірусів рослин. Рослини-індикатори.
- •Практична частина Лабораторне заняття
- •Тема. 2. Виділення, очистка та концентрування вірусів рослин
- •Практична частина
- •Теоретична частина
- •Розділ 5. Використання електронної мікроскопії у вірусологічних дослідженнях.
- •Практична частина Хід роботи
- •Розділ. 6. Методи діагностики вірусних інфекцій та ідентифікації вірусів
- •Тема 1. Серологічні методи досліджень
- •Теоретична частина Реакція гемаглютинації
- •Імунологічні методи дослідження
- •Імунодифузійні тести.
- •Радіоімунологічний аналіз (ріа)
- •Імунофлуоресцентний аналіз (іф)
- •Імуноферментний аналіз
- •Практична частина Практична робота №1
- •Хід роботи
- •Практична робота №2
- •Хід роботи
- •Список літератури
- •Тема 2. Застосування полімеразної ланцюгової реакції у вірусологчних дослідженнях
- •Обладнання для плр
- •Компоненти реакції.
- •Параметри температурних циклів
- •Аналіз плр-ампліфікованої днк
- •Real-time pcr (прл у реальному часі) та її застосування у вірусологічних дослідженнях.
- •Словник використаних термінів
- •Верхній агар
- •Нижній агар
- •Цитратний буфер, 0,1м, рН 3,0 –6,2
- •Ацетатний буфер,0,1м , рН 3.6-5,6 Розчин а
- •0,1М оцтова кислота
- •С) Солі та інші речовини, г/л
Практична частина Методи титрування бактеріофагів
Активність бактеріофагу визначають за його властивістю викликати лізис бактеріальної культури в рідких або твердих середовищах і чисельно виражають ступенем максимального розведення, в якому досліджуваний фаг проявив свою літичну дію. Вид середовища, як правило, визначається здатністю певного фагу лізувати культуру в рідкому чи твердому поживному середовищі.
При дослідженні в рідкому середовищі (за Аппельманом) титр фагу– це найбільше його розведення (або найменша кількість), яке повністю стримує (пригнічує) ріст тест-культури в умовах даного досліду.
На твердому середовищі (титрування за Граціа) титр фагу – кількість часток фагу в 1 мл досліджуваного матеріалу.
Титрування фагу за методом Аппельмана (рідке середовище)
Завдання: опанувати методику титрування бактеріофагів в рідкому поживному середивищі, визначити титр бактеріофагу Т4.
Матеріальне забезпечення: Пробірки з ватно-марлевими пробками, штатив, груші та піпетки (самплери та носики), маркери, поживне середовище (LB), нічна бактеріальна культура, бактеріофаг, термостат.
Хід роботи:
-
В 9 стерильних пробірок вносять по 4,5 мл поживного середовища. Пробірки ставлять в штатив і нумерують від 1 до 7, на 8 пробірці ставлять позначку КК (контроль культури), на 9 - КФ (контроль фагу). Всі дослідні пробірки повинні бути підписані.
-
В пробірках під номерами від 1 до 7 готують послідовні десятикратні розведення фагу від 101 до 107. В першу пробірку вносять 0,5 мл фагу. Таку ж його кількість вносять в пробірку контролю фагу під №9. Замінивши піпетку новою, ретельно перемішують вміст 1-ї пробірки і переносять 0,5 мл його в 2-гу пробірку, 0,5 мл вмісту 2-ї пробірки переносять в 3-тю і так далі до 7-ї пробірки. Кожен раз необхідно брати нові піпетки (або носики). Перемішавши вміст 7-ї пробірки, 0,5 мл розведення із неї виливають в дезрозчин. Так само чинять із вмістом пробірки №9 - контролем фагу (рис. 3.8).
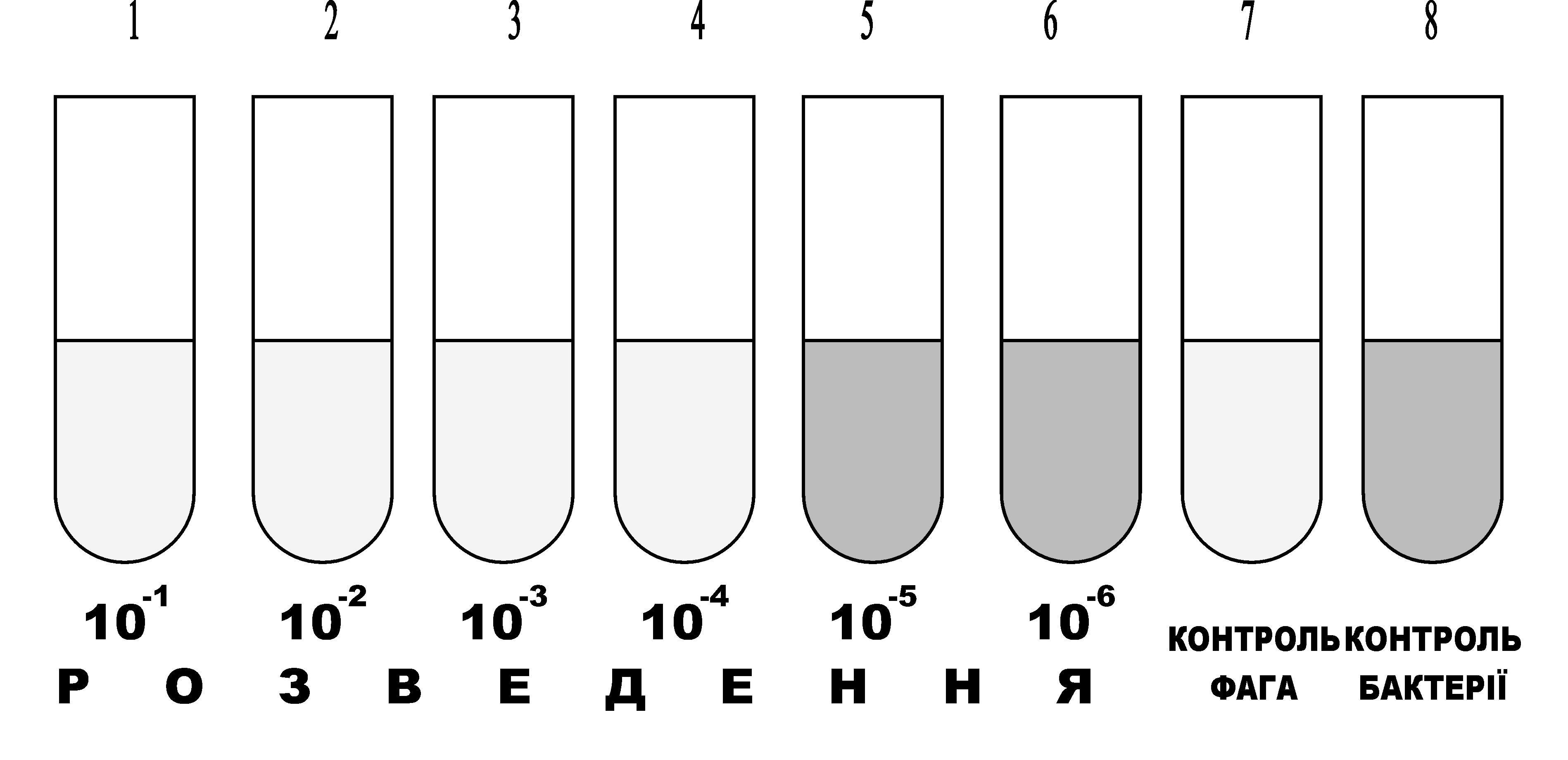
Рис.3.8. Результати титрування бактеріофагів за Апельманом
-
У всі пробірки досліду, крім пробірки №7, вносять по 1 краплині (0,05 мл) суспензії тест-культури. Внесення культури проводять однією піпеткою з пробірки № 9 до №1. Пробірки разом із штативом струшують. У всіх пробірках досліду, крім пробірки на контроль фагу, повинна з’явитись ледь помітна мутність.
-
Пробірки ставлять в термостат на 18-20 годин, після чого проводять облік результатів титрування, розпочинаючи з контролів.
При титруванні фагу ставлять такі контролі: контроль фагу і середовища на стерильність, контроль тест-культури на її життєву активність.
При правильній постановці досліду в контролі культури відбулося інтенсивне розмноження бактерій і вона стала мутною, що добре видно візуально. Цей контроль дозволяє зробити висновок, що тест-культура, на якій титрували фаг, життєздатна, поживне середовище забезпечує їй оптимальний розвиток в умовах досліду. Виходячи із результатів росту тест-культури в контролі, можна зробити висновок: якщо в пробірках з фагом культура не виросла, то на неї подіяв фаг. Рідина в пробірці з контролем на фаг повинна лишатись прозорою. Це дозволяє зробити висновок, що посуд, середовище і фаг стерильні.
Враховують характер змін в титраційному ряду пробірок від №1 до №7 (рис. ). Ріст культури в пробірках титраційного (дослідного) ряду свідчить про відсутність в них фагу. Визначають титр фагу, тобто його найбільше розведення, яке здатне викликати лізис культури (вміст пробірки в порівнянні з контролем на ріст культури прозорий). Позначається титр фагу степенем розведення фагу з від’ємним знаком, що відповідає порядковому номеру пробірки. Наприклад, якщо в перших чотирьох пробірках титраційного ряду відсутній ріст культури, а в наступних пробірках культура росте, то титр фагу буде 104 фагових частинок на мілілітр (рис. ).
Методичні рекомендації:
Найголовніша вимога при роботі з бактеріями – це стерильність роботи. Всі операції слід виконувати біля полум’я пальника або в стерильному боксі. Лабораторний посуд, інстументарій та поживні середовища попередньо стерилізуються в автоклаві. До початку роботи необхідно обробити робоче місце ультрафілетом та спиртом. Роботу бажано проводити в гумових рукавичках, оскільки E.coli є умовно патогенною бактерією.
При розведенні бактеріофагу необхідно кожного разу брати нову піпетку (носик для самплера). Після додавання фагу в поживне середовище слід ретельно перемішати вміст пробірки. При титруванні фагу об’єм і склад середовища, температура, аерація, кількість бактерій повинні бути однакові. Змінною є тільки кількість внесеного фагу.
Практична робота: Титрування фагу методом агарових шарів
Досить точним методом оцінки активності бактеріофагу є визначення кількості інфекційно-активних одиниць бактеріофагу в одиниці об’єму (титр бактеріофагу). Для цієї мети, як правило, користуються методом агарових шарів, запропонаваним Граціа (1936 р.). Суть методу полягає у тому, що культуру індикаторних бактерій в “м’якому” (0.7%) агарі при 46ОС заражають фагом у відповідному розведенні. Цю суміш виливають на поверхню захоловшого 1.4% поживного агару, дають захолонути верхньому шару агару і ставлять на інкубацію в термостат. На протязі 6-12 годин бактерії розмножуються всередині м’якого шару агару. Низька концентрація верхнього шару сприяє дифузії фагових частинок. В результаті фагові частинки заражають бактеріальні клітини, які знаходяться по сусідству з ними, розмножуються та лізують їх. Фагове потомство інфікує надалі сусідні бактерії, які, в свою чергу, піддаються лізису в результаті появи другого покоління фагу, і так далі. В результаті на бактеріальному газоні утворюються прозорі зони відсутності росту бактерій - негативні колонії або бляшки. Утворення кожної бляшки викликається однією частинкою бактеріофагу. Отже, число негативних колоній може слугувати кількісним показником вмісту інфекційних фагових частинок в досліджуваному розчині.
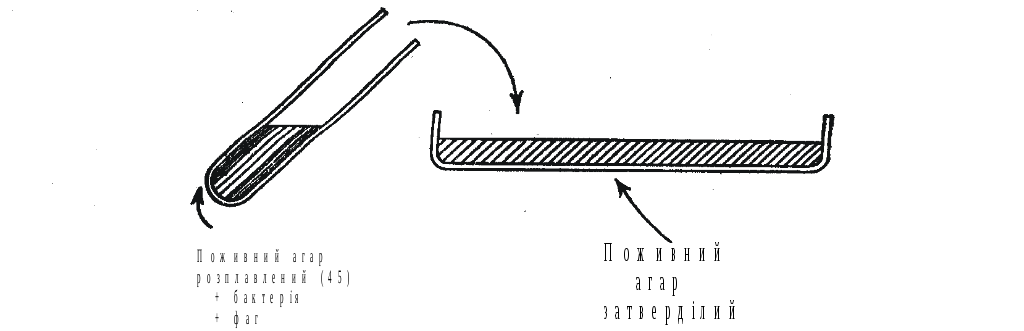
Рис.3.9. Техніка виконання досліду за методом агарових шарів.
Завдання: опанувати методику титрування бактеріофагів методом подвійних агарових шарів, визначити титр бактеріофагу Т4.
Матеріальне забезпечення: Пробірки з ватно-марлевими пробками, чашки Петрі, штатив, груші та піпетки (самплери та носики), маркери, поживне середовище (LB), агаризоване середовище (0,7% та 1,4%) нічна бактеріальна культура, бактеріофаг, термостат, водяна баня.
Хід роботи:
-
1,4% агар заливають в чашки Петрі по 2,5-3,0 мл, підсушують (Рис. 3.9).
-
Досліджуваний фаг титрують методом 10-кратних розведень (як і в методі Аппельмана). Контроль (пробірка №8) ставлять на ріст бактеріальної культури, №9 - на стерильність фагу та середовища.
-
В пробірку наливають 2,5 мл розплавленого 0,7%-ного агару та охолоджують до 450С, потім додають 1мл бактеріофагу в певному розведенні і 0,2 мл бактеріальної культури. Вміст пробірки ретельно перемішують та виливають в чашки Петрі на нижній агар. Нумерація чашок Петрі з нижнім і пробірок з верхнім агаром відповідає нумерації розведень фага. Ті ж самі висіви проводять із контрольних пробірок, які позначають як контролі на ріст бактерій (№8) та стерильність фагу (№9).
-
Після того, як верхній шар захолов, чашки Петрі ставлять на інкубацію (в термостат на 18-20 годин при 37оС). Для статистичної достовірності кожен дослід проводять в трьох повторностях.
Облік результатів титрування показує, що при великій концентрації фагу (перші 4 чашки) спостерігається суцільний лізис культур - чашки прозорі. В тих розведеннях фагу, де спостерігається зменшення кількості фагу, з‘являються окремі ізольовані негативні колонії, які можна підрахувати. Кількість негативних колоній знаходиться в оберненій залежності від розведення фагу. Щоб вирахувати кількість фагових часток в 1 мл фаголізату, користуються формулою:
n = y x ,
де: n - кількість фагових часток; y - кількість негативних колоній фага на ч. Петрі; x - розведення фагу.
Наприклад, якщо в ч. Петрі №7 (розведення фагу 107) утворилося 15 негативних колоній, то титр даного фагу буде дорівнювати кількості негативних колоній, помноженій на розведення фагу, тобто 15 107 або 1,5 108 ф/мл.
Методичні рекомендації:
Найголовнійша вимога при роботі з бактеріями – це стерильність роботи. Всі операції слід виконувати біля полум’я пальника або в стерильному боксі. Лабораторний посуд, інстументарій та поживні середовища попередньо стерилізуються в автоклаві. До початку роботи необхідно обробити робоче місце ультрафілетом та спиртом. Роботу бажано проводити в гумових рукавичках, оскільки E.coli є умовно патогенною бактерією.
При розведенні бактеріофагу необхідно кожного разу брати нову піпетку (носик для самплера). Після додавання фагу в верхній агар слід ретельно перемішати вміст пробірки та обережно вилити на поверхню нижнього застигшого та підсушеного агару. Після того, як верхній агар застигає, чашки Петрі ставлять у термостат. Оскільки на кришках чашок збирається конденсат, який при зкапуванні на бактеріальний газон може зпотворювати результати титрування, то чашки Петрі ставлять кришками до низу. При титруванні фагу об’єм і склад середовища, температура, кількість бактерій повинні бути однакові. Змінною є тільки кількість внесеного фагу.
Більш точні результати титрування фагу цим методом отримують тоді, коли визначають кількість частинок фагу в вихідній рідині по декількох розведеннях і визначають їх середнє арифметичне.
Слід зазначити, що підраховувати негативні колонії краще на чашках Петрі, де виросло не менше 5, але не більше 50 негативних колоній, тому що більша та менша кількість негативних колоній дасть неточні результати. Якщо ж на чашках Петрі утворилась велика кількість негативних колоній, то її розділяють на 2, 4, 6 і більше секторів, а потім отриману цифру множать на кількість секторів.
