
- •«Национальный исследовательский
- •Томский политехнический Университет»
- •Е.В. Михеева, н.П. Пикула, а.П. Асташкина
- •Коллоидная химия
- •Оглавление
- •Глава 1 дисперсные системы
- •1.1. Общая характеристика дисперсных систем
- •1.1.1. Признаки объектов коллоидной химии
- •1.1.2. Специфические особенности высокодисперсных систем
- •1.2. Классификации дисперсных систем
- •1.2.1. Классификация по размерам частиц дисперсной фазы
- •1.2.2. Классификация по агрегатному состоянию дисперсной фазы и дисперсионной среды
- •1.2.3. Классификация по силе межфазного взаимодействия дисперсной фазы и дисперсионной среды
- •1.2.4. Классификация по подвижности частиц дф (по структуре)
- •1.2.5. Классификация по фазовой различимости
- •1.2.6. Классификация по топографическому признаку (по форме частиц)
- •1.3. Методы получения дисперсных систем
- •1.3.1. Диспергационные методы
- •1.3.2. Конденсационные методы
- •1.3.2.1. Физические конденсационные методы
- •1.3.2.2. Химические конденсационные методы
- •2. Реакции обмена
- •3. Реакции окисления
- •1.3.3. Метод пептизации
- •1.4. Методы очистки дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 2 термодинамика поверхностных явлений
- •2.1. Классификация поверхностных явлений
- •2.2. Свободная поверхностная энергия и поверхностное натяжение
- •2.2.1. Физический смысл поверхностного натяжения
- •2.2.2. Термодинамическое определение поверхностного натяжения
- •2.2.3. Единицы измерения поверхностного натяжения
- •2.3. Влияние различных факторов на величину поверхностного натяжения
- •2.3.1. Влияние химической природы вещества
- •2.3.2. Влияние температуры
- •2.3.3. Влияние природы граничащих фаз
- •2.3.4. Влияние природы и концентрации растворенного вещества
- •2.4. Межмолекулярные и межфазные взаимодействия
- •2.4.1. Когезия
- •2.4.2. Адгезия
- •2.4.3. Растекание одной жидкости по поверхности другой
- •2.4.4. Смачивание
- •2.4.4.1. Анализ уравнения Юнга
- •2.4.4.2. Флотация
- •2.5. Особенности искривленной поверхности раздела фаз
- •2.5.1. Уравнение Лапласа
- •2.5.2. Капиллярное давление. Течение жидкости в капиллярах
- •2.6. Методы определения поверхностного натяжения
- •2.6.1. Метод наибольшего давления пузырька газа (метод Ребиндера)
- •2.6.2. Сталагмометрический метод (метод счета капель)
- •2.6.3. Метод капиллярного поднятия жидкости
- •2.7. Влияние кривизны поверхности на давление насыщенного пара
- •2.7.1. Уравнения Томсона (Кельвина)
- •2.7.2. Капиллярная конденсация
- •2.7.3. Изотермическая перегонка
- •Вопросыи задания для самоконтроля
- •Глава 3 адсорбция
- •3.1. Основные понятия и определения
- •3.1.1. Количественные способы выражения величины адсорбции
- •3.1.2. Классификации адсорбции
- •1. Классификация по природе границы раздела
- •2. Классификация по типу взаимодействия адсорбата и адсорбента
- •3.1.3. Основные экспериментальные зависимости адсорбции
- •3.2.Адсорбция на границе твердое тело – газ
- •3.2.1. Теория мономолекулярной адсорбции Лэнгмюра
- •3.2.2. Эмпирическое уравнение адсорбции Фрейндлиха
- •3.2.3. Теория полимолекулярной адсорбции Поляни
- •3.2.4. Дальнейшие представления о многослойной адсорбции. Теория бэт
- •3.2.5. Адсорбция на пористых адсорбентах
- •3.2.6.Адсорбенты и их характеристики
- •3.3.Адсорбция на границе жидкость – газ
- •3.3.1. Фундаментальное уравнение адсорбции Гиббса
- •3.3.2. Свойства поверхностно-активных (пав) и поверхностно-инактивных (пив) веществ
- •3.3.3. Строение адсорбционного слоя на границе раствор–газ
- •3.3.4. Уравнение Шишковского
- •3.3.5. Поверхностная активность. Правило Дюкло – Траубе
- •3.3.6. Расчет гиббсовской адсорбции из изотермы поверхностного натяжения методом графического дифференцирования
- •3.3.7.Применение уравнения изотермы Лэнгмюра к адсорбции на границе жидкость–газ. Расчет молекулярных характеристик исследуемого пав
- •3.3.8. Мицеллообразование в растворах коллоидных пав
- •3.3.9. Классификации пав
- •3.3.10. Солюбилизация
- •3.3.11. Практическое значение пав
- •3.3.12. Проблемы биоразлагаемости промышленных пав
- •3.4.Адсорбция на границе твердое тело – раствор
- •3.4.1. Молекулярная адсорбция
- •3.4.2. Ионная адсорбция
- •3.4.3. Ионообменная адсорбция. Ионный обмен
- •Вопросыи задания для самоконтроля
- •Глава 4 электрические свойства дисперсных систем
- •4.1. Электрокинетические явления
- •4.1.1. Механизм образования двойного электрического слоя
- •1. Неравенство электрохимических потенциалов ионов в кристаллической решетке твердого тела и ионов в растворе
- •Адсорбционный механизм образования дэс
- •Механизм поверхностной диссоциации
- •2. Специфическая адсорбции ионов на поверхности твердой фазы
- •3. Ориентированная адсорбция поверхностно-активных веществ
- •4.2. Теории строения двойного электрического слоя
- •4.2.1. Экспериментальные факты, послужившие основой для создания теорий строения дэс
- •4.2.2. Теория строения дэс Гельмгольца – Перрена
- •4.2.3. Теория строения дэс Гуи – Чэпмена
- •4.2.4. Современная теория строения дэс Штерна
- •4.3. Электрокинетический потенциал
- •4.3.1. Определение электрокинетического потенциала из электрокинетических явлений
- •4.3.2. Практическое значение электрокинетических явлений
- •4.4. Строение коллоидных мицелл
- •4.4.1. Примеры мицелл гидрофобных золей в природе
- •Вопросы и задания для самоконтроля
- •Глава 5 устойчивость и коагуляция лиофобных дисперсных систем
- •5.1. Основные понятия и определения
- •5.1.1. Факторы агрегативной устойчивости лиофобных систем
- •5.2. Коагуляция
- •Стадии коагуляции
- •5.2.1. Кинетика коагуляции. Теория кинетики быстрой коагуляции Смолуховского
- •5.2.2. Коагуляция золей электролитами
- •Эмпирические правила электролитной коагуляции
- •5.3. Теория устойчивости лиофобных дисперсных систем длфо
- •5.3.1. Расклинивающее давление
- •Составляющие расклинивающего давления
- •5.3.2. Энергия электростатического отталкивания
- •5.3.3. Энергия молекулярного притяжения
- •5.3.4. Потенциальные кривые взаимодействия частиц
- •5.4. Закономерности коагуляции гидрофобных золей электролитами
- •5.4.1. Особые явления при коагуляции
- •Коагуляция смесью электролитов
- •5.4.2. Примеры коагуляции. Образование почв
- •5.4.3. Физико-химические методы очистки сточных вод
- •Вопросыи задания для самоконтроля
- •Глава 6 структурно-механические свойства дисперсных систем
- •6.1. Типы структур
- •6.2. Реологические свойства дисперсных систем
- •6.2.1. Вязкость жидких дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 7 оптические свойства дисперсных систем
- •7.1. Рассеяние света в дисперсных системах
- •7.2. Поглощение света в дисперсных системах
- •7.3. Окраска дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 8 молекулярно-кинетические свойства дисперсных систем
- •8.1. Осмос
- •8.2. Диффузия
- •8.3. Броуновское движение
- •8.4. Седиментационное равновесие
- •8.5. Седиментационный анализ
- •Вопросы и задания для самоконтроля
- •Глава 9 краткая характеристика основных дисперсных систем
- •9.1. Системы с жидкой дисперсионной средой
- •9.1.1. Суспензии и золи
- •Классификация суспензий
- •Получение суспензий
- •Значение суспензий
- •9.1.2. Эмульсии
- •Классификация эмульсий
- •Агрегативная устойчивость эмульсии и природа эмульгатора
- •9.1.3. Пены
- •9.2. Системы с газообразной дисперсионной средой
- •9.2.1. Аэрозоли
- •Классификации аэрозолей
- •Агрегативная устойчивость аэрозолей. Коагуляция
- •Методы разрушения аэрозолей
- •9.3. Системы с твердой дисперсионной средой
- •Вопросыи задания для самоконтроля
- •Перечень используемой литературы
- •Коллоидная химия
- •В авторской редакции
- •Отпечатано в Издательстве тпу в полном соответствии с качеством предоставленного оригинал-макета
Глава 2 термодинамика поверхностных явлений
В дисперсных системах большая часть всех молекул или атомов, составляющих вещество, находится на поверхности раздела фаз. Эти поверхностные молекулы отличаются от молекул, находящихся внутри фазы по своему энергетическому состоянию, что приводит к возникновению избыточной поверхностной энергии. Избыточная поверхностная энергия равна произведению поверхностного натяжения на площадь межфазной поверхности:
![]() .
.
Любая термодинамическая система стремиться уменьшить свою поверхностную энергию. Избыточная поверхностная энергия может уменьшиться за счет:
уменьшения поверхностного натяжения: адсорбция, адгезия, смачивание, образование двойного электрического слоя;
уменьшения площади поверхности: сферическая форма капель (сглаживание поверхности), объединение частиц (коагуляция, агрегация, коалесценция).
2.1. Классификация поверхностных явлений
Рассмотрим классификацию поверхностных явлений в соответствии с объединенным уравнением первого и второго начал термодинамики для поверхностного слоя относительно изменения энергии Гиббса:
![]() ,
(2.1)
,
(2.1)
где
Т
– температура; S
– энтропия; р
– давление; V
– объем; s
– площадь поверхности;
![]() – поверхностное натяжение;
– поверхностное натяжение;![]() – химический потенциалi-го
компонента; ni
– число моль
i-го
компонента;
– химический потенциалi-го
компонента; ni
– число моль
i-го
компонента;
![]() – электрический потенциал;q
– количество
электричества.
– электрический потенциал;q
– количество
электричества.
В
уравнении (2.1) приращение свободной
энергии Гиббса представлено как
алгебраическая сумма приращений
различных видов энергии: тепловой,
механической, поверхностной, химической
и электрической. Выделим из всей суммы
поверхностную энергию
![]() ,
которая представлена в уравнении как
произведение поверхностного натяжения
,
которая представлена в уравнении как
произведение поверхностного натяжения![]() (интенсивный фактор) на величину
поверхностиs
(экстенсивный фактор). Из уравнения
(2.1) следует, что поверхностная энергия
способна переходить в другие виды
энергии, что приводит к возникновению
различных поверхностных явлений. Так,
например, превращение поверхностной
энергии в энергию Гиббса (dG)
сопровождает изменение реакционной
способности
с изменением
дисперсности, что количественно
описывается уравнением Томсона
(Кельвина). В результате превращения
поверхностной энергии в теплоту (
(интенсивный фактор) на величину
поверхностиs
(экстенсивный фактор). Из уравнения
(2.1) следует, что поверхностная энергия
способна переходить в другие виды
энергии, что приводит к возникновению
различных поверхностных явлений. Так,
например, превращение поверхностной
энергии в энергию Гиббса (dG)
сопровождает изменение реакционной
способности
с изменением
дисперсности, что количественно
описывается уравнением Томсона
(Кельвина). В результате превращения
поверхностной энергии в теплоту (![]() )
происходит смачивание и адгезия, что
количественно оценивается уравнением
Дюпре, превращение в механическую
энергию (Vdp)
связывается с капиллярными явлениями,
основой которых служит уравнение
Лапласа. Поверхностное явление, называемое
адсорбцией, сопровождает превращение
поверхностной энергии в химическую (
)
происходит смачивание и адгезия, что
количественно оценивается уравнением
Дюпре, превращение в механическую
энергию (Vdp)
связывается с капиллярными явлениями,
основой которых служит уравнение
Лапласа. Поверхностное явление, называемое
адсорбцией, сопровождает превращение
поверхностной энергии в химическую (![]() )
и оценивается уравнением Гиббса. И,
наконец, превращение поверхностной
энергии в электрическую (
)
и оценивается уравнением Гиббса. И,
наконец, превращение поверхностной
энергии в электрическую (![]() ),
приводит к электрическим явлениям
(уравнение
Липпмана).
),
приводит к электрическим явлениям
(уравнение
Липпмана).
2.2. Свободная поверхностная энергия и поверхностное натяжение
2.2.1. Физический смысл поверхностного натяжения
Поверхностное натяжение относится к числу наиболее важных свойств дисперсных систем и является основной термодинамической характеристикой поверхности раздела. Рассмотрим наиболее простой случай – поверхностное натяжение жидкости на границе с газом (рис. 2.1).

Рис. 2.1. Межмолекулярное взаимодействие внутри жидкости и на поверхности раздела фаз
На молекулу, находящуюся внутри жидкости, действуют силы взаимного притяжения (силы молекулярного сцепления) со стороны всех окружающих ее соседних молекул. Равнодействующая этих сил равна нулю вследствие симметрии силового поля, и для перемещения молекулы внутри жидкости не требуется затрачивать работу. Это вызвано тем, что в газообразной фазе молекулы удалены друг от друга на большие расстояния, и действующие между ними силы взаимного притяжения очень малы. Молекулы, находящиеся на границе раздела фаз, испытывают действие межмолекулярных сил в большей степени со стороны жидкой фазы f1, чем со стороны газообразной f2 (f1 >> f2). Результирующая сила F, пропорциональной разности сил (f1 – f2), направлена внутрь жидкости. Эта сила, отнесенная к единице поверхности (1 м2 или 1 см2), называется внутренним (молекулярным) давлением pM:
![]() .
.
Молекулярное давление определяется силой сцепления молекул, оно тем выше, чем полярнее вещество, так для H2O величина рМ равна 14000 атм, для C6H6 – 3800 атм. Таким образом, на поверхности любой жидкости существует огромное давление, вызванное нескомпенсированностью молекулярных сил сцепления в поверхностном слое и стремящееся затянуть все молекулы с поверхности внутрь жидкой фазы. Этим объясняется шарообразная форма капель жидкости.
Поверхностный слой вследствие нескомпенсированности молекулярных сил имеет избыточную свободную энергию по сравнению с объемом жидкости. Этот избыток свободной энергии, отнесенный к единице поверхности (1 м2 или 1 см2), называется удельной свободной поверхностной энергией (поверхностным натяжением). Весь избыток поверхностной энергии заключен в слое толщиной в 1 молекулу. Наличие на поверхности раздела фаз избытка энергии означает, что для образования новой поверхности требуется совершить работу.
Поверхностное
натяжение
(![]() )
– работа обратимого изотермического
процесса, затраченная на образование
единицы площади поверхности раздела
фаз (энергетическое определение
поверхностного натяжения):
)
– работа обратимого изотермического
процесса, затраченная на образование
единицы площади поверхности раздела
фаз (энергетическое определение
поверхностного натяжения):
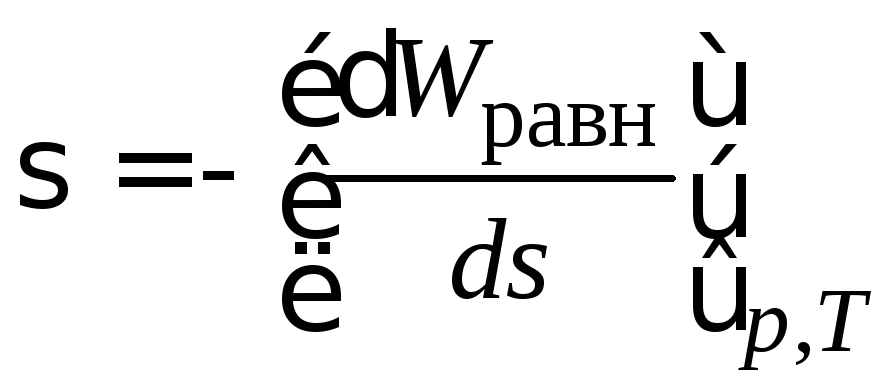 . (2.2)
. (2.2)
Знак минус говорит о том, что положительная работа совершается при уменьшении или сокращении поверхности.
Силовое определение: поверхностное натяжение – сила, направленная тангенциально (параллельно) к поверхности и приходящаяся на единицу длины периметра, ограничивающего эту поверхность.
Физическая сущность – поверхностные молекулы стремятся уйти вглубь конденсированной фазы, тем самым, сжимая поверхность.
Оба эти определения необходимо рассматривать в единстве. Такое единство энергетического и силового подходов сложилось исторически. Величина поверхностного натяжения была введена в физику задолго до появления понятия энергии и рассматривалась как сила, стягивающая гипотетическую пленку на поверхности жидкости и противодействующая ее растяжению. Силовое определение более справедливо для жидкостей, т.к. у них одновременно с образованием поверхности молекулы и атомы на ней ориентируются, уплотняются, переходя в равновесное состояние и вызывая тем самым тангенциальное натяжение поверхности.
