- •«Национальный исследовательский
- •Томский политехнический Университет»
- •Е.В. Михеева, н.П. Пикула, а.П. Асташкина
- •Коллоидная химия
- •Оглавление
- •Глава 1 дисперсные системы
- •1.1. Общая характеристика дисперсных систем
- •1.1.1. Признаки объектов коллоидной химии
- •1.1.2. Специфические особенности высокодисперсных систем
- •1.2. Классификации дисперсных систем
- •1.2.1. Классификация по размерам частиц дисперсной фазы
- •1.2.2. Классификация по агрегатному состоянию дисперсной фазы и дисперсионной среды
- •1.2.3. Классификация по силе межфазного взаимодействия дисперсной фазы и дисперсионной среды
- •1.2.4. Классификация по подвижности частиц дф (по структуре)
- •1.2.5. Классификация по фазовой различимости
- •1.2.6. Классификация по топографическому признаку (по форме частиц)
- •1.3. Методы получения дисперсных систем
- •1.3.1. Диспергационные методы
- •1.3.2. Конденсационные методы
- •1.3.2.1. Физические конденсационные методы
- •1.3.2.2. Химические конденсационные методы
- •2. Реакции обмена
- •3. Реакции окисления
- •1.3.3. Метод пептизации
- •1.4. Методы очистки дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 2 термодинамика поверхностных явлений
- •2.1. Классификация поверхностных явлений
- •2.2. Свободная поверхностная энергия и поверхностное натяжение
- •2.2.1. Физический смысл поверхностного натяжения
- •2.2.2. Термодинамическое определение поверхностного натяжения
- •2.2.3. Единицы измерения поверхностного натяжения
- •2.3. Влияние различных факторов на величину поверхностного натяжения
- •2.3.1. Влияние химической природы вещества
- •2.3.2. Влияние температуры
- •2.3.3. Влияние природы граничащих фаз
- •2.3.4. Влияние природы и концентрации растворенного вещества
- •2.4. Межмолекулярные и межфазные взаимодействия
- •2.4.1. Когезия
- •2.4.2. Адгезия
- •2.4.3. Растекание одной жидкости по поверхности другой
- •2.4.4. Смачивание
- •2.4.4.1. Анализ уравнения Юнга
- •2.4.4.2. Флотация
- •2.5. Особенности искривленной поверхности раздела фаз
- •2.5.1. Уравнение Лапласа
- •2.5.2. Капиллярное давление. Течение жидкости в капиллярах
- •2.6. Методы определения поверхностного натяжения
- •2.6.1. Метод наибольшего давления пузырька газа (метод Ребиндера)
- •2.6.2. Сталагмометрический метод (метод счета капель)
- •2.6.3. Метод капиллярного поднятия жидкости
- •2.7. Влияние кривизны поверхности на давление насыщенного пара
- •2.7.1. Уравнения Томсона (Кельвина)
- •2.7.2. Капиллярная конденсация
- •2.7.3. Изотермическая перегонка
- •Вопросыи задания для самоконтроля
- •Глава 3 адсорбция
- •3.1. Основные понятия и определения
- •3.1.1. Количественные способы выражения величины адсорбции
- •3.1.2. Классификации адсорбции
- •1. Классификация по природе границы раздела
- •2. Классификация по типу взаимодействия адсорбата и адсорбента
- •3.1.3. Основные экспериментальные зависимости адсорбции
- •3.2.Адсорбция на границе твердое тело – газ
- •3.2.1. Теория мономолекулярной адсорбции Лэнгмюра
- •3.2.2. Эмпирическое уравнение адсорбции Фрейндлиха
- •3.2.3. Теория полимолекулярной адсорбции Поляни
- •3.2.4. Дальнейшие представления о многослойной адсорбции. Теория бэт
- •3.2.5. Адсорбция на пористых адсорбентах
- •3.2.6.Адсорбенты и их характеристики
- •3.3.Адсорбция на границе жидкость – газ
- •3.3.1. Фундаментальное уравнение адсорбции Гиббса
- •3.3.2. Свойства поверхностно-активных (пав) и поверхностно-инактивных (пив) веществ
- •3.3.3. Строение адсорбционного слоя на границе раствор–газ
- •3.3.4. Уравнение Шишковского
- •3.3.5. Поверхностная активность. Правило Дюкло – Траубе
- •3.3.6. Расчет гиббсовской адсорбции из изотермы поверхностного натяжения методом графического дифференцирования
- •3.3.7.Применение уравнения изотермы Лэнгмюра к адсорбции на границе жидкость–газ. Расчет молекулярных характеристик исследуемого пав
- •3.3.8. Мицеллообразование в растворах коллоидных пав
- •3.3.9. Классификации пав
- •3.3.10. Солюбилизация
- •3.3.11. Практическое значение пав
- •3.3.12. Проблемы биоразлагаемости промышленных пав
- •3.4.Адсорбция на границе твердое тело – раствор
- •3.4.1. Молекулярная адсорбция
- •3.4.2. Ионная адсорбция
- •3.4.3. Ионообменная адсорбция. Ионный обмен
- •Вопросыи задания для самоконтроля
- •Глава 4 электрические свойства дисперсных систем
- •4.1. Электрокинетические явления
- •4.1.1. Механизм образования двойного электрического слоя
- •1. Неравенство электрохимических потенциалов ионов в кристаллической решетке твердого тела и ионов в растворе
- •Адсорбционный механизм образования дэс
- •Механизм поверхностной диссоциации
- •2. Специфическая адсорбции ионов на поверхности твердой фазы
- •3. Ориентированная адсорбция поверхностно-активных веществ
- •4.2. Теории строения двойного электрического слоя
- •4.2.1. Экспериментальные факты, послужившие основой для создания теорий строения дэс
- •4.2.2. Теория строения дэс Гельмгольца – Перрена
- •4.2.3. Теория строения дэс Гуи – Чэпмена
- •4.2.4. Современная теория строения дэс Штерна
- •4.3. Электрокинетический потенциал
- •4.3.1. Определение электрокинетического потенциала из электрокинетических явлений
- •4.3.2. Практическое значение электрокинетических явлений
- •4.4. Строение коллоидных мицелл
- •4.4.1. Примеры мицелл гидрофобных золей в природе
- •Вопросы и задания для самоконтроля
- •Глава 5 устойчивость и коагуляция лиофобных дисперсных систем
- •5.1. Основные понятия и определения
- •5.1.1. Факторы агрегативной устойчивости лиофобных систем
- •5.2. Коагуляция
- •Стадии коагуляции
- •5.2.1. Кинетика коагуляции. Теория кинетики быстрой коагуляции Смолуховского
- •5.2.2. Коагуляция золей электролитами
- •Эмпирические правила электролитной коагуляции
- •5.3. Теория устойчивости лиофобных дисперсных систем длфо
- •5.3.1. Расклинивающее давление
- •Составляющие расклинивающего давления
- •5.3.2. Энергия электростатического отталкивания
- •5.3.3. Энергия молекулярного притяжения
- •5.3.4. Потенциальные кривые взаимодействия частиц
- •5.4. Закономерности коагуляции гидрофобных золей электролитами
- •5.4.1. Особые явления при коагуляции
- •Коагуляция смесью электролитов
- •5.4.2. Примеры коагуляции. Образование почв
- •5.4.3. Физико-химические методы очистки сточных вод
- •Вопросыи задания для самоконтроля
- •Глава 6 структурно-механические свойства дисперсных систем
- •6.1. Типы структур
- •6.2. Реологические свойства дисперсных систем
- •6.2.1. Вязкость жидких дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 7 оптические свойства дисперсных систем
- •7.1. Рассеяние света в дисперсных системах
- •7.2. Поглощение света в дисперсных системах
- •7.3. Окраска дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 8 молекулярно-кинетические свойства дисперсных систем
- •8.1. Осмос
- •8.2. Диффузия
- •8.3. Броуновское движение
- •8.4. Седиментационное равновесие
- •8.5. Седиментационный анализ
- •Вопросы и задания для самоконтроля
- •Глава 9 краткая характеристика основных дисперсных систем
- •9.1. Системы с жидкой дисперсионной средой
- •9.1.1. Суспензии и золи
- •Классификация суспензий
- •Получение суспензий
- •Значение суспензий
- •9.1.2. Эмульсии
- •Классификация эмульсий
- •Агрегативная устойчивость эмульсии и природа эмульгатора
- •9.1.3. Пены
- •9.2. Системы с газообразной дисперсионной средой
- •9.2.1. Аэрозоли
- •Классификации аэрозолей
- •Агрегативная устойчивость аэрозолей. Коагуляция
- •Методы разрушения аэрозолей
- •9.3. Системы с твердой дисперсионной средой
- •Вопросыи задания для самоконтроля
- •Перечень используемой литературы
- •Коллоидная химия
- •В авторской редакции
- •Отпечатано в Издательстве тпу в полном соответствии с качеством предоставленного оригинал-макета
3.3.12. Проблемы биоразлагаемости промышленных пав
Большинство промышленных ПАВ химически стабильны. Проблема устойчивости ПАВ возникла в связи с загрязнением окружающей среды. Широкое использование ПАВ в промышленности и в быту (например, моющие средства) приводит к попаданию их в больших количествах в сточные воды и далее – в водоемы и почвы. Масштабы последствий загрязнения этими ПАВ весьма велики. Во многих странах законодательно определены нормы ПАВ в воде.
Скорость биоразложения (биодеградации) ПАВ в значительной степени зависит от их молекулярной структуры. Биодеградация происходит быстрее, если ПАВ растворимо в воде. С другой стороны, молекула ПАВ должна содержать связи, которые легко разрушаются при ферментативном катализе. Поэтому для увеличения скорости биоразложения в молекулу ПАВ вводят слабые, легко разрываемые связи (эфирные и амидные).
Еще один фактор, связанный с проблемой биодеградации – разветвленность неполярной части молекулы ПАВ. Сильная разветвленность затрудняет разложение из-за стерических препятствий, создаваемых боковыми группами. Разветвленные алкилбензолсульфонаты ранее использовались как один из основных компонентов бытовых моющих средств, однако из-за стабильности этих ПАВ они были заменены аналогами с линейными алкильными цепями, хорошо разрушающимися в анаэробных условиях.
Для решения экологических проблем синтезирован ряд ПАВ с молекулами, расщепляющимися в природных условиях. Основные типы этих веществ – амфифильные ПАВ, а также ПАВ, разлагаемые под действием ультрафиолетового излучения и озона.
3.4.Адсорбция на границе твердое тело – раствор
Адсорбция растворенных веществ твердыми адсорбентами является более сложным процессом, чем все вышеописанные случаи, т.к. она осложняется присутствием третьего компонента – растворителя, молекулы которого могут конкурировать с молекулами адсорбата за места на поверхности адсорбента. Таким образом, при адсорбции из растворов одновременно могут протекать два параллельных процесса:
1) адсорбция твердыми адсорбентами молекул растворенного вещества;
3) адсорбция твердыми адсорбентами молекул растворителя.
Адсорбироваться в первую очередь будет то вещество, которое в большей степени будет снижать поверхностное натяжение адсорбента.
Различают: молекулярную адсорбцию, ионную адсорбцию и ионный обмен.
3.4.1. Молекулярная адсорбция
Молекулярная адсорбция – адсорбция на поверхности адсорбента молекул неэлектролитов и слабых электролитов.
Адсорбируемость веществ на границе раздела фаз А/С определяется правилом уравнивания полярностей П.А. Ребиндера: вещество В будет адсорбироваться на границе раздела фаз А/С, если оно будет уравнивать полярности этих фаз:
![]() или
или
![]() ,
,
где
![]() – полярность (диэлектрическая
проницаемость) вещества.
– полярность (диэлектрическая
проницаемость) вещества.
Таким образом, адсорбат (растворенное вещество) должен занимать промежуточное значение по полярности между полярностью адсорбента и полярностью растворителя. Это правило дает возможность правильно выбрать адсорбент, адсорбат и растворитель.
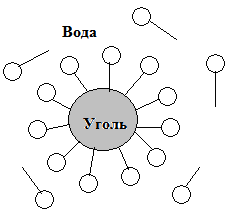
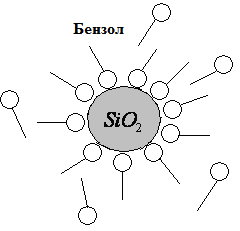
Например:
на границе вода (![]() =
81) – уголь (
=
81) – уголь (![]() ≈
1) адсорбироваться будут вещества, у
которых
≈
1) адсорбироваться будут вещества, у
которых![]() .
.
Для системы адсорбент – адсорбтив влияние природы растворителя на адсорбцию может быть сформулировано в виде правила Шилова: чем лучше растворяется адсорбтив в растворителе, тем он хуже адсорбируется поверхностью твердого адсорбента и наоборот, чем лучше растворяется, тем хуже адсорбируется.
Следовательно, малополярные адсорбенты (активированный уголь) лучше адсорбируют неполярные органические соединения, причем тем больше, чем выше их молярная масса. На поверхности полярных адсорбентов, являющихся оксидами (силикагель, алюмогель и др.), как правило, имеются гидроксильные группы, поэтому они хорошо сорбируют воду. Спирты, амины и другие полярные соединения.
Зависимость адсорбции от строения молекул адсорбата довольно сложна и вывести какие-либо общие количественные закономерности адсорбции практически не возможно. Молекулы ПАВ при адсорбции на поверхности твердого адсорбента ориентируются таким образом, чтобы полярная часть молекулы была обращена к полярной фазе, а неполярная – к неполярной.
|
а |
б |
|
Рис. 3.40. Ориентация дифильных молекул ПАВ на поверхности адсорбента: а– неполярный адсорбент в полярном растворителе; б– полярный адсорбент в неполярном растворителе | |
Как известно, процесс адсорбции идет с выделением тепла, поэтому с повышением температуры молекулярная адсорбция часто уменьшается. С ростом концентрации раствора молекулярная адсорбция возрастает до какого-то предельного значения. Анализ экспериментальных изотерм адсорбции показывает, что молекулярная адсорбция может быть описана уравнениями Лэнгмюра и Фрейндлиха. В системе полярный растворитель – малополярный адсорбент адсорбция ПАВ подчиняется правилу Дюкло – Траубе.
Методы молекулярной адсорбции широко используют для глубокой очистки сточных вод от растворенных органических веществ (фенолов, гербицидов, пестицидов, ароматических нитросоединений, ПАВ, красителей и др.). Достоинством метода является высокая эффективность, возможность очистки сточных вод, содержащих несколько веществ, а также рекуперации этих веществ.
В качестве адсорбентов используют активные угли, синтетические сорбенты. Широкое использование активных углей в качестве сорбентов объясняется их слабым взаимодействием с молекулами воды и сильным взаимодействием с молекулами органических веществ. Скорость процесса адсорбции зависит от концентрации, природы и структуры растворенных веществ, температуры воды, вида и свойств адсорбента.
Например, адсорбционную очистку сточных вод от нитропродуктов, производят углями КАД. Уголь регенерируют растворителями (бензолом, этанолом, метиленхлоридом). Растворитель и нитропродукты разделяют перегонкой. Для извлечения фенолов из сточных вод используют активные угли марок ИГП-90, КАД, БАУ, АГ-3, АП-3. Степень извлечения фенолов этими углями изменяется от 50 до 99 %.