- •«Национальный исследовательский
- •Томский политехнический Университет»
- •Е.В. Михеева, н.П. Пикула, а.П. Асташкина
- •Коллоидная химия
- •Оглавление
- •Глава 1 дисперсные системы
- •1.1. Общая характеристика дисперсных систем
- •1.1.1. Признаки объектов коллоидной химии
- •1.1.2. Специфические особенности высокодисперсных систем
- •1.2. Классификации дисперсных систем
- •1.2.1. Классификация по размерам частиц дисперсной фазы
- •1.2.2. Классификация по агрегатному состоянию дисперсной фазы и дисперсионной среды
- •1.2.3. Классификация по силе межфазного взаимодействия дисперсной фазы и дисперсионной среды
- •1.2.4. Классификация по подвижности частиц дф (по структуре)
- •1.2.5. Классификация по фазовой различимости
- •1.2.6. Классификация по топографическому признаку (по форме частиц)
- •1.3. Методы получения дисперсных систем
- •1.3.1. Диспергационные методы
- •1.3.2. Конденсационные методы
- •1.3.2.1. Физические конденсационные методы
- •1.3.2.2. Химические конденсационные методы
- •2. Реакции обмена
- •3. Реакции окисления
- •1.3.3. Метод пептизации
- •1.4. Методы очистки дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 2 термодинамика поверхностных явлений
- •2.1. Классификация поверхностных явлений
- •2.2. Свободная поверхностная энергия и поверхностное натяжение
- •2.2.1. Физический смысл поверхностного натяжения
- •2.2.2. Термодинамическое определение поверхностного натяжения
- •2.2.3. Единицы измерения поверхностного натяжения
- •2.3. Влияние различных факторов на величину поверхностного натяжения
- •2.3.1. Влияние химической природы вещества
- •2.3.2. Влияние температуры
- •2.3.3. Влияние природы граничащих фаз
- •2.3.4. Влияние природы и концентрации растворенного вещества
- •2.4. Межмолекулярные и межфазные взаимодействия
- •2.4.1. Когезия
- •2.4.2. Адгезия
- •2.4.3. Растекание одной жидкости по поверхности другой
- •2.4.4. Смачивание
- •2.4.4.1. Анализ уравнения Юнга
- •2.4.4.2. Флотация
- •2.5. Особенности искривленной поверхности раздела фаз
- •2.5.1. Уравнение Лапласа
- •2.5.2. Капиллярное давление. Течение жидкости в капиллярах
- •2.6. Методы определения поверхностного натяжения
- •2.6.1. Метод наибольшего давления пузырька газа (метод Ребиндера)
- •2.6.2. Сталагмометрический метод (метод счета капель)
- •2.6.3. Метод капиллярного поднятия жидкости
- •2.7. Влияние кривизны поверхности на давление насыщенного пара
- •2.7.1. Уравнения Томсона (Кельвина)
- •2.7.2. Капиллярная конденсация
- •2.7.3. Изотермическая перегонка
- •Вопросыи задания для самоконтроля
- •Глава 3 адсорбция
- •3.1. Основные понятия и определения
- •3.1.1. Количественные способы выражения величины адсорбции
- •3.1.2. Классификации адсорбции
- •1. Классификация по природе границы раздела
- •2. Классификация по типу взаимодействия адсорбата и адсорбента
- •3.1.3. Основные экспериментальные зависимости адсорбции
- •3.2.Адсорбция на границе твердое тело – газ
- •3.2.1. Теория мономолекулярной адсорбции Лэнгмюра
- •3.2.2. Эмпирическое уравнение адсорбции Фрейндлиха
- •3.2.3. Теория полимолекулярной адсорбции Поляни
- •3.2.4. Дальнейшие представления о многослойной адсорбции. Теория бэт
- •3.2.5. Адсорбция на пористых адсорбентах
- •3.2.6.Адсорбенты и их характеристики
- •3.3.Адсорбция на границе жидкость – газ
- •3.3.1. Фундаментальное уравнение адсорбции Гиббса
- •3.3.2. Свойства поверхностно-активных (пав) и поверхностно-инактивных (пив) веществ
- •3.3.3. Строение адсорбционного слоя на границе раствор–газ
- •3.3.4. Уравнение Шишковского
- •3.3.5. Поверхностная активность. Правило Дюкло – Траубе
- •3.3.6. Расчет гиббсовской адсорбции из изотермы поверхностного натяжения методом графического дифференцирования
- •3.3.7.Применение уравнения изотермы Лэнгмюра к адсорбции на границе жидкость–газ. Расчет молекулярных характеристик исследуемого пав
- •3.3.8. Мицеллообразование в растворах коллоидных пав
- •3.3.9. Классификации пав
- •3.3.10. Солюбилизация
- •3.3.11. Практическое значение пав
- •3.3.12. Проблемы биоразлагаемости промышленных пав
- •3.4.Адсорбция на границе твердое тело – раствор
- •3.4.1. Молекулярная адсорбция
- •3.4.2. Ионная адсорбция
- •3.4.3. Ионообменная адсорбция. Ионный обмен
- •Вопросыи задания для самоконтроля
- •Глава 4 электрические свойства дисперсных систем
- •4.1. Электрокинетические явления
- •4.1.1. Механизм образования двойного электрического слоя
- •1. Неравенство электрохимических потенциалов ионов в кристаллической решетке твердого тела и ионов в растворе
- •Адсорбционный механизм образования дэс
- •Механизм поверхностной диссоциации
- •2. Специфическая адсорбции ионов на поверхности твердой фазы
- •3. Ориентированная адсорбция поверхностно-активных веществ
- •4.2. Теории строения двойного электрического слоя
- •4.2.1. Экспериментальные факты, послужившие основой для создания теорий строения дэс
- •4.2.2. Теория строения дэс Гельмгольца – Перрена
- •4.2.3. Теория строения дэс Гуи – Чэпмена
- •4.2.4. Современная теория строения дэс Штерна
- •4.3. Электрокинетический потенциал
- •4.3.1. Определение электрокинетического потенциала из электрокинетических явлений
- •4.3.2. Практическое значение электрокинетических явлений
- •4.4. Строение коллоидных мицелл
- •4.4.1. Примеры мицелл гидрофобных золей в природе
- •Вопросы и задания для самоконтроля
- •Глава 5 устойчивость и коагуляция лиофобных дисперсных систем
- •5.1. Основные понятия и определения
- •5.1.1. Факторы агрегативной устойчивости лиофобных систем
- •5.2. Коагуляция
- •Стадии коагуляции
- •5.2.1. Кинетика коагуляции. Теория кинетики быстрой коагуляции Смолуховского
- •5.2.2. Коагуляция золей электролитами
- •Эмпирические правила электролитной коагуляции
- •5.3. Теория устойчивости лиофобных дисперсных систем длфо
- •5.3.1. Расклинивающее давление
- •Составляющие расклинивающего давления
- •5.3.2. Энергия электростатического отталкивания
- •5.3.3. Энергия молекулярного притяжения
- •5.3.4. Потенциальные кривые взаимодействия частиц
- •5.4. Закономерности коагуляции гидрофобных золей электролитами
- •5.4.1. Особые явления при коагуляции
- •Коагуляция смесью электролитов
- •5.4.2. Примеры коагуляции. Образование почв
- •5.4.3. Физико-химические методы очистки сточных вод
- •Вопросыи задания для самоконтроля
- •Глава 6 структурно-механические свойства дисперсных систем
- •6.1. Типы структур
- •6.2. Реологические свойства дисперсных систем
- •6.2.1. Вязкость жидких дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 7 оптические свойства дисперсных систем
- •7.1. Рассеяние света в дисперсных системах
- •7.2. Поглощение света в дисперсных системах
- •7.3. Окраска дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 8 молекулярно-кинетические свойства дисперсных систем
- •8.1. Осмос
- •8.2. Диффузия
- •8.3. Броуновское движение
- •8.4. Седиментационное равновесие
- •8.5. Седиментационный анализ
- •Вопросы и задания для самоконтроля
- •Глава 9 краткая характеристика основных дисперсных систем
- •9.1. Системы с жидкой дисперсионной средой
- •9.1.1. Суспензии и золи
- •Классификация суспензий
- •Получение суспензий
- •Значение суспензий
- •9.1.2. Эмульсии
- •Классификация эмульсий
- •Агрегативная устойчивость эмульсии и природа эмульгатора
- •9.1.3. Пены
- •9.2. Системы с газообразной дисперсионной средой
- •9.2.1. Аэрозоли
- •Классификации аэрозолей
- •Агрегативная устойчивость аэрозолей. Коагуляция
- •Методы разрушения аэрозолей
- •9.3. Системы с твердой дисперсионной средой
- •Вопросыи задания для самоконтроля
- •Перечень используемой литературы
- •Коллоидная химия
- •В авторской редакции
- •Отпечатано в Издательстве тпу в полном соответствии с качеством предоставленного оригинал-макета
3.3.3. Строение адсорбционного слоя на границе раствор–газ
Вследствие дифильного строения молекулы ПАВ адсорбируются на границе раздела фаз вода – воздух, ориентируясь при этом определенным образом. Гидрофильная часть молекул, обладающая сродством к полярным молекулам воды, взаимодействует с водой и находится в водной фазе, а неполярная гидрофобная часть выталкивается в неполярную фазу (воздух).
При малых концентрациях ПАВ в поверхностном слое тепловое движение нарушает пространственную ориентацию молекул и молекулы в основном расположены в поверхностном слое горизонтально, при этом полярные группы остаются в воде, а углеводородные цепи лежат на ее поверхности (псевдогазовые пленки).
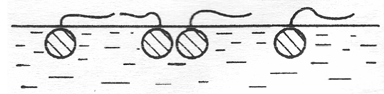
Рис. 3.21. Псевдогазовые пленки
При повышении концентрации ПАВ усиливается взаимодействие углеводородных цепей между собой, их углеводородные радикалы отрываются от поверхности воды, образуя крупные конденсированные кластеры «острова», в которых тепловое движение сильно затруднено (псевдожидкие пленки).
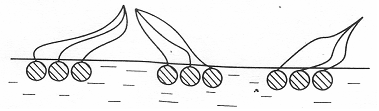
Рис. 3.22. Псевдожидкие пленки
При насыщении адсорбционного слоя (Г∞) образуется «молекулярный частокол Ленгмюра» из вертикально расположенных молекул. В этом состоянии площадь, занимаемая молекулой, определяется лишь площадью полярной группы, постоянной для всех членной гомологического ряда.
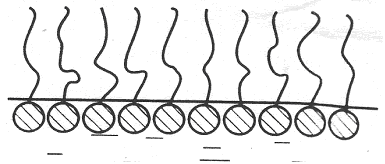
Рис. 3.23. Молекулярный частокол
3.3.4. Уравнение Шишковского
При средних и больших концентрациях ПАВ зависимость уменьшения поверхностного натяжения с увеличением концентрации ПАВ описывается эмпирическим уравнением Шишковского:
![]() , (3.31)
, (3.31)
где
![]() – поверхностное натяжение чистого
растворителя;
– поверхностное натяжение чистого
растворителя;![]() – поверхностное натяжение раствора
ПАВ;В –
константа для всего гомологического
ряда ПАВ; А
– константа для конкретного ПАВ.
– поверхностное натяжение раствора
ПАВ;В –
константа для всего гомологического
ряда ПАВ; А
– константа для конкретного ПАВ.
Уравнение Шишковского в дифференциальной форме имеет вид:
![]() . (3.32)
. (3.32)
Величина гиббсовской адсорбции (Г) связана с константами в уравнении Шишковского:
![]() . (3.33)
. (3.33)
С другой стороны величина адсорбция ПАВ в поверхностном слое связана с его концентрацией уравнением Лэнгмюра:
![]() , (3.34)
, (3.34)
где Г∞ – предельная адсорбция; С – концентрация адсорбата (ПАВ); К – константа адсорбционного равновесия.
Отсюда константы в уравнении Шишковского А и В приобретают определенный физический смысл:
![]() (3.35)
(3.35)
3.3.5. Поверхностная активность. Правило Дюкло – Траубе
Из адсорбционного уравнения Гиббса (3.30) следует, что концентрирование вещества в поверхностном слое или переход его в объемную фазу определяется знаком производной dσ / dС.
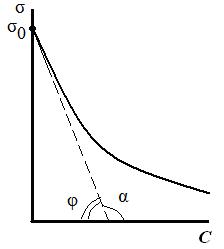
Предельное значение этой производной при С→0, взятой со знаком «минус», называется поверхностной активностью (g):
 . (3.36)
. (3.36)
|
Рис. 3.24. Тангенсы угла наклона касательной |
Поверхностную активность рассчитывают как тангенс угла наклона касательной, проведенной к изотерме поверхностного натяжения исследуемого ПАВ при С→0, взятой с обратным знаком (рис. 3.24):
|
| |
|
Рис. 3.25. Расчет поверхностной активности ПАВ |
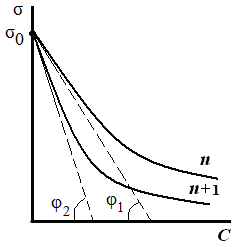
Исследуя поверхностное натяжение водных растворов, Дюкло и Траубе установили зависимость между поверхностной активностью и числом атомов углерода. Правило Дюкло – Траубе: при увеличении углеводородного радикала на группу –СН2–, поверхностная активность увеличивается в 3–3,5 раза (рис. 3.25):
| ||
Причина зависимости Дюкло – Траубе заключается в том, что с увеличением длины углеводородной цепи уменьшается растворимость ПАВ и тем самым увеличивается стремление его молекул перейти из объема в поверхностный слой.
|
|
|
|
Рис. 3.26. Изотермы поверхностного натяжения в растворах ПАВ |
Рис. 3.27. Изотермы адсорбции в растворах ПАВ |
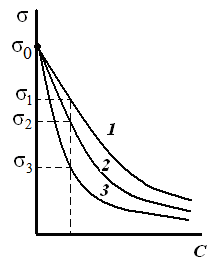
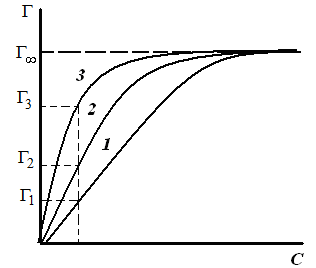
Таким образом, поверхностное натяжение раствора ПАВ уменьшается (σ1 > σ2 > σ3) по мере увеличения длины углеводородного радикала на группу –СН2– (рис. 3.26). При этом величины гиббсовской адсорбции будут возрастать (рис. 3.27) по мере увеличения длины углеводородного радикала в гомологическом ряду (Г1 < Г2 < Г3) и стремиться к одному и тому же предельному значению Г∞ («молекулярный частокол Лэнгмюра»).
Чем длиннее углеводородный радикал молекулы ПАВ, тем больше молекул в поверхностном слое, тем больше величина адсорбции.
Границы применимости правила Дюкло – Траубе
1. Правило выполняется для полярного растворителя. Если растворитель не полярный, то с увеличением углеводородного радикала поверхностная активность ПАВ уменьшается (обращение правила).
2. Правило применимо в области малых концентраций ПАВ в растворе (если «частокол Лэнгмюра», то с увеличением углеводородного радикала количество ПАВ на поверхности жидкости не меняется).
3. Правило выполняется при комнатной температуре, т.к. с увеличением температуры происходит десорбция ПАВ в объем раствора.
Работа адсорбции
Наряду с поверхностной активностью для характеристики ПАВ используют еще один термодинамический параметр – работу адсорбции.
Работа
адсорбции
(![]() )
– работа перемещения 1 моль ПАВ из объема
раствора в поверхностный слой приТ = const:
)
– работа перемещения 1 моль ПАВ из объема
раствора в поверхностный слой приТ = const:
![]()
![]() , (3.38)
, (3.38)
где
![]() – свободная поверхностная энергия;К
– константа адсорбционного равновесия.
– свободная поверхностная энергия;К
– константа адсорбционного равновесия.
Рассчитаем разность работ адсорбции для двух соседних членов гомологического ряда:
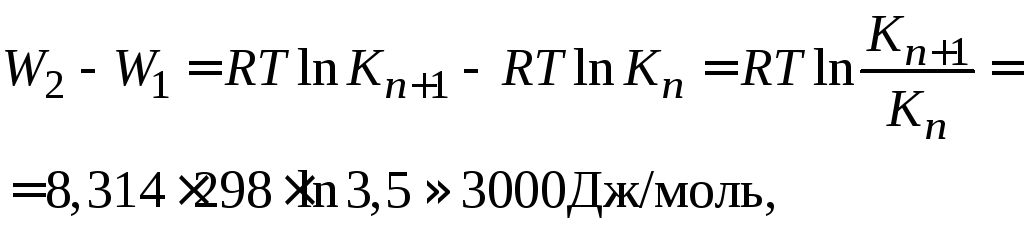
где Кn+1 / Kn =3,0–3,5 (по правилу Дюкло – Траубе).
Таким образом, для перевода каждой –СН2-группы из поверхностного слоя в объемную фазу надо затратить около 3 кДж/моль. Это работа раздвижения дипольных молекул воды (на величину –СН2-группы). Так как размер группы –СН2– один и тот же, то работа адсорбции одна и та же. Следовательно, носителем поверхностной активности ПАВ является углеводородный радикал.

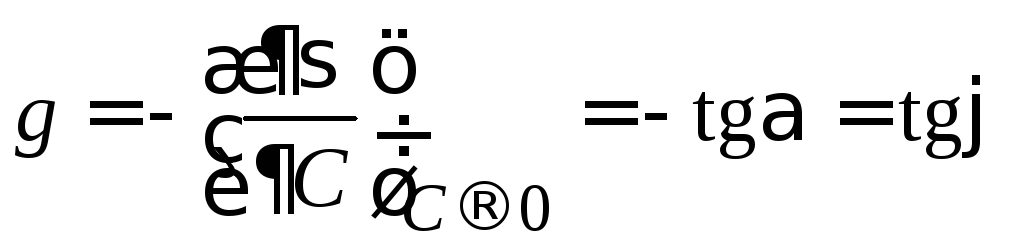 .
.
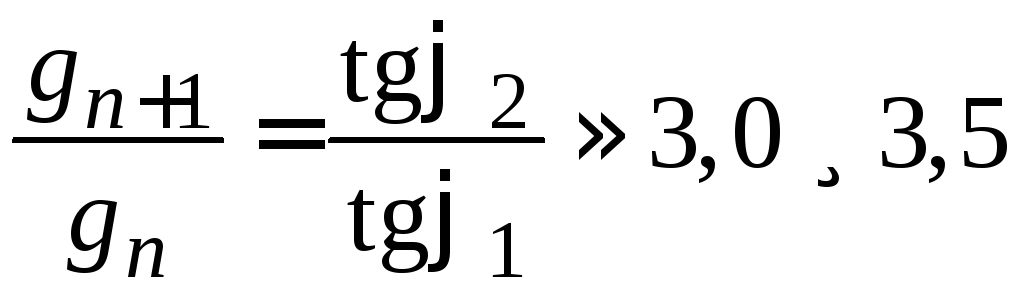 .
(3.37)
.
(3.37)