
- •«Национальный исследовательский
- •Томский политехнический Университет»
- •Е.В. Михеева, н.П. Пикула, а.П. Асташкина
- •Коллоидная химия
- •Оглавление
- •Глава 1 дисперсные системы
- •1.1. Общая характеристика дисперсных систем
- •1.1.1. Признаки объектов коллоидной химии
- •1.1.2. Специфические особенности высокодисперсных систем
- •1.2. Классификации дисперсных систем
- •1.2.1. Классификация по размерам частиц дисперсной фазы
- •1.2.2. Классификация по агрегатному состоянию дисперсной фазы и дисперсионной среды
- •1.2.3. Классификация по силе межфазного взаимодействия дисперсной фазы и дисперсионной среды
- •1.2.4. Классификация по подвижности частиц дф (по структуре)
- •1.2.5. Классификация по фазовой различимости
- •1.2.6. Классификация по топографическому признаку (по форме частиц)
- •1.3. Методы получения дисперсных систем
- •1.3.1. Диспергационные методы
- •1.3.2. Конденсационные методы
- •1.3.2.1. Физические конденсационные методы
- •1.3.2.2. Химические конденсационные методы
- •2. Реакции обмена
- •3. Реакции окисления
- •1.3.3. Метод пептизации
- •1.4. Методы очистки дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 2 термодинамика поверхностных явлений
- •2.1. Классификация поверхностных явлений
- •2.2. Свободная поверхностная энергия и поверхностное натяжение
- •2.2.1. Физический смысл поверхностного натяжения
- •2.2.2. Термодинамическое определение поверхностного натяжения
- •2.2.3. Единицы измерения поверхностного натяжения
- •2.3. Влияние различных факторов на величину поверхностного натяжения
- •2.3.1. Влияние химической природы вещества
- •2.3.2. Влияние температуры
- •2.3.3. Влияние природы граничащих фаз
- •2.3.4. Влияние природы и концентрации растворенного вещества
- •2.4. Межмолекулярные и межфазные взаимодействия
- •2.4.1. Когезия
- •2.4.2. Адгезия
- •2.4.3. Растекание одной жидкости по поверхности другой
- •2.4.4. Смачивание
- •2.4.4.1. Анализ уравнения Юнга
- •2.4.4.2. Флотация
- •2.5. Особенности искривленной поверхности раздела фаз
- •2.5.1. Уравнение Лапласа
- •2.5.2. Капиллярное давление. Течение жидкости в капиллярах
- •2.6. Методы определения поверхностного натяжения
- •2.6.1. Метод наибольшего давления пузырька газа (метод Ребиндера)
- •2.6.2. Сталагмометрический метод (метод счета капель)
- •2.6.3. Метод капиллярного поднятия жидкости
- •2.7. Влияние кривизны поверхности на давление насыщенного пара
- •2.7.1. Уравнения Томсона (Кельвина)
- •2.7.2. Капиллярная конденсация
- •2.7.3. Изотермическая перегонка
- •Вопросыи задания для самоконтроля
- •Глава 3 адсорбция
- •3.1. Основные понятия и определения
- •3.1.1. Количественные способы выражения величины адсорбции
- •3.1.2. Классификации адсорбции
- •1. Классификация по природе границы раздела
- •2. Классификация по типу взаимодействия адсорбата и адсорбента
- •3.1.3. Основные экспериментальные зависимости адсорбции
- •3.2.Адсорбция на границе твердое тело – газ
- •3.2.1. Теория мономолекулярной адсорбции Лэнгмюра
- •3.2.2. Эмпирическое уравнение адсорбции Фрейндлиха
- •3.2.3. Теория полимолекулярной адсорбции Поляни
- •3.2.4. Дальнейшие представления о многослойной адсорбции. Теория бэт
- •3.2.5. Адсорбция на пористых адсорбентах
- •3.2.6.Адсорбенты и их характеристики
- •3.3.Адсорбция на границе жидкость – газ
- •3.3.1. Фундаментальное уравнение адсорбции Гиббса
- •3.3.2. Свойства поверхностно-активных (пав) и поверхностно-инактивных (пив) веществ
- •3.3.3. Строение адсорбционного слоя на границе раствор–газ
- •3.3.4. Уравнение Шишковского
- •3.3.5. Поверхностная активность. Правило Дюкло – Траубе
- •3.3.6. Расчет гиббсовской адсорбции из изотермы поверхностного натяжения методом графического дифференцирования
- •3.3.7.Применение уравнения изотермы Лэнгмюра к адсорбции на границе жидкость–газ. Расчет молекулярных характеристик исследуемого пав
- •3.3.8. Мицеллообразование в растворах коллоидных пав
- •3.3.9. Классификации пав
- •3.3.10. Солюбилизация
- •3.3.11. Практическое значение пав
- •3.3.12. Проблемы биоразлагаемости промышленных пав
- •3.4.Адсорбция на границе твердое тело – раствор
- •3.4.1. Молекулярная адсорбция
- •3.4.2. Ионная адсорбция
- •3.4.3. Ионообменная адсорбция. Ионный обмен
- •Вопросыи задания для самоконтроля
- •Глава 4 электрические свойства дисперсных систем
- •4.1. Электрокинетические явления
- •4.1.1. Механизм образования двойного электрического слоя
- •1. Неравенство электрохимических потенциалов ионов в кристаллической решетке твердого тела и ионов в растворе
- •Адсорбционный механизм образования дэс
- •Механизм поверхностной диссоциации
- •2. Специфическая адсорбции ионов на поверхности твердой фазы
- •3. Ориентированная адсорбция поверхностно-активных веществ
- •4.2. Теории строения двойного электрического слоя
- •4.2.1. Экспериментальные факты, послужившие основой для создания теорий строения дэс
- •4.2.2. Теория строения дэс Гельмгольца – Перрена
- •4.2.3. Теория строения дэс Гуи – Чэпмена
- •4.2.4. Современная теория строения дэс Штерна
- •4.3. Электрокинетический потенциал
- •4.3.1. Определение электрокинетического потенциала из электрокинетических явлений
- •4.3.2. Практическое значение электрокинетических явлений
- •4.4. Строение коллоидных мицелл
- •4.4.1. Примеры мицелл гидрофобных золей в природе
- •Вопросы и задания для самоконтроля
- •Глава 5 устойчивость и коагуляция лиофобных дисперсных систем
- •5.1. Основные понятия и определения
- •5.1.1. Факторы агрегативной устойчивости лиофобных систем
- •5.2. Коагуляция
- •Стадии коагуляции
- •5.2.1. Кинетика коагуляции. Теория кинетики быстрой коагуляции Смолуховского
- •5.2.2. Коагуляция золей электролитами
- •Эмпирические правила электролитной коагуляции
- •5.3. Теория устойчивости лиофобных дисперсных систем длфо
- •5.3.1. Расклинивающее давление
- •Составляющие расклинивающего давления
- •5.3.2. Энергия электростатического отталкивания
- •5.3.3. Энергия молекулярного притяжения
- •5.3.4. Потенциальные кривые взаимодействия частиц
- •5.4. Закономерности коагуляции гидрофобных золей электролитами
- •5.4.1. Особые явления при коагуляции
- •Коагуляция смесью электролитов
- •5.4.2. Примеры коагуляции. Образование почв
- •5.4.3. Физико-химические методы очистки сточных вод
- •Вопросыи задания для самоконтроля
- •Глава 6 структурно-механические свойства дисперсных систем
- •6.1. Типы структур
- •6.2. Реологические свойства дисперсных систем
- •6.2.1. Вязкость жидких дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 7 оптические свойства дисперсных систем
- •7.1. Рассеяние света в дисперсных системах
- •7.2. Поглощение света в дисперсных системах
- •7.3. Окраска дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 8 молекулярно-кинетические свойства дисперсных систем
- •8.1. Осмос
- •8.2. Диффузия
- •8.3. Броуновское движение
- •8.4. Седиментационное равновесие
- •8.5. Седиментационный анализ
- •Вопросы и задания для самоконтроля
- •Глава 9 краткая характеристика основных дисперсных систем
- •9.1. Системы с жидкой дисперсионной средой
- •9.1.1. Суспензии и золи
- •Классификация суспензий
- •Получение суспензий
- •Значение суспензий
- •9.1.2. Эмульсии
- •Классификация эмульсий
- •Агрегативная устойчивость эмульсии и природа эмульгатора
- •9.1.3. Пены
- •9.2. Системы с газообразной дисперсионной средой
- •9.2.1. Аэрозоли
- •Классификации аэрозолей
- •Агрегативная устойчивость аэрозолей. Коагуляция
- •Методы разрушения аэрозолей
- •9.3. Системы с твердой дисперсионной средой
- •Вопросыи задания для самоконтроля
- •Перечень используемой литературы
- •Коллоидная химия
- •В авторской редакции
- •Отпечатано в Издательстве тпу в полном соответствии с качеством предоставленного оригинал-макета
4.3.2. Практическое значение электрокинетических явлений
Электрофорез применяют для: очистки, разделения и обезвоживания медицинских препаратов, пищевых продуктов, химических реактивов; нанесения тонких слоев неметаллических покрытий в радиоэлектронике; получения изоляционных пленок, изготовления прорезиненных тканей и т.д.
Электроосмос применяют для: обезвоживания грунта при возведении гидротехнических сооружений (платин, дамб); при сушке торфа и дерева; сушке стен и фундаментов сырых зданий; добыче нефти и т.д.
Потенциал оседания является причиной грозовых разрядов в атмосфере.
Потенциал течения – основа многих биологический процессов. Например, течение крови через капилляры кровеносной системы дает биопотенциал. Потенциал течения возникают при транспортировке жидкого топлива (при протекании нефти вместе с водой образуется огромный заряд, приводящий к взрывам).
4.4. Строение коллоидных мицелл
Коллоидные системы состоят из дисперсной фазы и дисперсионной среды. Частицу дисперсной фазы вместе с двойным электрическим слоем называют мицеллой.
Мицелла – сложное структурное образование, состоящее из агрегата, потенциалопределяющих ионов и противоионов.
Внутреннюю часть мицеллы составляет агрегат основного вещества. Как правило, агрегат состоит из большого числа молекул или атомов кристаллического или аморфного строения. Агрегат электронейтрален, но обладает большой адсорбционной способностью и способен адсорбировать на своей поверхности ионы из раствора – потенциалопределяющие ионы (ПОИ).
При выборе потенциалопределяющих ионов пользуются эмпирическим правилом Фаянса – Панета – Пескова: «На твердой поверхности агрегата в первую очередь адсорбируются ионы, которые:
входят в состав агрегата;
способны достраивать кристаллическую решетку агрегата;
образуют малорастворимое соединение с ионами агрегата;
изоморфны с ионами агрегата».
Агрегат вместе с потенциалопределяющими ионами составляет ядро мицеллы. Ядро мицеллы, обладающее большим зарядом, притягивает ионы противоположного заряда – противоионы (ПИ) из раствора.
Часть противоионов находится в непосредственной близости от ядра, прочно связана с ним за счет адсорбционных и электростатических сил, и образует плотную часть двойного электрического слоя (адсорбционный слой).
Ядро с противоионами плотной части двойного электрического слоя образуют гранулу или коллоидную частицу. Знак заряда коллоидной частицы определяется знаком заряда потенциалопределяющих ионов.
Коллоидную частицу (гранулу) окружают противоионы диффузного слоя – остальная часть противоионов, подвергающихся броуновскому движению и менее прочно связанная с ядром. В целом образуется мицелла. Мицелла в отличие от коллоидной частицы электронейтральна.
Пример 4.2. Рассмотрим строение мицеллы при образовании коллоидного раствора – золя иодида серебра методом химической конденсации при небольшом избытке нитрата серебра
![]() .
.
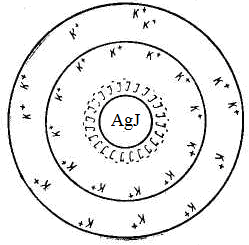
Рис. 4.11. Схематическое строение мицеллы золя иодида серебра
Формула мицеллы запишется:
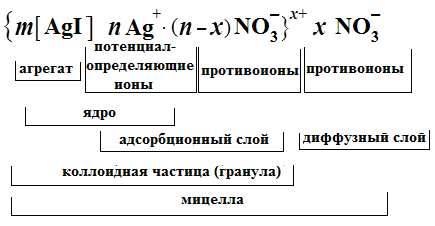
где
m
– количество
молекул или атомов, образующих агрегат;
n
– число потенциалопределяющих ионов,
адсорбированных на поверхности агрегата;
(n
– x)
– число противоионов в плотной части
двойного электрического слоя (адсорбционный
слой); x
– число
противоионов в диффузной части двойного
электрического слоя;
![]() – заряд коллоидной частицы (гранулы).
– заряд коллоидной частицы (гранулы).
При образовании золя иодида серебра при небольшом избытке иодида калия
![]()
образуется мицелла следующего состава:
![]() .
.
Заряд коллоидной частицы в этом случае будет отрицательным.
Формулы мицелл золей носят только качественный характер, они позволяют судить о структуре поверхностных слоев, но не пригодны для количественной характеристики состава мицелл. Существование мицелл в дисперсных системах приводит к тому, что состав дисперсионной среды вдали и вблизи частиц различается. Если, например, диффузный слой содержит ионы H+, то при фильтровании суспензий эти ионы уходят вместе с частицами. В результате возникает повышенная концентрация ионов H+ в осадке по сравнению с фильтратом. Это явление получило название суспензионного эффекта.
Образование ДЭС в присутствии электролита-стабилизатора обеспечивает электростатический фактор устойчивости дисперсной системе, который усиливается с ростом потенциала поверхности и толщины ДЭС. Он очень чувствителен к действию электролитов и характерен для систем с полярными, особенно водными средами, создающими условия для диссоциации. Наряду с электростатическим, в дисперсных схемах возможно проявление и других факторов стабилизации.
