
- •«Национальный исследовательский
- •Томский политехнический Университет»
- •Е.В. Михеева, н.П. Пикула, а.П. Асташкина
- •Коллоидная химия
- •Оглавление
- •Глава 1 дисперсные системы
- •1.1. Общая характеристика дисперсных систем
- •1.1.1. Признаки объектов коллоидной химии
- •1.1.2. Специфические особенности высокодисперсных систем
- •1.2. Классификации дисперсных систем
- •1.2.1. Классификация по размерам частиц дисперсной фазы
- •1.2.2. Классификация по агрегатному состоянию дисперсной фазы и дисперсионной среды
- •1.2.3. Классификация по силе межфазного взаимодействия дисперсной фазы и дисперсионной среды
- •1.2.4. Классификация по подвижности частиц дф (по структуре)
- •1.2.5. Классификация по фазовой различимости
- •1.2.6. Классификация по топографическому признаку (по форме частиц)
- •1.3. Методы получения дисперсных систем
- •1.3.1. Диспергационные методы
- •1.3.2. Конденсационные методы
- •1.3.2.1. Физические конденсационные методы
- •1.3.2.2. Химические конденсационные методы
- •2. Реакции обмена
- •3. Реакции окисления
- •1.3.3. Метод пептизации
- •1.4. Методы очистки дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 2 термодинамика поверхностных явлений
- •2.1. Классификация поверхностных явлений
- •2.2. Свободная поверхностная энергия и поверхностное натяжение
- •2.2.1. Физический смысл поверхностного натяжения
- •2.2.2. Термодинамическое определение поверхностного натяжения
- •2.2.3. Единицы измерения поверхностного натяжения
- •2.3. Влияние различных факторов на величину поверхностного натяжения
- •2.3.1. Влияние химической природы вещества
- •2.3.2. Влияние температуры
- •2.3.3. Влияние природы граничащих фаз
- •2.3.4. Влияние природы и концентрации растворенного вещества
- •2.4. Межмолекулярные и межфазные взаимодействия
- •2.4.1. Когезия
- •2.4.2. Адгезия
- •2.4.3. Растекание одной жидкости по поверхности другой
- •2.4.4. Смачивание
- •2.4.4.1. Анализ уравнения Юнга
- •2.4.4.2. Флотация
- •2.5. Особенности искривленной поверхности раздела фаз
- •2.5.1. Уравнение Лапласа
- •2.5.2. Капиллярное давление. Течение жидкости в капиллярах
- •2.6. Методы определения поверхностного натяжения
- •2.6.1. Метод наибольшего давления пузырька газа (метод Ребиндера)
- •2.6.2. Сталагмометрический метод (метод счета капель)
- •2.6.3. Метод капиллярного поднятия жидкости
- •2.7. Влияние кривизны поверхности на давление насыщенного пара
- •2.7.1. Уравнения Томсона (Кельвина)
- •2.7.2. Капиллярная конденсация
- •2.7.3. Изотермическая перегонка
- •Вопросыи задания для самоконтроля
- •Глава 3 адсорбция
- •3.1. Основные понятия и определения
- •3.1.1. Количественные способы выражения величины адсорбции
- •3.1.2. Классификации адсорбции
- •1. Классификация по природе границы раздела
- •2. Классификация по типу взаимодействия адсорбата и адсорбента
- •3.1.3. Основные экспериментальные зависимости адсорбции
- •3.2.Адсорбция на границе твердое тело – газ
- •3.2.1. Теория мономолекулярной адсорбции Лэнгмюра
- •3.2.2. Эмпирическое уравнение адсорбции Фрейндлиха
- •3.2.3. Теория полимолекулярной адсорбции Поляни
- •3.2.4. Дальнейшие представления о многослойной адсорбции. Теория бэт
- •3.2.5. Адсорбция на пористых адсорбентах
- •3.2.6.Адсорбенты и их характеристики
- •3.3.Адсорбция на границе жидкость – газ
- •3.3.1. Фундаментальное уравнение адсорбции Гиббса
- •3.3.2. Свойства поверхностно-активных (пав) и поверхностно-инактивных (пив) веществ
- •3.3.3. Строение адсорбционного слоя на границе раствор–газ
- •3.3.4. Уравнение Шишковского
- •3.3.5. Поверхностная активность. Правило Дюкло – Траубе
- •3.3.6. Расчет гиббсовской адсорбции из изотермы поверхностного натяжения методом графического дифференцирования
- •3.3.7.Применение уравнения изотермы Лэнгмюра к адсорбции на границе жидкость–газ. Расчет молекулярных характеристик исследуемого пав
- •3.3.8. Мицеллообразование в растворах коллоидных пав
- •3.3.9. Классификации пав
- •3.3.10. Солюбилизация
- •3.3.11. Практическое значение пав
- •3.3.12. Проблемы биоразлагаемости промышленных пав
- •3.4.Адсорбция на границе твердое тело – раствор
- •3.4.1. Молекулярная адсорбция
- •3.4.2. Ионная адсорбция
- •3.4.3. Ионообменная адсорбция. Ионный обмен
- •Вопросыи задания для самоконтроля
- •Глава 4 электрические свойства дисперсных систем
- •4.1. Электрокинетические явления
- •4.1.1. Механизм образования двойного электрического слоя
- •1. Неравенство электрохимических потенциалов ионов в кристаллической решетке твердого тела и ионов в растворе
- •Адсорбционный механизм образования дэс
- •Механизм поверхностной диссоциации
- •2. Специфическая адсорбции ионов на поверхности твердой фазы
- •3. Ориентированная адсорбция поверхностно-активных веществ
- •4.2. Теории строения двойного электрического слоя
- •4.2.1. Экспериментальные факты, послужившие основой для создания теорий строения дэс
- •4.2.2. Теория строения дэс Гельмгольца – Перрена
- •4.2.3. Теория строения дэс Гуи – Чэпмена
- •4.2.4. Современная теория строения дэс Штерна
- •4.3. Электрокинетический потенциал
- •4.3.1. Определение электрокинетического потенциала из электрокинетических явлений
- •4.3.2. Практическое значение электрокинетических явлений
- •4.4. Строение коллоидных мицелл
- •4.4.1. Примеры мицелл гидрофобных золей в природе
- •Вопросы и задания для самоконтроля
- •Глава 5 устойчивость и коагуляция лиофобных дисперсных систем
- •5.1. Основные понятия и определения
- •5.1.1. Факторы агрегативной устойчивости лиофобных систем
- •5.2. Коагуляция
- •Стадии коагуляции
- •5.2.1. Кинетика коагуляции. Теория кинетики быстрой коагуляции Смолуховского
- •5.2.2. Коагуляция золей электролитами
- •Эмпирические правила электролитной коагуляции
- •5.3. Теория устойчивости лиофобных дисперсных систем длфо
- •5.3.1. Расклинивающее давление
- •Составляющие расклинивающего давления
- •5.3.2. Энергия электростатического отталкивания
- •5.3.3. Энергия молекулярного притяжения
- •5.3.4. Потенциальные кривые взаимодействия частиц
- •5.4. Закономерности коагуляции гидрофобных золей электролитами
- •5.4.1. Особые явления при коагуляции
- •Коагуляция смесью электролитов
- •5.4.2. Примеры коагуляции. Образование почв
- •5.4.3. Физико-химические методы очистки сточных вод
- •Вопросыи задания для самоконтроля
- •Глава 6 структурно-механические свойства дисперсных систем
- •6.1. Типы структур
- •6.2. Реологические свойства дисперсных систем
- •6.2.1. Вязкость жидких дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 7 оптические свойства дисперсных систем
- •7.1. Рассеяние света в дисперсных системах
- •7.2. Поглощение света в дисперсных системах
- •7.3. Окраска дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 8 молекулярно-кинетические свойства дисперсных систем
- •8.1. Осмос
- •8.2. Диффузия
- •8.3. Броуновское движение
- •8.4. Седиментационное равновесие
- •8.5. Седиментационный анализ
- •Вопросы и задания для самоконтроля
- •Глава 9 краткая характеристика основных дисперсных систем
- •9.1. Системы с жидкой дисперсионной средой
- •9.1.1. Суспензии и золи
- •Классификация суспензий
- •Получение суспензий
- •Значение суспензий
- •9.1.2. Эмульсии
- •Классификация эмульсий
- •Агрегативная устойчивость эмульсии и природа эмульгатора
- •9.1.3. Пены
- •9.2. Системы с газообразной дисперсионной средой
- •9.2.1. Аэрозоли
- •Классификации аэрозолей
- •Агрегативная устойчивость аэрозолей. Коагуляция
- •Методы разрушения аэрозолей
- •9.3. Системы с твердой дисперсионной средой
- •Вопросыи задания для самоконтроля
- •Перечень используемой литературы
- •Коллоидная химия
- •В авторской редакции
- •Отпечатано в Издательстве тпу в полном соответствии с качеством предоставленного оригинал-макета
3.4.2. Ионная адсорбция
Ионная адсорбция – адсорбция сильных электролитов из водных растворов, обусловленная химическими и электростатическими силами.
Ионы избирательно адсорбируются на поверхностях, состоящих из ионов или полярных молекул. Ионная адсорбция более сложное явление, чем молекулярная, в большинстве случаев скорость ионной адсорбции с повышением температуры возрастает, поэтому ее называют активированной, это свидетельствует о том, что происходит образование поверхностных химических соединений.
Избирательная адсорбция ионов – процесс фиксации на твердой поверхности ионов одного знака заряда при сохранении подвижности ионов противоположного знака. Поглощаться поверхностью будет тот ион, химический потенциал которого в растворе выше, чем в твердой фазе, поэтому почти всегда один из ионов адсорбируется селективно (избирательно).
Правило избирательной адсорбции Пескова – Фаянса:
«На твердой поверхности адсорбента в первую очередь адсорбируются ионы, которые:
входят в состав кристаллической решетки адсорбента;
способны достраивать кристаллическую решетку адсорбента;
изоморфны с ионами адсорбента.»
Влияние природы ионов на их адсорбционную способность
1. С увеличением заряда иона его адсорбционная способность увеличивается.
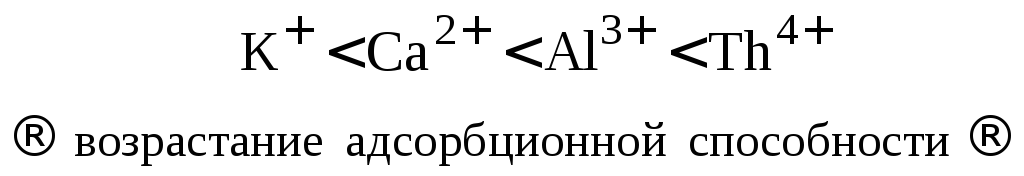
2. С увеличением радиуса иона его адсорбционная способность увеличивается.
Ионы одинаковой валентности адсорбируются тем лучше, чем больше их ионный радиус, т.к. с увеличением радиуса уменьшается степень гидратации ионов, наличие гидратной оболочки ослабляет электростатическое взаимодействие ионов, препятствуя адсорбции.
Ионы, расположенные в порядке возрастания адсорбционной способности образуют лиотропные ряды (ряды Гофмейстера).
а) лиотропный ряд гидратированных катионов щелочных металлов:
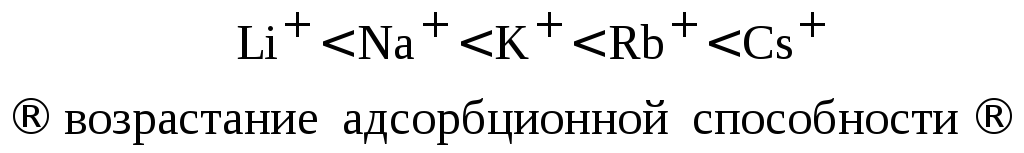
б) лиотропный ряд двухвалентных катионов:

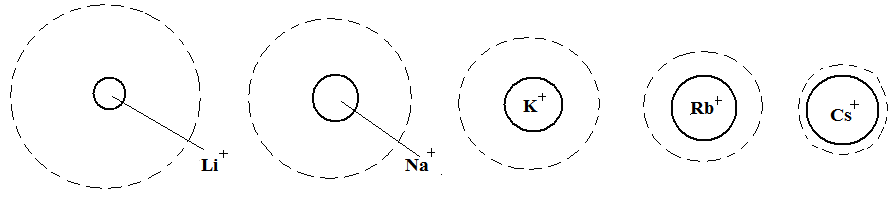
Рис. 3.41. Соотношение между истинными радиусами одновалентных катионов и их радиусами в гидратированном состоянии
3. С увеличением поляризуемости иона его адсорбционная способность увеличивается. Так как поляризуемость анионов всегда больше поляризуемости катионов, то на твердой поверхности преимущественно будут адсорбироваться анионы. Поэтому в природе чаще встречаются отрицательно заряженные поверхности. Лиотропный ряд некоторых анионов:
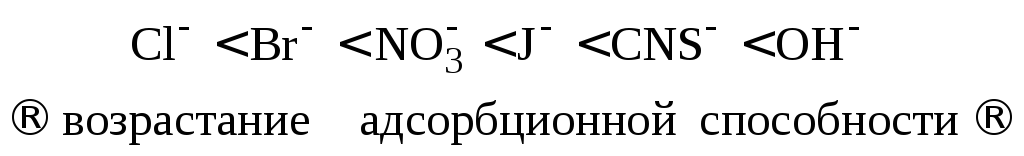
Это имеет большое значение для стабилизации и коагуляции коллоидных систем электролитами. В природе часто наблюдается избирательная адсорбция калия, бария, никеля, радиоактивных элементов и др.
3.4.3. Ионообменная адсорбция. Ионный обмен
Ионообменная адсорбция является наиболее распространенным видом ионной адсорбции.
Ионообменная адсорбция – процесс обмена ионов между раствором и ионообменником (сорбентом). При этом сорбент поглощает из раствора ионы одного знака (катионы или анионы) и вместо них выделяет в раствор эквивалентное число ионов того же знака.
Ионообменники (иониты) – высокомолекулярные полиэлектролиты, состоящие из синтетического нерастворимого каркаса с привитыми функциональными группами кислотного (–SO3Н, –COOН и др.) и основного ( =NH, –NH2 и др.) характера. Иониты классифицируют:
по происхождению – на природные и синтетические;
по составу – на неорганические и органические;
по знаку зарядов обменивающихся ионов – на катиониты (обменивающиеся с раствором катионами), аниониты (обменивающимися с раствором анионами), и амфолиты (вещества, которые в зависимости от условий могут обмениваться как катионами, так и анионами).
Широкое распространение получили синтетические органические иониты – ионообменные смолы. Эти вещества состоят из жесткой высокомолекулярной матрицы (каркас, сетка, скелет), включающей фиксированные ионы одного знака и пропитанные раствором, который содержит в основном подвижные противоионы. Ионообменные смолы подразделяют на категории:
сильнокислотые катиониты с активной сульфогруппой (–SO3Н) марки КУ-2, СДВ-3, СБС;
слабокислотные катиониты с активными группами (–OН, –COOН, –SiOН) марки КБ-4, КБ-4П-2;
слабоосновные аниониты с активными группами (=NH, –NH2, ≡N) марки АН-2Ф, А-1;
полифункциональные, включая амфолитные.
Обмен ионов на твердой поверхности количественно характеризуется уравнением изотермы ионного обмена Б.П. Никольского:
 , (3.43)
, (3.43)
где q1, q2 – содержание обменивающихся ионов в сорбенте, моль/г; С1, С2 – концентрации обменивающихся ионов в растворе; z1, z2 – заряд ионов; k – константа ионного обмена.
При z1 = z2 = 1 уравнение упрощается:
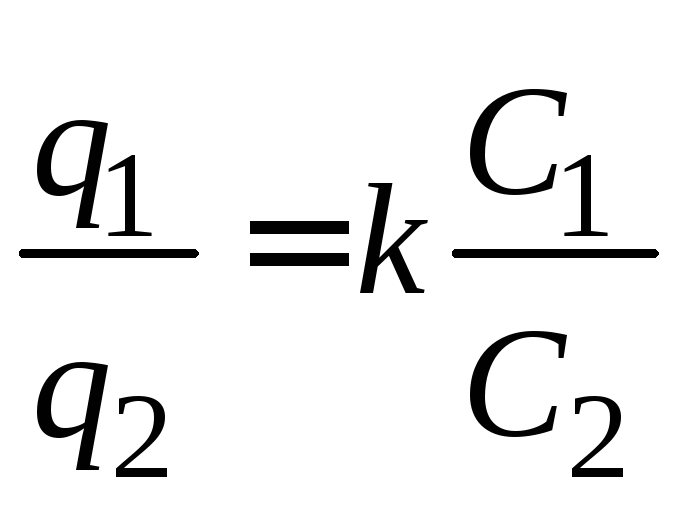 . (3.44)
. (3.44)
Для данного ионита константа ионного обмена k характеризует относительное сродство обменивающихся ионов к иониту, т.е. селективность ионита к тому или другому иону. Ион, обладающий большим сродством к иониту, лучше сорбируется при прочих равных условиях.
Особенности ионообменной адсорбции:
Адсорбция специфична, каждый адсорбент (ионит, ионообменник) обменивается определенными типами ионов.
Ионообменная адсорбция не всегда обратима.
Протекает более медленно, чем молекулярная адсорбция.
При обменной адсорбции может измениться рН среды.
Применение ионного обмена
В настоящее время ионный обмен находит широкое применение в самых различных отраслях народного хозяйства, в экологии для очистки воды и извлечения ценных примесей. Рассмотрим отдельные примеры применения ионного обмена.
1. Обессоливание (деминерализация) воды – удаление СаCl2, МgCl2 и т.д. Процесс обессоливание состоит в пропускании засоленной воды через колонки, заполненные катионитом в Н+-форме и анионитом в ОН--форме. На катионите происходит поглощение из воды ионов Са2+ и Мg2+-ионов и замена их на ионы Н+ по схеме:
![]() .
.
При поступлении воды, содержащей НСl во вторую колонку на анионите происходит замена ОН–-группы ионита эквивалентным числом анионов Сl- кислоты по схеме:
![]() .
.
На выходе из колонки с анионитом получают полностью деминерализованную воду, не уступающую по степени очистки дистиллированной воде.
2. Опреснение воды на морских судах и космических кораблях:
![]() ;
;
![]() .
.
3.
Ионный обмен в почвах. Почва способна
поглощать катионы
![]() и
и![]() ,
содержащиеся в удобрениях и необходимые
для питания растений. Взамен этих
катионов почва выделяет эквивалентное
количество других катионов, например
,
содержащиеся в удобрениях и необходимые
для питания растений. Взамен этих
катионов почва выделяет эквивалентное
количество других катионов, например![]() и
и![]() .
Анионы, как, например
.
Анионы, как, например![]() ,
,![]() ,
,![]() ,
почти не поглощаются почвой. От природы
поглощенных ионов в значительной мере
зависят физические и агротехнические
свойства почвы.
,
почти не поглощаются почвой. От природы
поглощенных ионов в значительной мере
зависят физические и агротехнические
свойства почвы.
4. Извлечение ценных примесей, например, урана золота, серебра решается во многих случаях сравнительно легко, благодаря их высокой адсорбционной способности. В настоящее время нет производства по переработки урановых руд, в котором не применялся бы ионный обмен.
5. Очистка заводских сточных вод – удаление ионов тяжелых металлов (Zn2+, Cd2+, Pb2+, Cu2+).
Большое значение ионный обмен имеет при охране окружающей среды. Так, например, в сточных водах многих производств содержатся ионы тяжелых металлов, которые очень вредны для живых организмов. Так как концентрация тяжелых металлов в сточных водах очень мала, то применение обычных методов очистки (например, осаждение) неэффективно и дорого. Сточные воды пропускают через катионит, содержащий не ион водорода, а, например, ион натрия. Ионы тяжелых металлов, обмениваясь на ион натрия, поглощаются катионитом, из которого их легко можно извлечь и использовать в дальнейшем производстве:
![]() .
.
Ионообменная очистка применяется для извлечения из сточных вод металлов (цинка, меди, хрома, никеля, свинца, ртути, кадмия, ванадия, марганца и др.), а также соединений мышьяка, фосфора, цианистых соединений и радиоактивных веществ. Метод позволяет рекуперировать ценные вещества при высокой степени очистки воды.
Процессы ионообменной очистки сточных вод проводят на установках периодического и непрерывного действия.
Примеры ионообменной очистки: ионы цинка извлекают на катионитах КУ-2 и КБ-4, ионы меди катионитом КУ-1, ионы никеля катионитом КЧ-2, хромат и бихромат-ионы анионитами АВ-17, АН-18П, АН-25.
