
- •№ 1 Классы неорганических веществ. Оксиды, основания, кислоты, соли: определения, классификация, названия, свойства, получение.
- •Классификации:
- •№ 2 Основные понятия и законы химии. Атом, молекула, простые и сложные вещества, моль. Относительная молекулярная масса. Молярная масса, эквивалентная масса.
- •Формулой атома
- •Способы выражения концентрации растворов:
- •* РН растворов солей. Возможны три случая гидролиза солей.
- •2. Уравняем данную реакцию методом электронного баланса. Процесс восстановления описывается:
- •Защитные покрытия представляют собой пленки (металлические, оксидные, лакокрасочные и т.П.).
№ 1 Классы неорганических веществ. Оксиды, основания, кислоты, соли: определения, классификация, названия, свойства, получение.
КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
Простые вещества. Молекулы состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут разлагаться с образованием других веществ.
|
Простые Металлы Неметаллы
|
Сложные Оксиды Основания Кислоты Соли
|
Неорганические вещества:
Оксиды - сложные вещества, состоящие из двух химических элементов, один из которых кислород.
1.Солеобразующие оксиды: оксиды неметаллов и металлов, при взаимодействии с водой образующие соответствующие кислоты, при взаимодействии с основаниями — соответствующие нормальные и кислые соли.
А) Основные оксиды — оксиды 1, 2 и некоторых 3 валентных металлов CuO, Na2O
1. Основный оксид + cильная кислота → соль + вода
2. Сильноосновный оксид + вода → гидроксид
3. Сильноосновный оксид + кислотный оксид → соль
4. Основный оксид + водород → металл + вода
Б) Кислотные оксиды - оксиды, проявляющие кислотные свойства и образующие соответствующие кислородсодержащие кислоты. Образованы типичными неметаллами и некоторыми переходными элементами. SO3, NO2.
1. Кислотный оксид + вода → кислота
2. Кислотный оксид + основный оксид → соль
3. Кислотный оксид + основание → соль + вода
В) Амфотерные оксиды — солеобразующие оксиды, проявляющие в зависимости от условий либо основные, либо кислотные свойства (то есть проявляющие амфотерность). Образуются переходными металлами. ZnO, Al2О3
1. Амфотерный оксид + сильная кислота → основания
2. Амфотерный оксид + основание → кислота
2. Несолеобразующие оксиды: СО, N2О, NO.
Основания (щелочи) — это сложные вещества, состоящие из ионов металлов и связанных с ними одного или нескольких гидроксид ионов.
Классификации:
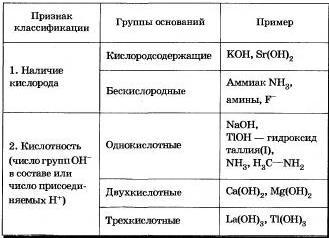

Кислота – это сложное вещество, в молекуле которого имеется один или несколько атомов водорода и кислотный остаток.
-
По содержанию атомов кислорода:
бескислородные (HCl, H2S);
кислородсодержащие (HNO3, H2SO4).
-
По количеству кислых атомов водорода:
одноосновные (HNO3);
двухосновные (H2SeO4);
трёхосновные (H3PO4, H3BO3);
многоосновные.
-
По силе
Сильные — диссоциируют практически полностью, константы диссоциации больше 1·10−3 (HNO3);
Слабые — константа диссоциации меньше 1·10−3 (уксусная кислота Kд= 1,7·10−5).
-
По устойчивости
Устойчивые (H2SO4);
Неустойчивые (H2CO3).
-
По принадлежности к классам химических соединений
Неорганические (HBr);
Органические (HCOOH,CH3COOH);
-
По летучести
Летучие (HNO3,H2S, HCl);
Нелетучие (H2SO4) ;
-
По растворимости в воде
Растворимые (H2SO4);
Нерастворимые (H2SiO3)
№ 2 Основные понятия и законы химии. Атом, молекула, простые и сложные вещества, моль. Относительная молекулярная масса. Молярная масса, эквивалентная масса.
Атом — частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств.
Атом состоит из атомного ядра и электронов. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом.
Молекула— электрически нейтральная частица, образованная из двух или более связанных ковалентными связями атомов.
Простые вещества — вещества, состоящие исключительно из атомов одного химического элемента.
Сложные вещества – вещества, состоящее из химически связанных атомов двух или более элементов
Моль - единица измерения количества вещества. Моль принят в качестве основной единицы СИ
Молекулярная масса - масса молекулы, выраженная в атомных единицах массы. Численно равна молярной массе.
Молярная масса — масса одного моля вещества. Для отдельных химических элементов молярной массой является масса одного моля отдельных атомов этого элемента. В этом случае молярная масса элемента, выраженная в г/моль, численно совпадает с массой атома элемента, выраженной в а.е.м.
Эквивалентная масса — это масса одного эквивалента данного вещества.
№ 3. Строение атома. Энергетическое состояние электрона в атоме. Орбиталь. Квантовые числа: главное, орбитальное, магнитное, спиновое. Заполнение электронами энергетических уровней, подуровней. Принцип Паули, правило Хунда. Электронная формула атома.
Строение атома : Атом состоит из ядра и электронов.
При химических реакциях ядра атомов остаются без изменений, изменяется лишь строение электронных оболочек вследствие перераспределения электронов между атомами. Способностью атомов отдавать или присоединять электроны определяются его химические свойства.
Энергетическое состояние электрона в атоме: Электроны в атоме расположены на энергетических уровнях, которые со-
держат различные энергетические подуровни, состоящие, в свою очередь, из
определенного количества атомных орбиталей: s- подуровень состоит из одной,
р- подуровень ─ из трех, d- подуровень ─ из пяти и f- подуровень ─ из семи
орбиталей.
Условная запись, представляющая распределение электронов атома по энерге-
тическим уровням и подуровням (атомным орбиталям), называется электронной
