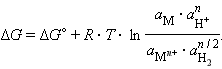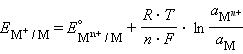- •№ 1 Классы неорганических веществ. Оксиды, основания, кислоты, соли: определения, классификация, названия, свойства, получение.
- •Классификации:
- •№ 2 Основные понятия и законы химии. Атом, молекула, простые и сложные вещества, моль. Относительная молекулярная масса. Молярная масса, эквивалентная масса.
- •Формулой атома
- •Способы выражения концентрации растворов:
- •* РН растворов солей. Возможны три случая гидролиза солей.
- •2. Уравняем данную реакцию методом электронного баланса. Процесс восстановления описывается:
- •Защитные покрытия представляют собой пленки (металлические, оксидные, лакокрасочные и т.П.).
2. Уравняем данную реакцию методом электронного баланса. Процесс восстановления описывается:
![]()
Сложнее составить схему окисления, поскольку окисляются сразу два элемента — Fe и S. Можно приписать железу степень окисления 2+, сере 1- и учесть, что на один атом Fe приходится два атома S:
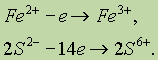
Можно, однако, обойтись без определения степеней окисления и записать схему, напоминающую схему
![]()
Правая часть имеет заряд +15, левая — 0, поэтому FeS2 должен отдать 15 электронов. Записываем общий баланс:
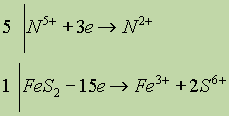
![]()
пять молекул НNО3 идут на окисление FeS2, и еще три молекулы HNO3 необходимы для образования Fe(NО3)3:
![]()
Чтобы уравнять водород и кислород, добавляем в правую часть две молекулы Н2О:
![]()
Метод электронно-ионного баланса более универсален по сравнению с методом электронного баланса и имеет неоспоримое преимущество при подборе коэффициентов во многих окислительно-восстановительных реакциях, в частности, с участием органических соединений, в которых даже процедура определения степеней окисления является очень сложной.
Рассмотрим, например, процесс окисления этилена, происходящий при пропускании его через водный раствор перманганата калия. В результате этилен окисляется до этиленгликоля НО—CH2—СН2—ОН, а перманганат восстанавливается до оксида марганца (IV), кроме того, как будет очевидно из итогового уравнения баланса, справа образуется также гидроксид калия:
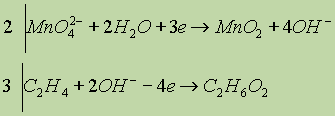
![]()
После проведения необходимых сокращений подобных членов записываем уравнение в окончательном молекулярном виде
![]()
Сте́пень окисле́ния (окислительное число, формальный заряд) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций, численная величина электрического заряда, приписываемого атому вмолекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов. К химическим источникам тока, в которых происходит прямое преобразование химической энергии В электрическую, относят гальванические элементы, топливные элементы, аккумуляторы, а также комбинированные источники тока типа топливный элемент — аккумулятор. Эти источники тока, как правило, имеют высокий к.п.д., работают бесшумно, практически не загрязняют окружающую среду.
Гальванические элементы — это первичные химические источники тока, в которых химические реакции необратимы. В простейшем виде элемент представляет собой два электрода из разных металлов, погруженных в раствор электролита. При этом на одном из электродов (катоде) идет реакция растворения материала электрода - или окисления, при которой электрод теряет электроны, отдавая их во внешнюю электрическую цепь.
 На
другом электроде (аноде) идет реакция
восстановления— нейтрализации ионов
материала, окружающего электрод, за
счет электронов, поступающих с катода
по внешней цепи. Разность потенциалов
(электродвижущая сила) для различных
элементов находится в пределах от 0,85
до 6 В.
На
другом электроде (аноде) идет реакция
восстановления— нейтрализации ионов
материала, окружающего электрод, за
счет электронов, поступающих с катода
по внешней цепи. Разность потенциалов
(электродвижущая сила) для различных
элементов находится в пределах от 0,85
до 6 В.
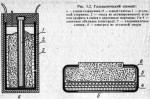
В наиболее широко применяемых гальванических элементах (для питания радиоприемников, карманных фонарей и т. д.) положительный электрод представляет собой угольный стержень 1 (рис. 3.2, а) и массу 2 из активированного угля или смеси двуокиси марганца с графитом, а отрицательный — цинковую обкладку 3 в виде стаканчика или чашечки. В качестве электролита чаще всего используется раствор нашатыря.
Галетному (рис. 3.2, б) элементу придана плоская форма, удобная для соединения в батарею. На наружную сторону цинкового электрода 4 нанесен специальный электропроводный слой, не пропускающий электролит. Собранный элемент покрывают тонкой хлорвиниловой пленкой 5. Такое устройство имеет, например, батарея «Крона». Пленочное покрытие изолирует отдельные элементы с боков, препятствует вытеканию электролита, но легко пропускает газы, образующиеся внутри элемента. Масса из активированного угля 6 несколько выступает из галеты для удобного контакта с другой галетой. В этих батареях активный материал используется лучше и полнее, чем у стаканчиковых батарей.
Сухие гальванические элементы поступают потребителю в готовом виде; водоналивные перед употреблением необходимо залить чистой водой.
Напряжение гальванического элемента всегда меньше, чем развиваемая им э.д.с, во-первых, вследствие падения напряжения внутри элемента на его внутреннем сопротивлении, во-вторых, из-за явления поляризации электродов в результате электрохимических реакций, происходящих на поверхности электродов под влиянием проходящего в цепи тока. Например, выделение водорода на катоде и кислорода на аноде сопровождается возникновением потенциалов поляризации, которые направлены навстречу электродным потенциалам и снижают их. •Чтобы уменьшить влияние поляризации на работу элемента, применяют деполяризаторы — вещества, которые принимают на себя водород или кислород, вступают с ними в реакцию и таким образом способствуют снижению потенциала поляризации. В гальванических элементах с угольным электродом в качестве деполяризатора используется двуокись марганца.
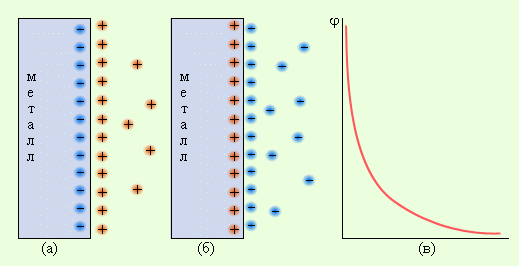
Система, состоящая из металла, погруженного в раствор электролита, называется электродом, то есть электроды в электрохимии – это системы из двух токопроводящих тел: проводников 1 и 2 рода. Абсолютное значение разности потенциалов на границе двух фаз разной природы металл│электролит измерить нельзя, однако можно измерить разность потенциалов двух различных электродов.
|
|
|
Рисунок 7.2 Схема двойного электрического слоя (а) и (б); распределение заряда в объеме электролита (в) |
Значения электродных потенциалов определяются относительно некоторого электрода, потенциал которого условно принят за нулевой. Таким эталонным электродом выбран водородный в стандартных условиях. Его устройство таково: платиновый электрод, покрытый мелкодисперсной платиной (платиновой чернью), погруженный в раствор серной кислоты с активностью ионов водорода 1 моль∙л–1, обдувается струей газообразного водорода под давлением 100 кПа; при этих условиях и приT = 298 K
|
|
|
|
Платиновая чернь адсорбирует водород, который электрохимически взаимодействует с H+ по уравнению
|
|
|
|
Для гальванического элемента
|
|
(–)Pt, H2¦2H+||Mn+¦M(+), |
|
в котором протекает окислительно-восстановительная реакция
|
|
|
|
запишем уравнение изотермы
|
|
|
|
Учитывая, что для стандартного водородного электрода активности ионов H+ и газа H2 равны 1, а ΔG = –nFE, после преобразования получим уравнение Нернста для электродного процесса:
|
|
|
(7.1) |
В
этом уравнении ![]() –
ЭДС реакции, n –
число электронов, участвующих в
электронной реакции, F – число Фарадея.
–
ЭДС реакции, n –
число электронов, участвующих в
электронной реакции, F – число Фарадея.
Коррозия — процесс химического или электрохимического разрушения металлов под действием окружающей среды. Установлено, что от коррозии ежегодно теряется безвозвратно около 10 % производимых металлов, т. е. годовая продукция крупного металлургического завода.
В процессе химического разрушения на поверхности металла образуется пленка из продуктов коррозии, обычно оксидов. В некоторых случаях эта пленка может защищать лежащий под ней металл от дальнейшей коррозии. Сравнительно плотные оксиды пленки образуются на поверхности алюминия, свинца, олова, никеля, хрома. При окислении железа в сухом воздухе или в атмосфере сухого кислорода образуется также достаточно плотная пленка, но она по мере роста растрескивается и отслаивается от металла. Чаще всего химическая коррозия происходит в среде сухих газов при высокой температуре (металлическая арматура печей, клапаны двигателей, лопатки газовых турбин и т.п.) или в жидкостях неэлектролитов (окисление металла в спирте, бензине, нефти, мазуте и т. п.).
При электрохимической коррозии металл разрушается вследствие его растворения в жидкой среде, являющейся электролитом. Сущность процесса электрохимической коррозии заключается в том, что атомы, находящиеся в узлах кристаллической решетки металла, при контакте с раствором электролита переходят в раствор в форме ионов, оставляя эквивалентное количество электронов в металле. Переход атомов металла в ионы и растворение их в жидком электролите определяется величиной нормального электродного потенциала. Он характеризует то напряжение электрического тока, которое надо приложить к границе раздела твердого металла с жидким электролитом, чтобы воспрепятствовать переходу иона металла в раствор. Чем отрицательнее нормальный электродный потенциал, тем более резко выражено стремление металла к растворению в электролитах (например, свинец растворяется значительно медленнее, чем железо). Данный вид коррозии может также возникнуть при контакте двух разнородных металлов в присутствии электролита, когда между этими металлами возникает гальванический ток. В гальванической паре любых двух металлов будет растворяться тот металл, который обладает более отрицательным электродным потенциалом. Например, железо имеет более низкий отрицательный электродный потенциал, чем цинк, и более высокий, чем медь. Следовательно, при контакте железа с цинком будет разрушаться цинк, а при контакте железа с медью — железо. Гальванические пары при коррозии образуются не только между отдельными участками контактирующих металлов, но также и между микроскопически малыми кристалликами одного и того же сплава, если они различаются по химическому составу и физическим свойствам. В результате возникает коррозионное разрушение, которое может проникнуть очень глубоко и идти по границам раздела зерен (межкристаллическая коррозия). Например, в перлите феррит более электроотрицателен, чем цементит, он и будет разрушаться в соответствующих условиях.
[AD]
Таким образом, электрохимическая коррозия — это разрушение сплава, сопровождающееся появлением электрического тока в результате работы множества микрогальванических элементов на корродирующей поверхности металла.
На скорость растворения металла в электролите влияют примеси, способы обработки металла, концентрация электролитов. Металл, находящийся под нагрузкой, корродирует значительно быстрее ненагруженного, так как нарушается целостность защитной пленки и образуются микротрещины (коррозионное растрескивание). Разрушение металла одновременным воздействием знакопеременных нагрузок и коррозионной среды называют коррозионной усталостью.
В зависимости от характера окружающей среды электрохимическая коррозия может быть подводной, атмосферной, почвенной, вызванной блуждающими токами. Электрохимическая коррозия металлов в воде обусловливается присутствием в ней растворенного кислорода. При атмосферной коррозии электролитом служит тонкая пленка влаги, сам же процесс коррозии ничем не отличается от коррозии в воде.
В результате коррозии стали на ее поверхности появляется смесь различных гидратированных оксидов железа, имеющих состав «FeO-pH2O+mFe2O3-<?H2O (ржавчина).
Активному протеканию процесса коррозии способствует углекислый и в особенности сернистый газы, хлористый водород, различные соли.
Защиту от коррозии следует начинать с правильного подбора химического состава и структуры металла. При конструировании необходимо избегать форм, способствующих задержке влаги. Для защиты металла от коррозии применяют различные способы.
Легирование стали повышает ее антикоррозионные свойства. Например, совершенную стойкость к атмосферной коррозии показывают нержавеющие легированные стали, содержащие в большом количестве хром, который, образуя на поверхности оксидные пленки, приводит сталь в пассивное состояние. Существенно повышается (в 1,5...3 раза) коррозионная стойкость строительных сталей при введении в их состав меди (0,2...0,5 %). Повышенной стойкости нержавеющих сталей против коррозии способствуют также их однородность и небольшое содержание вредных примесей.