
- •№ 1 Классы неорганических веществ. Оксиды, основания, кислоты, соли: определения, классификация, названия, свойства, получение.
- •Классификации:
- •№ 2 Основные понятия и законы химии. Атом, молекула, простые и сложные вещества, моль. Относительная молекулярная масса. Молярная масса, эквивалентная масса.
- •Формулой атома
- •Способы выражения концентрации растворов:
- •* РН растворов солей. Возможны три случая гидролиза солей.
- •2. Уравняем данную реакцию методом электронного баланса. Процесс восстановления описывается:
- •Защитные покрытия представляют собой пленки (металлические, оксидные, лакокрасочные и т.П.).
Способы выражения концентрации растворов:
1. Массовая доля. Она показывает отношение массы растворенного вещества к массе раствора. сколько грамм растворенного вещества содержится в 100 граммах раствора и обозначается - %
2. Моляльная или моляльность. Она показывает, сколько молей растворенного вещества приходится на килограмм растворителя. Чаще всего ее обозначают m и она имеет размерность М/кг или М/1000г.
3. Молярная или молярность. Она показывает, сколько молей растворенного вещества содержится в 1-ом литре раствора. Ее обозначают М и она имеет размерность М/л.
4. Нормальная или нормальность. Она показывает, сколько моль эквивалентов растворенного вещества содержится в литре раствора. Ее обозначают Н и она имеет размерностьМоль Эквивалент/л (МЭ/л).
5. Мольная доля. Она показывает долю молекул данного сорта от общего количества молекул раствора.
* Тепловой эффект химической реакции или изменение энтальпии системы вследствие протекания химической реакции — отнесенное к изменению химической переменной количество теплоты, полученное системой, в которой прошла химическая реакция и продукты реакции приняли температуру реагентов.
* Коллигативные свойства – это свойства растворов, зависящие от числа частиц растворенного вещества. К коллигативным свойствам растворов относят:
1) понижение давления насыщенного пара растворителя над раствором,
2) понижение температуры замерзания и повышение температуры кипения растворов по сравнению с температурами замерзания и кипения чистых растворителей.
3) осмотическое давление.
* Значение осмоса
Осмос играет важную роль в биологических процессах, обеспечивая поступление воды в клетки.
Растворы с одинаковым осмотическим давлением называются изотоническими. Если осмотическое давление выше внутриклеточного, то оно называется гипертоническим, если ниже внутриклеточного – гипотоническим.
*Осмотическое давление
Если привести в соприкосновение два раствора с разными концентрациями, то молекулы будут диффундировать преимущественно в том направлении, где их концентрация ниже. Двусторонняя диффузия приведет к выравниванию концентраций.
Диффузия может стать односторонней, если растворы разделить полупроницаемой перегородкой, пропускающей только молекулы растворителя.
*Растворы электролитов, содержат в заметных концентрациях ионы-катионы и анионы. образующиеся в результатеэлектролитической диссоциации молекул растворенного вещества. Р-ритель (чистый или смешанный) обычно в сколько-нибудь значит. степени не диссоциирован. Р. э. обладают способностью проводить электрич. ток и относятся к проводникам второго рода. Благодаря увеличению общего числа частиц коллигативные свойства бесконечно разбавленных растворы электролитов (т. е. свойства, зависящие только от концентрации растворенного вещества, но не от его природы) существенно отличаются от тех же свойств растворов неэлектролитов.
* ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ, полный или частичный распад молекул растворенного в-ва на катионы и анионы. Электролитическойдиссоциацией называют также распад на катионы и анионы ионных кристаллов при растворении или расплавлении. Электролитическаядиссоциация, как правило, происходит в полярных р-рителях.
* Различают сильные и слабые электролиты. Сильные электролиты в растворах практически диссоциированы полностью. К этой группе электролитов относится большинство солей, щелочей и сильных кислот. К слабым электролитам принадлежат слабые кислоты и слабые основания и некоторые соли: хлорид ртути (II), цианид ртути (II), роданид железа (III), иодид кадмия. Растворы сильных электролитов при больших концентрациях обладают значительной электропроводностью, причем она с разбавлением растворов возрастает незначительно.
Растворы слабых электролитов при больших концентрациях отличаются незначительной электропроводностью, сильно увеличивающейся при разбавлении растворов.
* Произведение растворимости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
В насыщенном растворе труднорастворимого сильного электролита произведение концентрации его ионов в степенях стехиометрических коэффициентов при данной температуре есть величина постоянная, называемая произведением растворимости (ПР).
9)* Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксила OH− в воде или в водных растворах, константа автопротолиза воды.
*
Водородный показатель
(рН) величина, характеризующая активность
или концентрацию ионов водорода в
растворах. Водородный показатель
обозначается рН.
Водородный
показатель численно равен отрицательному
десятичному логарифму активности
или концентрации ионов водорода,
выраженной в молях на литр:
pH=-lg[
H+ ]
В
воде концентрация ионов водорода
определяется электролитической
диссоциацией воды по
уравнению
H2O=H++OH-
Константа
диссоциации при 22° С составляет
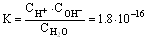
![]()
* Гидролиз солей – это взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц.
Гидролиз, дословно, - это разложение водой. Давая такое определение реакции гидролиза солей, мы подчеркиваем, что соли в растворе находятся в виде ионов, и что движущей силой реакции является образование малодиссоциирующих частиц (общее правило для многих реакций в растворах).
Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах (преимущественно, водных) растворимых солей-электролитов. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или (реже) молекулярном виде («связывание ионов»).
