
- •«Национальный исследовательский
- •Томский политехнический Университет»
- •Е.В. Михеева, н.П. Пикула, а.П. Асташкина
- •Коллоидная химия
- •Оглавление
- •Глава 1 дисперсные системы
- •1.1. Общая характеристика дисперсных систем
- •1.1.1. Признаки объектов коллоидной химии
- •1.1.2. Специфические особенности высокодисперсных систем
- •1.2. Классификации дисперсных систем
- •1.2.1. Классификация по размерам частиц дисперсной фазы
- •1.2.2. Классификация по агрегатному состоянию дисперсной фазы и дисперсионной среды
- •1.2.3. Классификация по силе межфазного взаимодействия дисперсной фазы и дисперсионной среды
- •1.2.4. Классификация по подвижности частиц дф (по структуре)
- •1.2.5. Классификация по фазовой различимости
- •1.2.6. Классификация по топографическому признаку (по форме частиц)
- •1.3. Методы получения дисперсных систем
- •1.3.1. Диспергационные методы
- •1.3.2. Конденсационные методы
- •1.3.2.1. Физические конденсационные методы
- •1.3.2.2. Химические конденсационные методы
- •2. Реакции обмена
- •3. Реакции окисления
- •1.3.3. Метод пептизации
- •1.4. Методы очистки дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 2 термодинамика поверхностных явлений
- •2.1. Классификация поверхностных явлений
- •2.2. Свободная поверхностная энергия и поверхностное натяжение
- •2.2.1. Физический смысл поверхностного натяжения
- •2.2.2. Термодинамическое определение поверхностного натяжения
- •2.2.3. Единицы измерения поверхностного натяжения
- •2.3. Влияние различных факторов на величину поверхностного натяжения
- •2.3.1. Влияние химической природы вещества
- •2.3.2. Влияние температуры
- •2.3.3. Влияние природы граничащих фаз
- •2.3.4. Влияние природы и концентрации растворенного вещества
- •2.4. Межмолекулярные и межфазные взаимодействия
- •2.4.1. Когезия
- •2.4.2. Адгезия
- •2.4.3. Растекание одной жидкости по поверхности другой
- •2.4.4. Смачивание
- •2.4.4.1. Анализ уравнения Юнга
- •2.4.4.2. Флотация
- •2.5. Особенности искривленной поверхности раздела фаз
- •2.5.1. Уравнение Лапласа
- •2.5.2. Капиллярное давление. Течение жидкости в капиллярах
- •2.6. Методы определения поверхностного натяжения
- •2.6.1. Метод наибольшего давления пузырька газа (метод Ребиндера)
- •2.6.2. Сталагмометрический метод (метод счета капель)
- •2.6.3. Метод капиллярного поднятия жидкости
- •2.7. Влияние кривизны поверхности на давление насыщенного пара
- •2.7.1. Уравнения Томсона (Кельвина)
- •2.7.2. Капиллярная конденсация
- •2.7.3. Изотермическая перегонка
- •Вопросыи задания для самоконтроля
- •Глава 3 адсорбция
- •3.1. Основные понятия и определения
- •3.1.1. Количественные способы выражения величины адсорбции
- •3.1.2. Классификации адсорбции
- •1. Классификация по природе границы раздела
- •2. Классификация по типу взаимодействия адсорбата и адсорбента
- •3.1.3. Основные экспериментальные зависимости адсорбции
- •3.2.Адсорбция на границе твердое тело – газ
- •3.2.1. Теория мономолекулярной адсорбции Лэнгмюра
- •3.2.2. Эмпирическое уравнение адсорбции Фрейндлиха
- •3.2.3. Теория полимолекулярной адсорбции Поляни
- •3.2.4. Дальнейшие представления о многослойной адсорбции. Теория бэт
- •3.2.5. Адсорбция на пористых адсорбентах
- •3.2.6.Адсорбенты и их характеристики
- •3.3.Адсорбция на границе жидкость – газ
- •3.3.1. Фундаментальное уравнение адсорбции Гиббса
- •3.3.2. Свойства поверхностно-активных (пав) и поверхностно-инактивных (пив) веществ
- •3.3.3. Строение адсорбционного слоя на границе раствор–газ
- •3.3.4. Уравнение Шишковского
- •3.3.5. Поверхностная активность. Правило Дюкло – Траубе
- •3.3.6. Расчет гиббсовской адсорбции из изотермы поверхностного натяжения методом графического дифференцирования
- •3.3.7.Применение уравнения изотермы Лэнгмюра к адсорбции на границе жидкость–газ. Расчет молекулярных характеристик исследуемого пав
- •3.3.8. Мицеллообразование в растворах коллоидных пав
- •3.3.9. Классификации пав
- •3.3.10. Солюбилизация
- •3.3.11. Практическое значение пав
- •3.3.12. Проблемы биоразлагаемости промышленных пав
- •3.4.Адсорбция на границе твердое тело – раствор
- •3.4.1. Молекулярная адсорбция
- •3.4.2. Ионная адсорбция
- •3.4.3. Ионообменная адсорбция. Ионный обмен
- •Вопросыи задания для самоконтроля
- •Глава 4 электрические свойства дисперсных систем
- •4.1. Электрокинетические явления
- •4.1.1. Механизм образования двойного электрического слоя
- •1. Неравенство электрохимических потенциалов ионов в кристаллической решетке твердого тела и ионов в растворе
- •Адсорбционный механизм образования дэс
- •Механизм поверхностной диссоциации
- •2. Специфическая адсорбции ионов на поверхности твердой фазы
- •3. Ориентированная адсорбция поверхностно-активных веществ
- •4.2. Теории строения двойного электрического слоя
- •4.2.1. Экспериментальные факты, послужившие основой для создания теорий строения дэс
- •4.2.2. Теория строения дэс Гельмгольца – Перрена
- •4.2.3. Теория строения дэс Гуи – Чэпмена
- •4.2.4. Современная теория строения дэс Штерна
- •4.3. Электрокинетический потенциал
- •4.3.1. Определение электрокинетического потенциала из электрокинетических явлений
- •4.3.2. Практическое значение электрокинетических явлений
- •4.4. Строение коллоидных мицелл
- •4.4.1. Примеры мицелл гидрофобных золей в природе
- •Вопросы и задания для самоконтроля
- •Глава 5 устойчивость и коагуляция лиофобных дисперсных систем
- •5.1. Основные понятия и определения
- •5.1.1. Факторы агрегативной устойчивости лиофобных систем
- •5.2. Коагуляция
- •Стадии коагуляции
- •5.2.1. Кинетика коагуляции. Теория кинетики быстрой коагуляции Смолуховского
- •5.2.2. Коагуляция золей электролитами
- •Эмпирические правила электролитной коагуляции
- •5.3. Теория устойчивости лиофобных дисперсных систем длфо
- •5.3.1. Расклинивающее давление
- •Составляющие расклинивающего давления
- •5.3.2. Энергия электростатического отталкивания
- •5.3.3. Энергия молекулярного притяжения
- •5.3.4. Потенциальные кривые взаимодействия частиц
- •5.4. Закономерности коагуляции гидрофобных золей электролитами
- •5.4.1. Особые явления при коагуляции
- •Коагуляция смесью электролитов
- •5.4.2. Примеры коагуляции. Образование почв
- •5.4.3. Физико-химические методы очистки сточных вод
- •Вопросыи задания для самоконтроля
- •Глава 6 структурно-механические свойства дисперсных систем
- •6.1. Типы структур
- •6.2. Реологические свойства дисперсных систем
- •6.2.1. Вязкость жидких дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 7 оптические свойства дисперсных систем
- •7.1. Рассеяние света в дисперсных системах
- •7.2. Поглощение света в дисперсных системах
- •7.3. Окраска дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 8 молекулярно-кинетические свойства дисперсных систем
- •8.1. Осмос
- •8.2. Диффузия
- •8.3. Броуновское движение
- •8.4. Седиментационное равновесие
- •8.5. Седиментационный анализ
- •Вопросы и задания для самоконтроля
- •Глава 9 краткая характеристика основных дисперсных систем
- •9.1. Системы с жидкой дисперсионной средой
- •9.1.1. Суспензии и золи
- •Классификация суспензий
- •Получение суспензий
- •Значение суспензий
- •9.1.2. Эмульсии
- •Классификация эмульсий
- •Агрегативная устойчивость эмульсии и природа эмульгатора
- •9.1.3. Пены
- •9.2. Системы с газообразной дисперсионной средой
- •9.2.1. Аэрозоли
- •Классификации аэрозолей
- •Агрегативная устойчивость аэрозолей. Коагуляция
- •Методы разрушения аэрозолей
- •9.3. Системы с твердой дисперсионной средой
- •Вопросыи задания для самоконтроля
- •Перечень используемой литературы
- •Коллоидная химия
- •В авторской редакции
- •Отпечатано в Издательстве тпу в полном соответствии с качеством предоставленного оригинал-макета
4.4.1. Примеры мицелл гидрофобных золей в природе
В
природе в коллоидном состоянии широко
распространены сульфидные руды многих
элементов (![]() ).
).
![]() –важнейший
стабилизатор коллоидных
частиц сернистых минералов,
может диссоциировать по двум стадиям:
–важнейший
стабилизатор коллоидных
частиц сернистых минералов,
может диссоциировать по двум стадиям:
![]()
![]()
![]()
![]()
![]() .
.
Показано,
что устойчивость коллоидных растворов,
стабилизированных
![]() зависит от присутствия кислорода
воздуха. Так, при хранении золя сульфида
ртути без воздуха ее устойчивость
возрастает, что, по-видимому, объясняется
изменением состава мицеллы:
зависит от присутствия кислорода
воздуха. Так, при хранении золя сульфида
ртути без воздуха ее устойчивость
возрастает, что, по-видимому, объясняется
изменением состава мицеллы:
![]()
![]() .
.
При
этом потенциалопределяющими ионами
являются в первом случае
![]() ,
во втором –
,
во втором –![]() .
.
Коллоидный
карбонат кальция
в природе не устойчив и сравнительно
быстро переходит в метаколлоидные
формы. Предположив, что
![]() образуется при обменной реакции:
образуется при обменной реакции:
![]() .
.
Вероятное строение мицеллы можно представить следующим образом:
при избытке
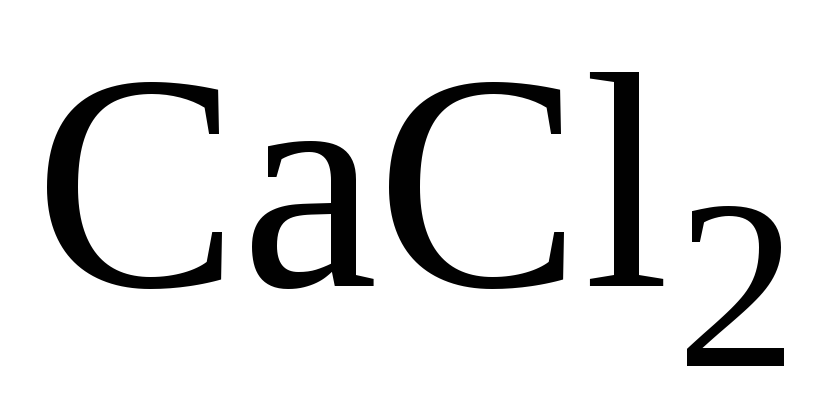 :
:
![]() ,
,
при избытке
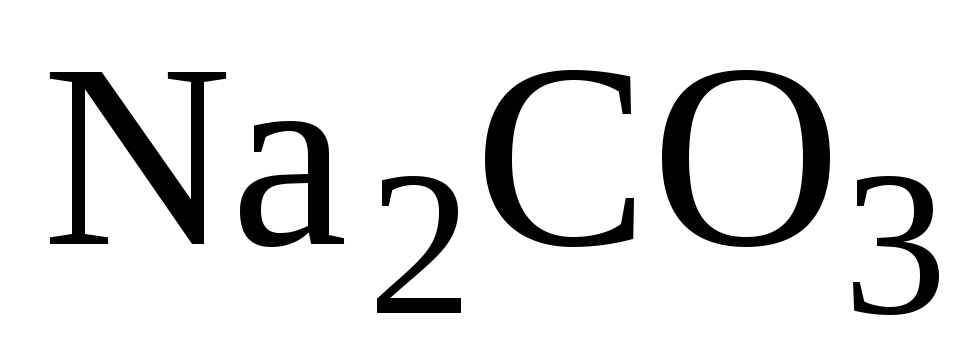 :
:
![]() .
.
Золь сульфата бария образуется в природе при взаимодействии растворимых соединений бария с растворимыми сульфатами. Заряд коллоидной частицы обычно отрицателен:
![]() ,
,
стабилизатор:
![]() .
.
Щелочные метасиликаты при гидролизе
![]()
образуют устойчивые золи кремниевой кислоты, которые в щелочных растворах имеют отрицательный заряд:
![]() ,
,
стабилизатор:
![]() .
.
Возникновение двойного электрического слоя на поверхности ионностабилизированных частиц сообщает им электрический заряд. Последний может возникать также за счет диссоциации собственных частиц ионогенных групп.
Например, гидроксид алюминия, образующийся при обменных и гидролитических реакциях, легко пептизируется, т.к. на поверхности частиц возможна диссоциация по кислотному или основному типу в зависимости от рН грунтовых вод:
![]()
![]()
![]()
![]()
![]() ,
,
поэтому строение мицеллы определяет рН среды:
при рН < 7
![]() ;
;
при рН > 8,1
![]() ;
;
при 7 ≤ рН ≤ 8,1
![]() ,
,
значение электрокинетического потенциала равно нулю.
Другим
примером является золь
кремнезема
на поверхности частиц
![]() ,
построенных из
,
построенных из![]() -тетраэдров
при взаимодействии с водой, когда
образуются силанольные группы:
-тетраэдров
при взаимодействии с водой, когда
образуются силанольные группы:
![]()
Возникшее поверхностное соединение – поликремнекислота – способно к частичной диссоциации по кислотному типу:
![]() .
.
Мицелла может быть представлена:
![]() .
.
Вопросы и задания для самоконтроля
1. Что является причиной электрокинетических явлений?
2. Каким образом образуется двойной электрический слой?
3. Перечислите и охарактеризуйте основные теории строения ДЭС.
4. Что такое электрокинетический потенциал и где он возникает?
5. Каким образом можно количественно рассчитать величину электрокинетического потенциала?
6. Каково строение коллоидных мицелл?
7. Приведите примеры мицелл гидрофобных золей в природе.
Глава 5 устойчивость и коагуляция лиофобных дисперсных систем
5.1. Основные понятия и определения
Все
дисперсные системы условно делятся на
лиофильные – получаемые самопроизвольным
диспергированием и термодинамически
устойчивые и лиофобные дисперсные
системы – термодинамические
неустойчивые.
Несмотря на термодинамическую
неустойчивость (![]() ),
многие лиофобные дисперсные системы
оказываются устойчивыми кинетически,
не изменяясь заметно с течение некоторого
времени (иногда десятилетиями). Рассмотрим
причины такого поведения лиофобных
дисперсных систем.
),
многие лиофобные дисперсные системы
оказываются устойчивыми кинетически,
не изменяясь заметно с течение некоторого
времени (иногда десятилетиями). Рассмотрим
причины такого поведения лиофобных
дисперсных систем.
Устойчивость дисперсной системы – неизменность во времени ее основных параметров: дисперсности и равновесного распределения дисперсной фазы в дисперсионной среде.
Проблема устойчивости дисперсных систем является одной из важнейших в коллоидной химии. В одних случаях необходимо обеспечить предельно высокую устойчивость дисперсных систем (при получении аэрозольных препаратов, связующих материалов), в других – разрушить дисперсную систему (получение осадков, ликвидация кислотных туманов, очистка сточных вод). Устойчивость является проблемой «жизни и смерти» дисперсной системы и она должна быть управляемой.
Различают два вида устойчивости (по Пескову): агрегативную и седиментационную (кинетическую).
1. Агрегативная устойчивость – способность частиц дисперсной фазы оказывать сопротивлению их слипанию и тем самым удерживать определенную степень дисперсности (способность сохранять размер дисперсной фазы).
Решающим фактором в агрегативной устойчивости дисперсной системы является степень дисперсности частиц дисперсной фазы: чем она выше (чем меньше размер частиц), чем больше энергия их броуновского движения, тем выше агрегативная устойчивость. При нарушении агрегативной устойчивости происходит нарушение седиментационной устойчивости.
2. Седиментационная устойчивость – устойчивость дисперсной фазы по отношению к силе тяжести (способность дисперсной системы сохранять равномерное распределение частиц дисперсной фазы по объему дисперсионной среды).
Примером лиофобной дисперсной системы могут служить сточные воды. Сточные воды наряду с грубодисперсными (5–10 мкм) фракциями, удаляемых механическими способами в результате потери седиментационной устойчивости содержатся высокодисперсные фракции. В основе некоторых методов очистки сточных вод от высокодисперсных фракций загрязнений лежит явление потери агрегативной устойчивости в результате объединения частиц под влиянием специально вводимых коагулянтов и флокулянтов, добавление которых приводит к потере седиментационной устойчивости.
Нарушение седиментационной устойчивости может быть вызвано оседанием (седиментацией) частиц под действием их силы тяжести, приводящей к оседанию (или всплыванию) частиц дисперсной фазы. Это особенно характерно для грубодисперсных систем.
