- •«Национальный исследовательский
- •Томский политехнический Университет»
- •Е.В. Михеева, н.П. Пикула, а.П. Асташкина
- •Коллоидная химия
- •Оглавление
- •Глава 1 дисперсные системы
- •1.1. Общая характеристика дисперсных систем
- •1.1.1. Признаки объектов коллоидной химии
- •1.1.2. Специфические особенности высокодисперсных систем
- •1.2. Классификации дисперсных систем
- •1.2.1. Классификация по размерам частиц дисперсной фазы
- •1.2.2. Классификация по агрегатному состоянию дисперсной фазы и дисперсионной среды
- •1.2.3. Классификация по силе межфазного взаимодействия дисперсной фазы и дисперсионной среды
- •1.2.4. Классификация по подвижности частиц дф (по структуре)
- •1.2.5. Классификация по фазовой различимости
- •1.2.6. Классификация по топографическому признаку (по форме частиц)
- •1.3. Методы получения дисперсных систем
- •1.3.1. Диспергационные методы
- •1.3.2. Конденсационные методы
- •1.3.2.1. Физические конденсационные методы
- •1.3.2.2. Химические конденсационные методы
- •2. Реакции обмена
- •3. Реакции окисления
- •1.3.3. Метод пептизации
- •1.4. Методы очистки дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 2 термодинамика поверхностных явлений
- •2.1. Классификация поверхностных явлений
- •2.2. Свободная поверхностная энергия и поверхностное натяжение
- •2.2.1. Физический смысл поверхностного натяжения
- •2.2.2. Термодинамическое определение поверхностного натяжения
- •2.2.3. Единицы измерения поверхностного натяжения
- •2.3. Влияние различных факторов на величину поверхностного натяжения
- •2.3.1. Влияние химической природы вещества
- •2.3.2. Влияние температуры
- •2.3.3. Влияние природы граничащих фаз
- •2.3.4. Влияние природы и концентрации растворенного вещества
- •2.4. Межмолекулярные и межфазные взаимодействия
- •2.4.1. Когезия
- •2.4.2. Адгезия
- •2.4.3. Растекание одной жидкости по поверхности другой
- •2.4.4. Смачивание
- •2.4.4.1. Анализ уравнения Юнга
- •2.4.4.2. Флотация
- •2.5. Особенности искривленной поверхности раздела фаз
- •2.5.1. Уравнение Лапласа
- •2.5.2. Капиллярное давление. Течение жидкости в капиллярах
- •2.6. Методы определения поверхностного натяжения
- •2.6.1. Метод наибольшего давления пузырька газа (метод Ребиндера)
- •2.6.2. Сталагмометрический метод (метод счета капель)
- •2.6.3. Метод капиллярного поднятия жидкости
- •2.7. Влияние кривизны поверхности на давление насыщенного пара
- •2.7.1. Уравнения Томсона (Кельвина)
- •2.7.2. Капиллярная конденсация
- •2.7.3. Изотермическая перегонка
- •Вопросыи задания для самоконтроля
- •Глава 3 адсорбция
- •3.1. Основные понятия и определения
- •3.1.1. Количественные способы выражения величины адсорбции
- •3.1.2. Классификации адсорбции
- •1. Классификация по природе границы раздела
- •2. Классификация по типу взаимодействия адсорбата и адсорбента
- •3.1.3. Основные экспериментальные зависимости адсорбции
- •3.2.Адсорбция на границе твердое тело – газ
- •3.2.1. Теория мономолекулярной адсорбции Лэнгмюра
- •3.2.2. Эмпирическое уравнение адсорбции Фрейндлиха
- •3.2.3. Теория полимолекулярной адсорбции Поляни
- •3.2.4. Дальнейшие представления о многослойной адсорбции. Теория бэт
- •3.2.5. Адсорбция на пористых адсорбентах
- •3.2.6.Адсорбенты и их характеристики
- •3.3.Адсорбция на границе жидкость – газ
- •3.3.1. Фундаментальное уравнение адсорбции Гиббса
- •3.3.2. Свойства поверхностно-активных (пав) и поверхностно-инактивных (пив) веществ
- •3.3.3. Строение адсорбционного слоя на границе раствор–газ
- •3.3.4. Уравнение Шишковского
- •3.3.5. Поверхностная активность. Правило Дюкло – Траубе
- •3.3.6. Расчет гиббсовской адсорбции из изотермы поверхностного натяжения методом графического дифференцирования
- •3.3.7.Применение уравнения изотермы Лэнгмюра к адсорбции на границе жидкость–газ. Расчет молекулярных характеристик исследуемого пав
- •3.3.8. Мицеллообразование в растворах коллоидных пав
- •3.3.9. Классификации пав
- •3.3.10. Солюбилизация
- •3.3.11. Практическое значение пав
- •3.3.12. Проблемы биоразлагаемости промышленных пав
- •3.4.Адсорбция на границе твердое тело – раствор
- •3.4.1. Молекулярная адсорбция
- •3.4.2. Ионная адсорбция
- •3.4.3. Ионообменная адсорбция. Ионный обмен
- •Вопросыи задания для самоконтроля
- •Глава 4 электрические свойства дисперсных систем
- •4.1. Электрокинетические явления
- •4.1.1. Механизм образования двойного электрического слоя
- •1. Неравенство электрохимических потенциалов ионов в кристаллической решетке твердого тела и ионов в растворе
- •Адсорбционный механизм образования дэс
- •Механизм поверхностной диссоциации
- •2. Специфическая адсорбции ионов на поверхности твердой фазы
- •3. Ориентированная адсорбция поверхностно-активных веществ
- •4.2. Теории строения двойного электрического слоя
- •4.2.1. Экспериментальные факты, послужившие основой для создания теорий строения дэс
- •4.2.2. Теория строения дэс Гельмгольца – Перрена
- •4.2.3. Теория строения дэс Гуи – Чэпмена
- •4.2.4. Современная теория строения дэс Штерна
- •4.3. Электрокинетический потенциал
- •4.3.1. Определение электрокинетического потенциала из электрокинетических явлений
- •4.3.2. Практическое значение электрокинетических явлений
- •4.4. Строение коллоидных мицелл
- •4.4.1. Примеры мицелл гидрофобных золей в природе
- •Вопросы и задания для самоконтроля
- •Глава 5 устойчивость и коагуляция лиофобных дисперсных систем
- •5.1. Основные понятия и определения
- •5.1.1. Факторы агрегативной устойчивости лиофобных систем
- •5.2. Коагуляция
- •Стадии коагуляции
- •5.2.1. Кинетика коагуляции. Теория кинетики быстрой коагуляции Смолуховского
- •5.2.2. Коагуляция золей электролитами
- •Эмпирические правила электролитной коагуляции
- •5.3. Теория устойчивости лиофобных дисперсных систем длфо
- •5.3.1. Расклинивающее давление
- •Составляющие расклинивающего давления
- •5.3.2. Энергия электростатического отталкивания
- •5.3.3. Энергия молекулярного притяжения
- •5.3.4. Потенциальные кривые взаимодействия частиц
- •5.4. Закономерности коагуляции гидрофобных золей электролитами
- •5.4.1. Особые явления при коагуляции
- •Коагуляция смесью электролитов
- •5.4.2. Примеры коагуляции. Образование почв
- •5.4.3. Физико-химические методы очистки сточных вод
- •Вопросыи задания для самоконтроля
- •Глава 6 структурно-механические свойства дисперсных систем
- •6.1. Типы структур
- •6.2. Реологические свойства дисперсных систем
- •6.2.1. Вязкость жидких дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 7 оптические свойства дисперсных систем
- •7.1. Рассеяние света в дисперсных системах
- •7.2. Поглощение света в дисперсных системах
- •7.3. Окраска дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 8 молекулярно-кинетические свойства дисперсных систем
- •8.1. Осмос
- •8.2. Диффузия
- •8.3. Броуновское движение
- •8.4. Седиментационное равновесие
- •8.5. Седиментационный анализ
- •Вопросы и задания для самоконтроля
- •Глава 9 краткая характеристика основных дисперсных систем
- •9.1. Системы с жидкой дисперсионной средой
- •9.1.1. Суспензии и золи
- •Классификация суспензий
- •Получение суспензий
- •Значение суспензий
- •9.1.2. Эмульсии
- •Классификация эмульсий
- •Агрегативная устойчивость эмульсии и природа эмульгатора
- •9.1.3. Пены
- •9.2. Системы с газообразной дисперсионной средой
- •9.2.1. Аэрозоли
- •Классификации аэрозолей
- •Агрегативная устойчивость аэрозолей. Коагуляция
- •Методы разрушения аэрозолей
- •9.3. Системы с твердой дисперсионной средой
- •Вопросыи задания для самоконтроля
- •Перечень используемой литературы
- •Коллоидная химия
- •В авторской редакции
- •Отпечатано в Издательстве тпу в полном соответствии с качеством предоставленного оригинал-макета
4.1.1. Механизм образования двойного электрического слоя
При погружении твердой фазы в раствор электролита происходят следующие явления: между твердой фазой и раствором возникает двойной электрический слой, появляется вполне определенная разность потенциалов между поверхностью дисперсной фазы и дисперсионной средой. Образование двойного электрического слоя можно объяснить рядом причин:
1. Неравенство электрохимических потенциалов ионов в кристаллической решетке твердого тела и ионов в растворе
С
термодинамической точки зрения
возникновение ДЭС на границе твердое
тело – раствор может быть связано с
неравенством электрохимических
потенциалов ионов в кристаллической
решетке твердого тела и ионов в растворе:
![]() .
.
Электрохимический
потенциал
– химический потенциал плюс
электрохимическая составляющая
![]() .
.
Если
электрохимические потенциалы одного
и того же иона в твердой и жидкой фазе
не одинаковы, то происходит перенос
иона от большего электрохимического
потенциала к меньшему до полного их
выравнивания:
![]() .
.
В рамках выравнивая электрохимических потенциалов, возможно два механизма образования ДЭС: адсорбционный и механизм поверхностной диссоциации.
Адсорбционный механизм образования дэс
|
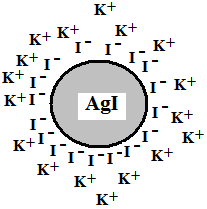
Рис. 4.5. Мицелла золя иодида серебра
|
Рассмотрим адсорбционный механизм образования ДЭС на примере золя иодида серебра, полученного при избытке иодида калия по реакции:
При избытке KI электрохимический потенциал иодид-ионов в растворе больше электрохимического потенциала иодид-ионов на поверхности твердой фазы:
|
Иодид-ионы будут терять свою сольватную оболочку, и адсорбироваться на поверхности твердой фазы, заряжая частицу отрицательно. К отрицательно заряженной частице из раствора за счет электростатического притяжения будут притягиваться ионы противоположного знака (ионы калия), образуется двойной электрический слой. По аналогии со строением конденсатора вводится понятие внутренней и внешней обкладки ДЭС. Ионы, образующие внутреннюю обкладку и вызывающие возникновение потенциала – потенциалопределяющие ионы (ПОИ) – иодид-ионы; ионы, составляющие внешнюю обкладку – противоионы (ПИ) – ионы калия.
Механизм поверхностной диссоциации
Если
электрохимический потенциал иодид
ионов в кристаллической решетке твердой
фазы больше, чем в объеме раствора
![]() (концентрация иодид-ионов в растворе
мала), то иодид-ионы с поверхности будут
переходить в раствор за счет поверхностной
диссоциации ионов кристаллической
решетки и образовывать у поверхности
внешнюю обкладку ДЭС. Поверхность
твердой фазы в этом случае зарядится
положительно и будет служить внутренней
обкладкой ДЭС.
(концентрация иодид-ионов в растворе
мала), то иодид-ионы с поверхности будут
переходить в раствор за счет поверхностной
диссоциации ионов кристаллической
решетки и образовывать у поверхности
внешнюю обкладку ДЭС. Поверхность
твердой фазы в этом случае зарядится
положительно и будет служить внутренней
обкладкой ДЭС.
2. Специфическая адсорбции ионов на поверхности твердой фазы
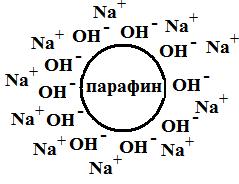
Возникновение ДЭС может быть результатом специфической адсорбции ионов на поверхности твердой фазы. Под специфической адсорбцией понимают накопление на поверхности твердой фазы ионов под действием адсорбционных сил.
|
Рис. 4.6. Потенциалопределяющие ионы – OH–, противоионы – Na+ |
Так как адсорбционная способность анионов выше, чем у катионов, то на поверхности твердой частицы в результате специфической адсорбции может появиться адсорбционный слой анионов, которые притянут к себе катионы из раствора. Примером такой специфической адсорбции может являться адсорбция гидроксид-ионов на поверхности парафина (золь парафина в растворе щелочи). |