- •«Национальный исследовательский
- •Томский политехнический Университет»
- •Е.В. Михеева, н.П. Пикула, а.П. Асташкина
- •Коллоидная химия
- •Оглавление
- •Глава 1 дисперсные системы
- •1.1. Общая характеристика дисперсных систем
- •1.1.1. Признаки объектов коллоидной химии
- •1.1.2. Специфические особенности высокодисперсных систем
- •1.2. Классификации дисперсных систем
- •1.2.1. Классификация по размерам частиц дисперсной фазы
- •1.2.2. Классификация по агрегатному состоянию дисперсной фазы и дисперсионной среды
- •1.2.3. Классификация по силе межфазного взаимодействия дисперсной фазы и дисперсионной среды
- •1.2.4. Классификация по подвижности частиц дф (по структуре)
- •1.2.5. Классификация по фазовой различимости
- •1.2.6. Классификация по топографическому признаку (по форме частиц)
- •1.3. Методы получения дисперсных систем
- •1.3.1. Диспергационные методы
- •1.3.2. Конденсационные методы
- •1.3.2.1. Физические конденсационные методы
- •1.3.2.2. Химические конденсационные методы
- •2. Реакции обмена
- •3. Реакции окисления
- •1.3.3. Метод пептизации
- •1.4. Методы очистки дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 2 термодинамика поверхностных явлений
- •2.1. Классификация поверхностных явлений
- •2.2. Свободная поверхностная энергия и поверхностное натяжение
- •2.2.1. Физический смысл поверхностного натяжения
- •2.2.2. Термодинамическое определение поверхностного натяжения
- •2.2.3. Единицы измерения поверхностного натяжения
- •2.3. Влияние различных факторов на величину поверхностного натяжения
- •2.3.1. Влияние химической природы вещества
- •2.3.2. Влияние температуры
- •2.3.3. Влияние природы граничащих фаз
- •2.3.4. Влияние природы и концентрации растворенного вещества
- •2.4. Межмолекулярные и межфазные взаимодействия
- •2.4.1. Когезия
- •2.4.2. Адгезия
- •2.4.3. Растекание одной жидкости по поверхности другой
- •2.4.4. Смачивание
- •2.4.4.1. Анализ уравнения Юнга
- •2.4.4.2. Флотация
- •2.5. Особенности искривленной поверхности раздела фаз
- •2.5.1. Уравнение Лапласа
- •2.5.2. Капиллярное давление. Течение жидкости в капиллярах
- •2.6. Методы определения поверхностного натяжения
- •2.6.1. Метод наибольшего давления пузырька газа (метод Ребиндера)
- •2.6.2. Сталагмометрический метод (метод счета капель)
- •2.6.3. Метод капиллярного поднятия жидкости
- •2.7. Влияние кривизны поверхности на давление насыщенного пара
- •2.7.1. Уравнения Томсона (Кельвина)
- •2.7.2. Капиллярная конденсация
- •2.7.3. Изотермическая перегонка
- •Вопросыи задания для самоконтроля
- •Глава 3 адсорбция
- •3.1. Основные понятия и определения
- •3.1.1. Количественные способы выражения величины адсорбции
- •3.1.2. Классификации адсорбции
- •1. Классификация по природе границы раздела
- •2. Классификация по типу взаимодействия адсорбата и адсорбента
- •3.1.3. Основные экспериментальные зависимости адсорбции
- •3.2.Адсорбция на границе твердое тело – газ
- •3.2.1. Теория мономолекулярной адсорбции Лэнгмюра
- •3.2.2. Эмпирическое уравнение адсорбции Фрейндлиха
- •3.2.3. Теория полимолекулярной адсорбции Поляни
- •3.2.4. Дальнейшие представления о многослойной адсорбции. Теория бэт
- •3.2.5. Адсорбция на пористых адсорбентах
- •3.2.6.Адсорбенты и их характеристики
- •3.3.Адсорбция на границе жидкость – газ
- •3.3.1. Фундаментальное уравнение адсорбции Гиббса
- •3.3.2. Свойства поверхностно-активных (пав) и поверхностно-инактивных (пив) веществ
- •3.3.3. Строение адсорбционного слоя на границе раствор–газ
- •3.3.4. Уравнение Шишковского
- •3.3.5. Поверхностная активность. Правило Дюкло – Траубе
- •3.3.6. Расчет гиббсовской адсорбции из изотермы поверхностного натяжения методом графического дифференцирования
- •3.3.7.Применение уравнения изотермы Лэнгмюра к адсорбции на границе жидкость–газ. Расчет молекулярных характеристик исследуемого пав
- •3.3.8. Мицеллообразование в растворах коллоидных пав
- •3.3.9. Классификации пав
- •3.3.10. Солюбилизация
- •3.3.11. Практическое значение пав
- •3.3.12. Проблемы биоразлагаемости промышленных пав
- •3.4.Адсорбция на границе твердое тело – раствор
- •3.4.1. Молекулярная адсорбция
- •3.4.2. Ионная адсорбция
- •3.4.3. Ионообменная адсорбция. Ионный обмен
- •Вопросыи задания для самоконтроля
- •Глава 4 электрические свойства дисперсных систем
- •4.1. Электрокинетические явления
- •4.1.1. Механизм образования двойного электрического слоя
- •1. Неравенство электрохимических потенциалов ионов в кристаллической решетке твердого тела и ионов в растворе
- •Адсорбционный механизм образования дэс
- •Механизм поверхностной диссоциации
- •2. Специфическая адсорбции ионов на поверхности твердой фазы
- •3. Ориентированная адсорбция поверхностно-активных веществ
- •4.2. Теории строения двойного электрического слоя
- •4.2.1. Экспериментальные факты, послужившие основой для создания теорий строения дэс
- •4.2.2. Теория строения дэс Гельмгольца – Перрена
- •4.2.3. Теория строения дэс Гуи – Чэпмена
- •4.2.4. Современная теория строения дэс Штерна
- •4.3. Электрокинетический потенциал
- •4.3.1. Определение электрокинетического потенциала из электрокинетических явлений
- •4.3.2. Практическое значение электрокинетических явлений
- •4.4. Строение коллоидных мицелл
- •4.4.1. Примеры мицелл гидрофобных золей в природе
- •Вопросы и задания для самоконтроля
- •Глава 5 устойчивость и коагуляция лиофобных дисперсных систем
- •5.1. Основные понятия и определения
- •5.1.1. Факторы агрегативной устойчивости лиофобных систем
- •5.2. Коагуляция
- •Стадии коагуляции
- •5.2.1. Кинетика коагуляции. Теория кинетики быстрой коагуляции Смолуховского
- •5.2.2. Коагуляция золей электролитами
- •Эмпирические правила электролитной коагуляции
- •5.3. Теория устойчивости лиофобных дисперсных систем длфо
- •5.3.1. Расклинивающее давление
- •Составляющие расклинивающего давления
- •5.3.2. Энергия электростатического отталкивания
- •5.3.3. Энергия молекулярного притяжения
- •5.3.4. Потенциальные кривые взаимодействия частиц
- •5.4. Закономерности коагуляции гидрофобных золей электролитами
- •5.4.1. Особые явления при коагуляции
- •Коагуляция смесью электролитов
- •5.4.2. Примеры коагуляции. Образование почв
- •5.4.3. Физико-химические методы очистки сточных вод
- •Вопросыи задания для самоконтроля
- •Глава 6 структурно-механические свойства дисперсных систем
- •6.1. Типы структур
- •6.2. Реологические свойства дисперсных систем
- •6.2.1. Вязкость жидких дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 7 оптические свойства дисперсных систем
- •7.1. Рассеяние света в дисперсных системах
- •7.2. Поглощение света в дисперсных системах
- •7.3. Окраска дисперсных систем
- •Вопросыи задания для самоконтроля
- •Глава 8 молекулярно-кинетические свойства дисперсных систем
- •8.1. Осмос
- •8.2. Диффузия
- •8.3. Броуновское движение
- •8.4. Седиментационное равновесие
- •8.5. Седиментационный анализ
- •Вопросы и задания для самоконтроля
- •Глава 9 краткая характеристика основных дисперсных систем
- •9.1. Системы с жидкой дисперсионной средой
- •9.1.1. Суспензии и золи
- •Классификация суспензий
- •Получение суспензий
- •Значение суспензий
- •9.1.2. Эмульсии
- •Классификация эмульсий
- •Агрегативная устойчивость эмульсии и природа эмульгатора
- •9.1.3. Пены
- •9.2. Системы с газообразной дисперсионной средой
- •9.2.1. Аэрозоли
- •Классификации аэрозолей
- •Агрегативная устойчивость аэрозолей. Коагуляция
- •Методы разрушения аэрозолей
- •9.3. Системы с твердой дисперсионной средой
- •Вопросыи задания для самоконтроля
- •Перечень используемой литературы
- •Коллоидная химия
- •В авторской редакции
- •Отпечатано в Издательстве тпу в полном соответствии с качеством предоставленного оригинал-макета
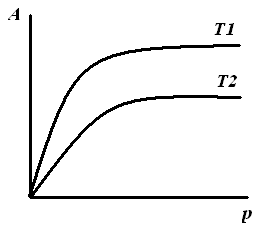
3.1.3. Основные экспериментальные зависимости адсорбции
|
Рис. 3.1. Изотерма адсорбции: Т2 > Т1 А = fT(C), A = fT(p) |
1. Изотерма адсорбции – зависимость адсорбции от равновесного давления или равновесной концентрации при Т = const. С повышением температуры увеличивается десорбция, следовательно, адсорбция уменьшается. |
|
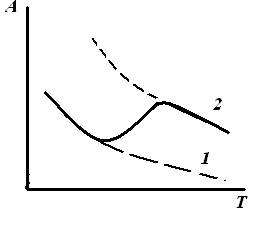
Рис. 3.2. Изобара адсорбции: А = fС(Т), A = fр(Т) |
2. Изобара (изопикта) адсорбции – зависимость адсорбции от температуры при постоянной концентрации или давлении адсорбата (С, р = const): 1 – изобара при физической адсорбции, 2 – при хемосорбции. |
|
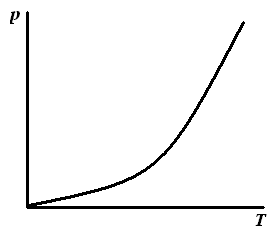
Рис. 3.3. Изостера адсорбции: С = fА(Т), р = fА(Т) |
3. Изостера адсорбции – зависимость концентрации или парциального давления от температуры при постоянной величине адсорбции А = const (расчетная зависимость, позволяющая определить теплоту адсорбции). |
Наиболее распространенной зависимостью, получаемой экспериментально, является изотерма адсорбции, т.к. проще всего обеспечить постоянство температуры.
3.2.Адсорбция на границе твердое тело – газ
В настоящее время не создано общей теории, которая бы достаточно корректно описывала бы все виды адсорбции на различных поверхностях раздела фаз.
Рассмотрим «классические» теории адсорбции, разработанные в начале XX в. Лэнгмюром и Поляни.
3.2.1. Теория мономолекулярной адсорбции Лэнгмюра
Основные положения теории Лэнгмюра
Адсорбция молекул адсорбата происходит на активных центрах, всегда существующих на поверхности адсорбента. Активные центры адсорбента энергетически равноценны.
1. Каждый активный центр может адсорбировать только одну молекулу адсорбата. В результате этого на поверхности адсорбента образуется мономолекулярный слой адсорбата.
2. Адсорбированные молекулы не взаимодействуют друг с другом. Поэтому время пребывания молекул на активных центрах не зависит от того, заняты молекулами соседние активные центры или нет.
3. Адсорбция носит динамический характер. Адсорбат удерживается на поверхности адсорбента некоторое время, а потом десорбируется.
Вывод уравнения Лэнгмюра
Существует несколько вариантов вывода уравнения Лэнгмюра. Рассмотрим кинетический вывод. В основе вывода лежит представление о степени заполнения поверхности адсорбента θ, которая представляет собой отношение величины адсорбции А к величине предельной адсорбции А∞ (А∞ – число адсорбционных центров на единицу поверхности адсорбента – емкость адсорбционного монослоя):
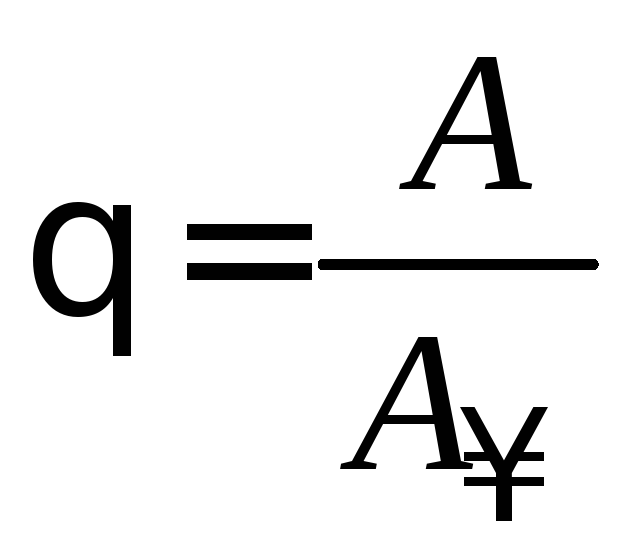 . (3.3)
. (3.3)
Степень заполнения изменяется в пределах от 0 до 1. Если А = 0, то θ = 0, если А = А∞, то θ = 1.
Согласно основным представлениям гетерогенной кинетики, скорость адсорбции, т.е. скорость оседания молекул на поверхность адсорбента будет равна:
![]() , (3.4)
, (3.4)
где
![]() – константа скорости процесса адсорбции;
(
– константа скорости процесса адсорбции;
(![]() )
– доля свободной поверхности адсорбента;р
– давление газа.
)
– доля свободной поверхности адсорбента;р
– давление газа.
Скорость десорбции, т.е. скорость ухода молекул с поверхности адсорбента не зависит от давления газа в объеме, а зависит только от степени заполнения поверхности:
![]() , (3.5)
, (3.5)
где
![]() – константа скорости процесса десорбции;
– константа скорости процесса десорбции;![]() – доля занятой поверхности адсорбента.
– доля занятой поверхности адсорбента.
Со временем скорость адсорбции уменьшается, а скорость десорбции возрастает, т.к. доля занятой поверхности адсорбента увеличивается, а доля свободной поверхности уменьшается. В какой-то момент времени наступает динамическое равновесие, при котором количество адсорбирующихся молекул будет равно количеству молекул, покидающих поверхность, т.е. будет выполняться равенство:
![]() .
.
Подставив
выражение для
![]() и
и![]() ,
получим:
,
получим:
![]() ; (3.6)
; (3.6)
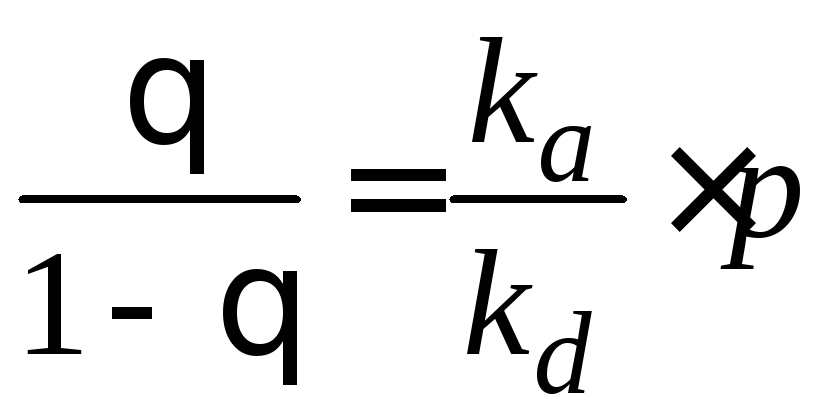 . (3.7)
. (3.7)
Обозначим
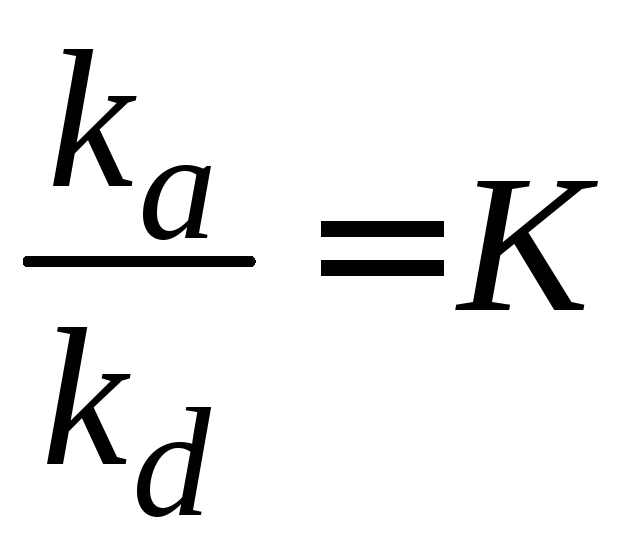 , (3.8)
, (3.8)
где К – константа адсорбционного равновесия, равная отношению константы скорости процесса адсорбции к константе скорости процесса десорбции.
Константа адсорбционного равновесия характеризует адсорбционную активность вещества. Чем больше эта константа, тем сильнее взаимодействие адсорбата с адсорбентом.
Тогда
![]() . (3.9)
. (3.9)
Решим
это уравнение относительно
![]() :
:
![]() ;
;
![]() ,
,
отсюда
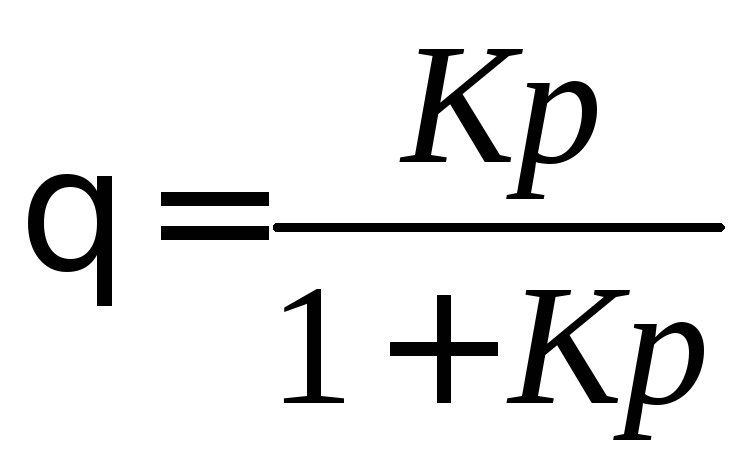 . (3.10)
. (3.10)
Получили уравнение мономолекулярной адсорбции Лэнгмюра, выраженное через долю занятой поверхности (3.10).
Подставим
в уравнение (3.10) значение
![]() из уравнения (3.8). Получимуравнение
мономолекулярной адсорбции Лэнгмюра:
из уравнения (3.8). Получимуравнение
мономолекулярной адсорбции Лэнгмюра:
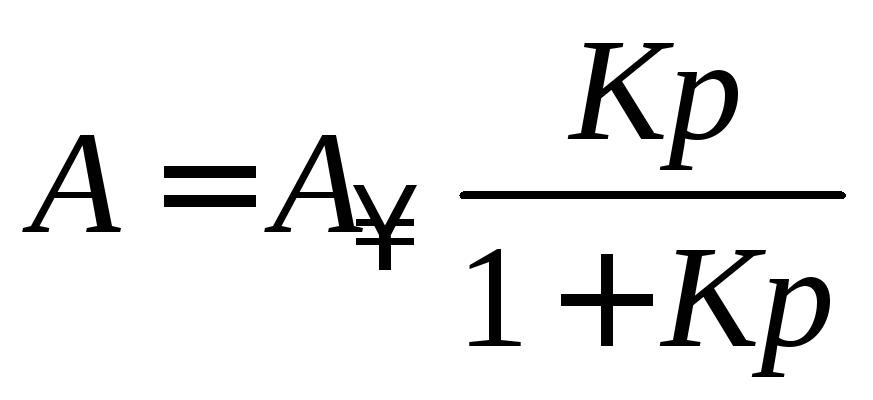 . (3.11)
. (3.11)
Полученное уравнение (3.11) используют для адсорбции газов. Для адсорбции из растворов используют уравнение Лэнгмюра в следующем виде:
![]() ,
(3.12)
,
(3.12)
где С – концентрация адсорбата.
Анализ и применение уравнения изотермы адсорбции Лэнгмюра
Уравнение изотермы адсорбции Лэнгмюра применимо не только для адсорбции газов и паров на твердых адсорбентах, но и для адсорбции на границах газ/жидкость и жидкость/твердое тело.
Константа
адсорбционного равновесия в уравнении
Лэнгмюра (К)
характеризуют энергию взаимодействия
адсорбата и адсорбента (химическое
сродство
![]() ).
Чем сильнее это взаимодействие, тем
больше константа адсорбционного
равновесия:
).
Чем сильнее это взаимодействие, тем
больше константа адсорбционного
равновесия:
![]() . (3.13)
. (3.13)
Константа адсорбционного равновесия тем больше, чем сильнее выражено сродство адсорбата и адсорбента. С повышением температуры константа адсорбционного равновесия уменьшается, т.к. возрастает скорость десорбции.
Величина А∞ зависит от числа адсорбционных центров на единице поверхности или массы адсорбента и от размеров молекул адсорбата. Чем крупнее молекула адсорбата, тем меньше А∞.
Типичная изотерма адсорбции Лэнгмюра показана на рис. 3.4.
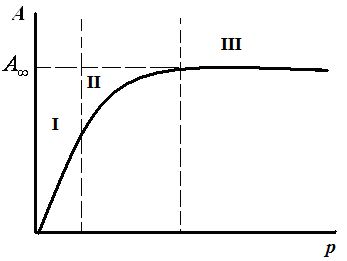
Рис. 3.4. Изотерма мономолекулярной адсорбции Лэнгмюра в координатах А = f(p)
На изотерме адсорбции выделяют три участка:
I – в области малых давлений (р→0, Кр<<1), тогда: А = А∞·Kp, величина адсорбции линейно растет с увеличением концентрации (уравнение Генри).
III – в области больших давлений (Кр>>1), тогда: А = А∞, вся поверхность адсорбента занята молекулами адсорбата.
II – в области средних давлений [уравнение (3.11)].
Расчет констант уравнения Лэнгмюра
Константы (К и А∞) уравнения Лэнгмюра рассчитывают графическим способом. Для этого уравнение (3.11) приводят к линейному виду. Для этого проводят следующие преобразования:
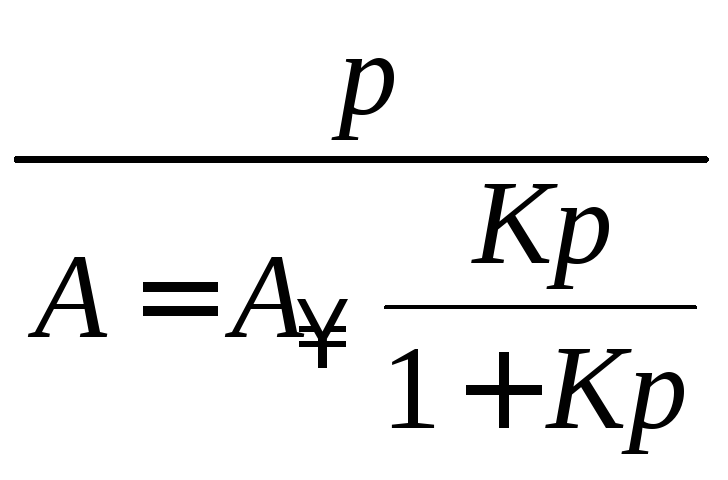 ;
;
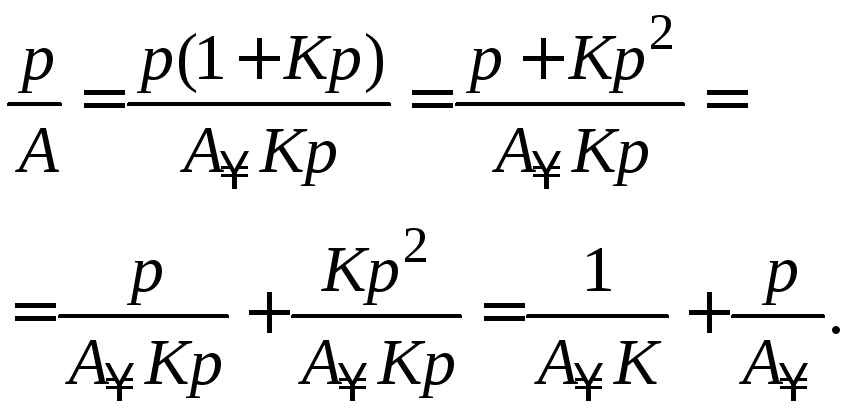
Получают уравнение мономолекулярной адсорбции Лэнгмюра в линейной форме:
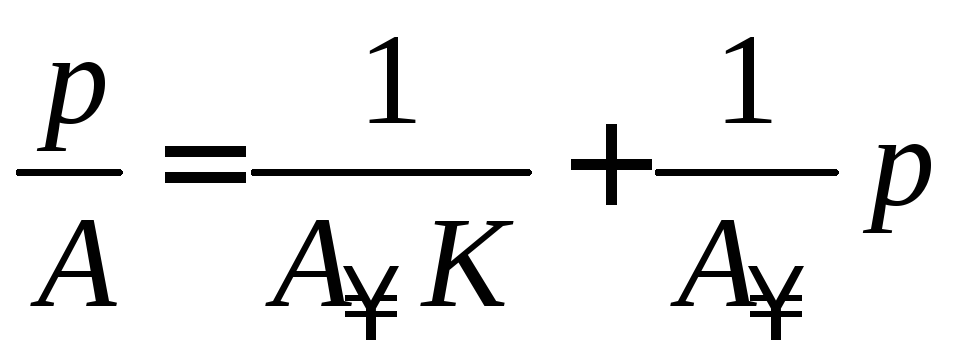 . (3.14)
. (3.14)
Строят изотерму адсорбции в координатах линейной формы уравнения Лэнгмюра (рис. 3.5).
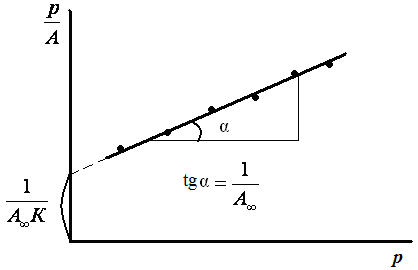
Рис. 3.5. Изотерма адсорбции в координатах линейной формы уравнения Лэнгмюра
Экстраполяция зависимости до оси ординат дает отрезок, равный
![]() .
.
Тангенс угла наклона прямой равен:
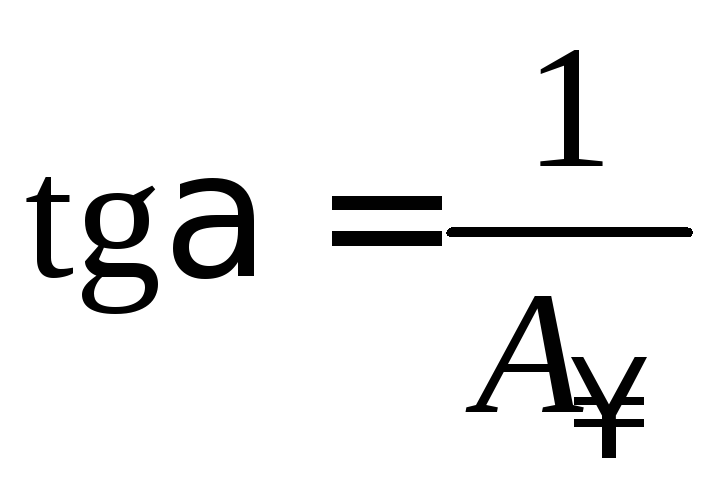 . (3.15)
. (3.15)
Уравнение Лэнгмюра можно использовать только при условии, что адсорбция вещества сопровождается образованием мономолекулярного слоя. Это условие достаточно строго выполняется при хемосорбции, физической адсорбции газов при небольших давлениях и температурах (в отсутствие конденсации у поверхности адсорбента). В большинстве случаев мономолекулярный адсорбционный слой не компенсирует полностью избыточную поверхностную энергию и влияние поверхностных сил может распространяться на последующие адсорбционные слои.
Недостатки уравнения Лэнгмюра
1. Теория не показывает зависимость адсорбции от температуры. По теории Лэнгмюра адсорбция от температуры не зависит, в действительности с увеличением температуры адсорбция уменьшается.
2. По теории Лэнгмюра А∞ = 1, в действительности А∞ = 0,03–0,3 (монослой полностью не образуется).
Представления, развитые Лэнгмюром, в значительной степени идеализируют и упрощают действительную картину адсорбции. На самом деле поверхность большинства адсорбентов энергетически неоднородна, между молекулами адсорбата на поверхности имеют место «боковые» взаимодействия.
Пример 3.1. При изучении адсорбции углекислого газа на активированном угле были получены следующие экспериментальные данные:
|
р·10–2, Н/м2 |
9,9 |
49,7 |
99,8 |
200 |
|
А·103, кг/кг |
32,0 |
70,0 |
91,0 |
102,0 |
Графически определите константы в уравнении Лэнгмюра, пользуясь которыми, постройте изотерму Лэнгмюра.
Решение:
1. Для построения изотермы Лэнгмюра в линейных координатах (3.14) рассчитаем значения р/А для значения р = 9,9·102 Н/м:
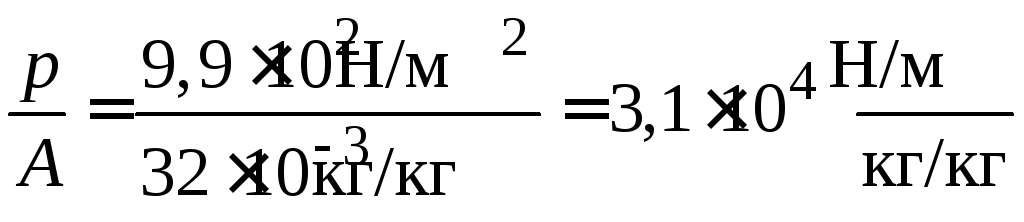 .
.
Аналогично проведем расчет для других значений, полученные данные занесем в таблицу:
|
р·10–2, Н/м2 |
9,9 |
49,7 |
99,8 |
200 |
|
|
3,1 |
7,1 |
10,9 |
19,6 |
2. По полученным значениям строим изотерму адсорбции в координатах линейной формы уравнении Лэнгмюра (рис. 3.6):
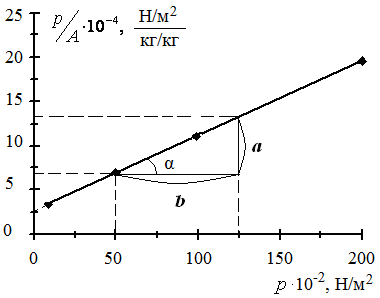
Рис. 3.6. Изотерма адсорбции в координатах линейной формы уравнения Лэнгмюра
3. Графически рассчитываем константы уравнения Лэнгмюра:
 ;
;
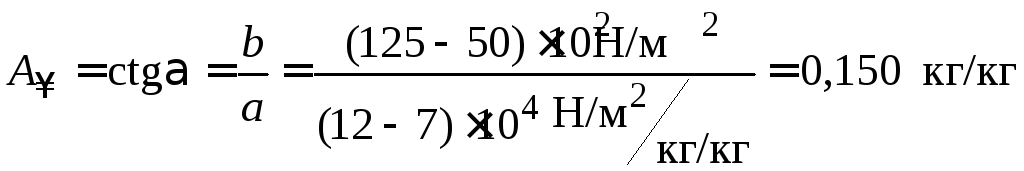 ;
;
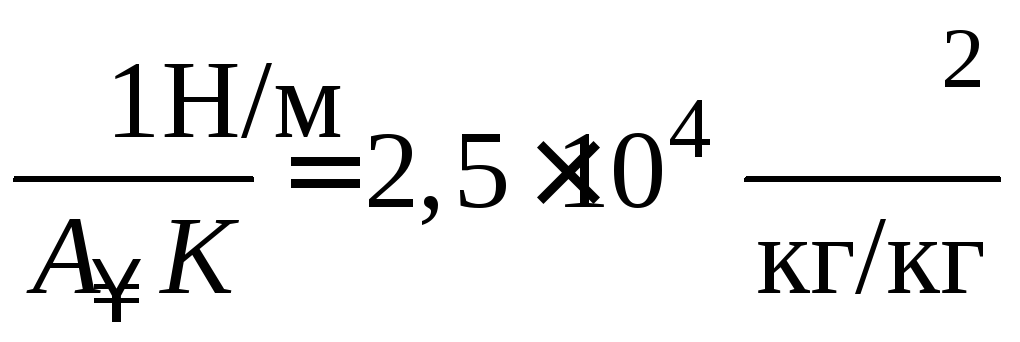 ;
;
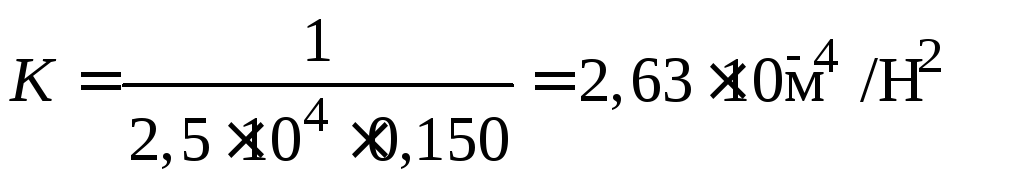 .
.
4. Используя рассчитанные значения констант уравнения Лэнгмюра, вычисляем величину адсорбции по уравнению (3.11) для значения р = 9,9·102 Н/м:
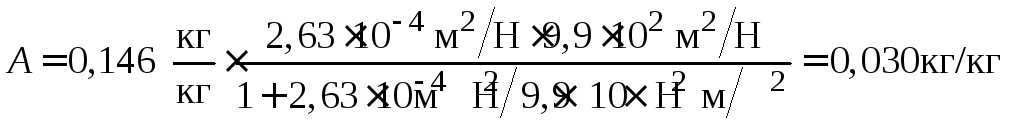 .
.
Аналогично проведем расчет для других значений р, полученные данные занесем в таблицу:
|
р·10–2, Н/м2 |
9,9 |
49,7 |
99,8 |
200 |
|
А, кг/кг |
0,030 |
0,083 |
0,106 |
0,123 |
5. Строим изотермы адсорбции (рис. 3.7): 1 – исходные значения; 2 – рассчитанные по уравнению Лэнгмюра.
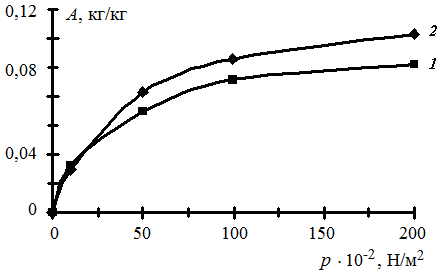
Рис. 3.7. Изотерма мономолекулярной адсорбции Лэнгмюра
Рассчитанная по уравнению (3.11) изотерма адсорбции Лэнгмюра (кривая 2, рис. 3.7) не совпадает с изотермой адсорбции, построенной по экспериментальным значениям (кривая 1, рис. 3.7) в области средних и высоких давлений. Следовательно, для описания процесса адсорбции углекислого газа на активированном угле в данном случае можно использовать уравнение Лэнгмюра только в области низких давлений.