
- •Раздел I. Методические указания и контрольные работы…………… 7
- •Раздел II.Самостоятельная работа студентов в период лабораторно-
- •РАздел I. Методические указания и контрольные работы по биологической химии
- •Распределение материала по контрольным работам Контрольная работа №1
- •Контрольная работа №2
- •Контрольная работа №3
- •Литература Основная:
- •1.Обмен руклеопротеинов
- •2.Обмен хромопротеинов
- •1.Введение в фармацевтическую биохимию. Микросомальное окисление
- •2.Конъюгация ксенобиотиков
- •Распределение вопросов контрольных работ по вариантам
- •Раздел II. Самостоятельная работа студентов в период лабораторНо – экзаменационной сессИи Модуль 1. Белки. Ферменты. Цель занятия:
- •План занятия
- •1.1. Белки
- •1.2. Ферменты
- •1.1. Дан трипептид гли – ала – вал
- •Примеры тестов для контроля исходного уровня знаний по теме «Ферменты»
- •Примеры ситуационных задач по теме «Белки»
- •Работа № 2. Количественное определение белка сыворотки крови биуретовым методом.
- •Фотоэлектроколориметр
- •Работа №3. Высаливание белков сыворотки крови сернокислым аммонием
- •Эталоны ответов к тестовым заданиям по теме «Белки»
- •План занятия
- •1.1. Наиболее токсичен при гипервитаминозе…
- •1.2Витамина в12 …
- •2.1.Фермент – кофермент – функция.
- •2.2. Витамин – антивитамин
- •1.3.Минуя стадию образования пирувата, в ацетил-КоА превращаются…
- •3.1. В состав пируватдегидрогеназного комплекса входят…
- •3.2. Примерами субстратного фосфорилирования являются реакции
- •3.3. Скорость окисления ацетата в цтк снижают…
- •2.1. Анилиновая проба на витамин д.
- •2.2. Реакция с серной кислотой.
- •5.1. Реакция с гидросульфитом натрия.
- •5.2. Реакция с раствором уксусно-кислой меди.
- •1. Обмен углеводов. Сахар крови. Регуляция сахара крови
- •1.1. В пентозный путь катаболизма вовлекается сразу … молекул глюкозо-6-фосфата
- •1.1. Ферменты, участвующие в расщеплении жиров в желудочно-кишечном тракте относятся к классу …
- •Эталоны ответов на ситуационные задачи по теме «Обмен углеводов» Задача 1.
- •1.1 Серотонин синтезируется из…
- •2.2 Установление соответствия:
- •Задача 1.
- •Эталоны ответов на ситуационные задачи Задача 1.
- •1.3 Развитие метгемоглобинемии может быть обусловлено:
- •3.2. В реакциях инактивации активных форм кислорода участвуют:
- •3.3. В основе детоксикации ядовитых веществ в печени лежат процессы:
- •Задача 1.
- •1. Реакция с хлорным железом.
- •2. Реакция с йодатом калия.
- •Ответы на ситуационные задачи
- •Контрольные вопросы
- •1.2. Первая фаза биотрансформации включает все перечисленные реакции,
- •1.3. Биотрансформация сульфаниламидов осуществляется с участием:
- •2.2. Установление локализации реакции биотрансформации:
- •3.2. Фармацевтическая биохимия изучает:
- •Примеры ситуационных задач
- •Задача 2
- •Некоторые биохимические показатели жидких сред организма
1.2. Первая фаза биотрансформации включает все перечисленные реакции,
кроме:
А-гидролиза Г- восстановления
Б-деалкилирования Д- окисления
В-коньюгации
1.3. Биотрансформация сульфаниламидов осуществляется с участием:
1-ацил-N-глицинтрансферазы
2-глутатион-S-трансферазы
3-аминооксидазы
4-ариламин-N-ацетилтрансферазы
Вид 2. 2.1 Установление соответствия:
реакция: фаза биотрансформации:
1. амфетамин → фенилацетон А-фаза модификации
2. тирамин → n-оксифенилацетальдегид Б-фаза коньюгации
+ Ац - КоА
3. изониазид ―――→ ацетилизониазид
½ О2 ; - Н2 S
4. паратион ―――→ параоксон
АТФ1
5. бензойная ―――→ гиппуровая кислота
кислота глицин
2.2. Установление локализации реакции биотрансформации:
1. окислительное дезаминирование А. наружная мембрана митохондрий.
амфетамина. Б. цитозоль
2. окисление метанола в формальдегид. В. эндоплазматический ретикул
3. окислительное дезаминирование Г. пероксисомы
гистамина
4. этанол + Н2 О2 ―→ ацетальдегид + +Н2О2
каталаза
азовосста-
5. Пронтозил ―――→ сульфаниламид
новление
Вид 3. 3.1. Липосомальные лекарственные формы проникают в клетку путем:
1) простой диффузии 3) активного транспорта
2) облегченной диффузии 4) эндоцитоза
3.2. Фармацевтическая биохимия изучает:
1) молекулярные механизмы действия гормонов
2) биохимические основы технологии лекарственных форм
3) механизмы действия ферментов
4) генно-инженерную биотехнологию лекарственных форм
Вид 4. Определите правильность утверждений в предложении и установите
наличие причинной связи между ними. Утверждения разделены союзом
«потому что»
1. При лечении фенобарбиталом возникает феномен привыкания к нему, потому что фенобарбитал является индуктором цитохрома Р450.
2. Метилхолантрен является канцерогенным веществом, потому что метилхолантрен индуцирует цитохром Р448.
3. Все ксенобиотики в организме обязательно подвергаются структурной модификации, потому что без этапа модификации невозможен этап конъюгации.
Примеры ситуационных задач
Задача 1.
При лечении хронического алкоголизма применяют тетурам, в результате чего происходит накопление в организме уксусного альдегида.
А.Напишите схему метаболизма этанола до стадии образования уксусной кислоты.
Б.Какой фермент ингибируется при лечении тетурамом?
Задача 2.
Изониазид С5NH4CO—NH—NH2 – препарат, применяемый при лечении туберкулеза легких, подвергаетя гидолизу или ацетилированию.
А. Напишите продукты гидролиза или ацетилирования изониазида.
Б.Одним из осложнений лечением изониазидом является возникновение
пеллагры.Синтез какого кофермента нарушается при этом без соблю-
дения профилактических мер?
Самостоятельная работа студентов
Кратко выпишите принцип метода, химизм реакций и порядок проведения работ, выполняемых на лабораторном занятии, не забывая оставлять места для выводов.
Работа 1.Определение активности монооксигеназ эндоплазматической сети клеток печени по выделению метаболитов амидопирина с мочой.
Метаболизм амидопирина состоит из 2-х фаз:
1. Окисление его монооксигеназной системой эндоплазматической сети печени:
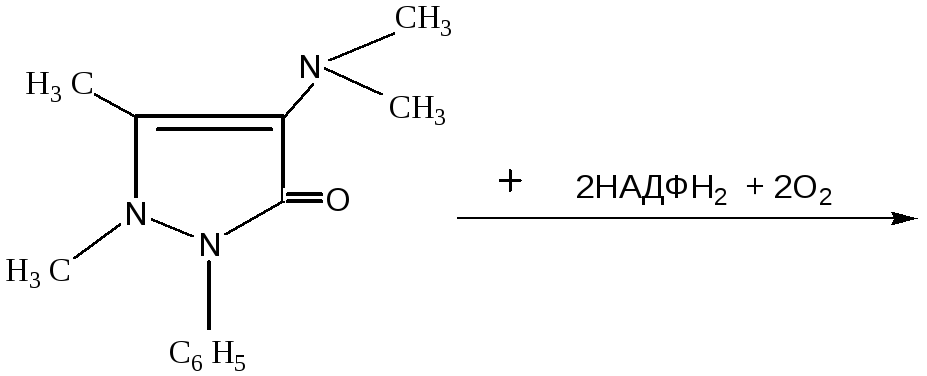
Амидопирин
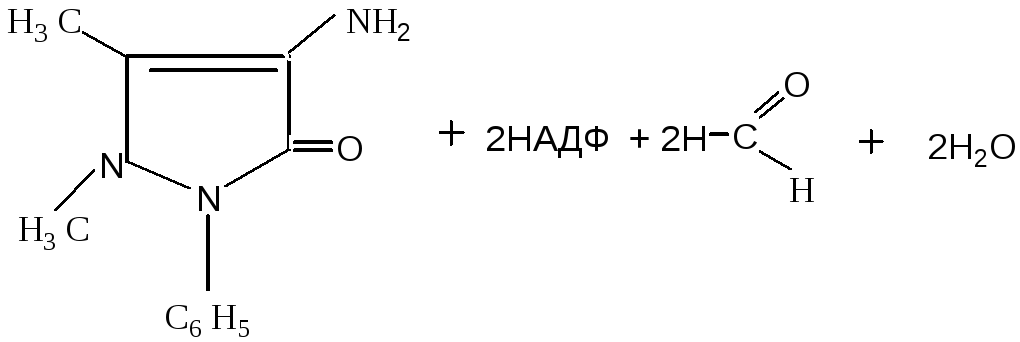
4-аминоантипирин (4-АП)
2. Коньюгация: 4-аминоантипирин подвергается ацетилированию:
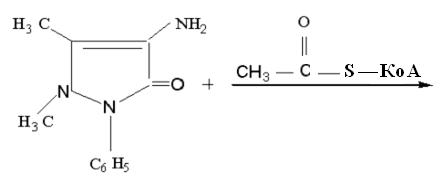
4-аминоантипирин
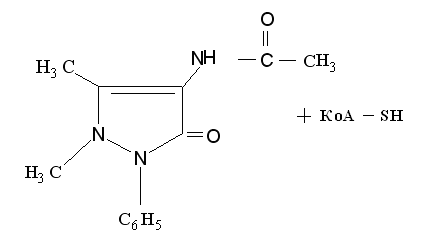
4-N-ацетиламиноантипирин
Метод основан на способности 4-аминоантипирина (4-АП) - метаболита амидопирина, при взаимодействии с фенолом в щелочной среде в присутствии гексацианоферрата (Ш) калия образовывать соединение типа индофенола, имеющее розовую окраску.
Ход определения. В 2 пробирки (1-я для определения свободного 4-АП; 2-я для определения суммы метаболитов (4-АП + его коньюгат) вносят по 1,5 мл профильтрованной мочи.
В 1-ю пробирку приливают 0,3 мл аммиачного буфера, а во 2-ю - 0,3 мл концентрированной соляной кислоты. Перемешивают пробы, осторожно встряхивая пробирки.
Содержимое 1-й пробирки через 15 минут фильтруют через стеклянный фильтр. 2-ю пробирку закрывают пробкой, обернутой фольгой, помещают на 15 минут в кипящую водяную баню, затем охлаждают водой. Гидролизат фильтруют в другую пробирку. Затем прибавляют 0,6 мл аммиачного буфера, перемешивают и вновь профильтровывают. Из первой пробы отбирают 0,6 мл фильтрата в чистую пробирку и добавляют 0,5 мл раствора ТХУ, 2 мл раствора фенола и 0,1 мл р-ра К3 [Fe(CN)6 ]. Перемешивают и через 10 мин. фотометрируют при зеленом светофильтре в кювете с толщиной слоя 1см против контроля, содержащего все компоненты, кроме фенола, который заменяется на 2 мл Н2 О. Полученная экстинция Е1 соответствует содержанию в моче 4-АП. 2-я проба: отбирают 0,8 мл фильтрата, добавляют 0,2 мл Н2О, 2 мл раствора фенола, 0,1 мл раствора К3 [Fe(CN)6 ], перемешивают и измеряют Е2 (содержание в моче 4-АП + его коньюгат).
По калибровочному графику находят:
1) общее количество 4-аминоантипирина (по Е1), умножая содержание его в пробе (мкг/мл) на суточный объем мочи в мл;
2) по Е2 аналогичным образом определяют сумму метаболитов амидопирина, выделенных за сутки с мочой.
Относительную активность монооксигеназы печени рассчитывают в % от
введенного амидопирина:
А х 100% А – сумма метаболитов, выделенных за сутки
Х1 = ------------------, В – количество введенного амидопирина
В
Ацетилирующую активность ферментных систем организма (в %) находят по формуле:
(Е2-Е1) 100%
Х2 = ------------------,
Е2
Работа 2. Определение активности алкогольдегидрогеназы
в сыворотке крови.
Метод основан на способности алкогольдегидрогеназы (АДГ) катализировать две последовательные реакции: НАД-зависимое окисление бутанола и восстановление п-нитрозодиметиланилина с участием НАД Н2 , образовавшимся в ходе первой реакции. При этом п-нитрозодиметиланилин, имеющий в растворе интенсивно желтую окраску, обесцвечивается. Об активности АДГ судят по скорости светопоглощения красителя, которое регистрируют на спектрометре при 440 нм.
Ход определения. Спектрофотометр подготавливают к работе, устанавливают рабочую длину волны на 440 нм и стрелку шкалы отсчета с помощью рукоятки на «нуль» при закрытой шторке.
В кювету спектрофотометра помещают 2 мл раствора п-нитрозодиме-тиланилина и 0,5 мл сыворотки крови. Против этой кюветы рукояткой «щель» устанавливают шкалу отсчета на 0,300, после чего реакцию запускают добавлением в кювету 0,1 мл раствора НАД в растворе бутанола. Смесь
быстро перемешивают стеклянной палочкой. Регистрируют снижение экстинкции инкубационной среды в течение 2 мин при 25oC.
Примечание. Определение активности АДГ в каждом образце сыворотки проводят дважды, а при расхождении результатов измерения более чем на 10% - три раза. После этого вычисляют среднее значение изменения экстинкции за 1 мин.
Расчет производится по формуле:
х = 320,5 · ∆ Е,
где х – активность АДГ, мкмоль/(мин · л); 320,5 – коэффициент расчета активности, выраженный в мкмолях превращенного субстрата при указанных условиях инкубации; ∆ Е – изменение экстинкции при 440 нм за 1 мин.
Если изменение экстинкции при 440 нм превышает 0,050 за 1 мин, то сыворотку крови следует развести натрий-фосфатным буфером в 2-4 раза. Измеренную величину активности умножить на фактор разведения.
Для определения активности АДГ рекомендуется брать свежеполученную сыворотку крови. При хранении активность фермента снижается, поэтому значение активности измеренной после хранения, следует умножить на
соответствующий коэффициент, установленный эмпирически:
|
Коэффициент |
Время хранения сыворотки, сут | |||||||
|
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 | |
|
при 4o С |
1,00 |
1,03 |
1,04 |
1,09 |
1,11 |
1,12 |
1,15 |
1,17 |
|
при 20o С |
1,00 |
1,18 |
1,20 |
1,43 |
1,47 |
1,54 |
1,66 |
2,38 |
Сравнить полученное значение активности АДГ с нормой и сделать соответствующие выводы.
Алкогольдегидрогеназа не проявляет абсолютной субстратной специфичности. Этот фермент катализирует окисление, помимо этанола, ряда первичных и вторичных спиртов, этиленгликоля и т.д., причем в некоторых случаях с большей скоростью, чем этанола. АДГ содержится в гиалоплазме клеток многих органов и тканей, но в ткани печени ее активность в 20-40-раз выше, чем в других. В сыворотке крови концентрация фермента у здоровых людей очень низка и традиционными методами практически не выявляется. Описанный метод позволяет определить активность АДГ.
У здоровых людей активность АДГ в сыворотке крови регистрируется в пределах 0,32-2,56, а в среднем 1,18 мкмоль/(мин·л). У лиц, злоупотребляющих алкоголем, активность фермента в сыворотке крови повышается в зависимости от длительности приема алкоголя и стадии алкоголизма. Тест на алкогольдегидрогеназу сыворотки крови используется и диагностике алкоголизма и контроля эффективности лечения этого заболевания.
Низкая активность АДГ при поражениях печени, в которой окисляется до 90% поступающего в организм этанола и других спиртов, или генетическая недостаточность этого фермента снижает обезвреживание алкоголя и усугубляет его отрицательное действие на функции систем организма.
Работа 3. Определение ацетилирующей способности организма по
выделению с мочой свободной и ацетилированной форм сульфаниламидов
Процесс ацетилирования является одной из разновидностей реакций конъюгации ксенобиотиков, происходящих в клетках с участием ферментов. Ариламины, в том числе сульфаниламиды, подвергаются N-ацетилированию в организме и поэтому по выделению свободной и ацетилированиой форм этих веществ можно оценить активность процесса ацетилирования.
Принцип метода. Метод основан на способности диазотированного сулфаниламида при взаимодействии с ацетилированной Н-кислотой в (1,6-аминооксинафталин-3,5-дисульфокислота) образовывать комплекс розового цвета, интенсивность которого пропорциональна концентрации сульфани
ламида. Содержание суммы сульфаниламидов (ацетилированных и свободных) в моче устанавливают после гидролиза проб с соляной кислотой, в ходе которого происходит образование свободной формы сульфаниламида из ацетилированной.
Ход определения. В две пробирки (одна для определения общего, а другая — свободного сульфадимезина) отмеривают по 1 мл разведенной в 20 раз мочи, по 1,5 мл дистиллированной воды и по 0,25 мл раствора соляной кислоты. В третью пробирку (контрольную) вносят 2,5 мл воды и 0,25 мл раствора соляной кислоты.
Одну пробирку (для определения общего сульфадимезина) закрывают пробкой, обернутой фольгой, и ставят на гидролиз в кипящую водяную баню на 15 мин. Затем пробирку охлаждают.
Во все три пробирки приливают по 2 капли раствора нитрита натрия, тщательно перемешивают содержимое и оставляют стоять 10 мин. Добавляют во все пробы по 1,5 мл насыщенного раствора ацетата натрия, закрывают пробирки пробками и энергично встряхивают их несколько раз.
Прибавляют во все пробирки по 0,25 мл раствора ацетилированной Н-кислоты. Вновь перемешивают содержимое и оставляют стоять пробы на 15 мин для развития окрашивания.
Измеряют экстинкцию опытных проб против контроля на ФЭКе при 440 нм (светофильтр синий) в кювете с толщиной слоя 0,5 см.
Расчет проводят по формуле:
(Е2 – Е1) ·100
Х = -------------------------
Е2
где х — ацетилирующая способность организма, % ацетилированного сульфадемизина; Е1 – экстинкция свободного сульфадимезина, содержащего в пробе, не подвергавшейся гидролизу; Е2 – экстинкция общего сульфадимезина (свободный + ацетилированный), содержащийся в пробе, подвергнутый гидролизу.
Занести значения экстинкции в тетрадь и рассчитать ацетилирующую способность организма по сульфадимезину. Сделать вывод о возможности метаболизма ксенобиотиков посредством ацетилирования и значении этого процесса.
По степени ацетилирования сульфаниламидов или других ксенобиотиков, подвергающихся в организме ацетилированию, судят об активности ферментной системы ариламинацетилтрансферазы в клетках, которая катализирует реакции ацетилирования (конъюгации) различных соединений. Для сульфаниламидов реакция ацетилирования является основным ведущим ме
ханизмом конъюгации, другие конъюганты для большинства сульфаниламидов образуются в незначительном количестве. Ацетилирование приводит к анактивации (обезвреживанию) сульфаниламидов и выведению их из организма с мочой. Поэтому степень ацетилирования сульфаниламидов указывает также на соотношение бактериостатически активной и неактивной форм препаратов. Чем быстрее ацетилируется сульфаниламид, тем меньше его бактриостатическая активность.
Работа 4. Выявление ацетилирования (инактивации) гидразида
изоникотиновой кислоты (ГИНК) в организме.
Принцип метода. Метод основан на выявлении свободной формы ГИНК, которая с метаванадатом аммония в кислой среде дает комплексное соединение коричнево-красного цвета. Разница в окраске между пробами мочи до и после гидролиза указывает на степень ацетилированпя ГИНК в организме:
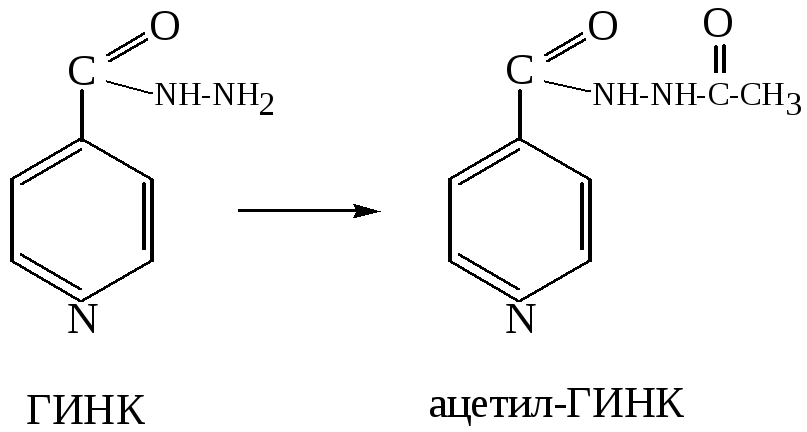
Ход определения. Собранную мочу разводят в 20 раз дистиллированной водой. В две пробирки вносят по 1 мл разведенной мочи; в одну из них (для определения общей ГИНК, т. е. суммы свободной и ацетилированной форм препарата) добавляют 1 мл раствора соляной кислоты, а во вторую (для выявления свободной ГИНК) — 1 мл дистиллированной воды.
Первую пробирку закрывают пробкой и ставят на 20 мин на кипящую водяную баню, после чего охлаждают под струей водопроводной воды. В обе пробирки приливают по 2 мл реактива метаванадата аммония и отмечают разницу в окрашивании исследуемых проб мочи.
Реакция N-ацетилирования ГИНК осуществляется специальной ацетилтрансферазой, содержащейся в различных тканях организма. В зависимости от активности этого фермента у разных людей их делят на быстрых и медленных «инактиваторов» (ацетиляторов) ГИНК, что имеет значение не только для практической фармакогенетики, но и для рациональной терапии. По степени ацетилирования ГИНК устанавливается эффективная индивидуальная доза препарата для конкретного больного.
Работа 5. Проба Квика—Пытеля.
Принцип метода. Проба основана на том, что ароматические соединения окисляются в организме до бензойной кислоты, которая в печени путем соединения с гликоколом переходит в гиппуровую кислоту. По количеству выделившейся гиппуровой кислоты после нагрузки бензойнокислым натрием судят о функции печени. Данную пробу применяют только в тех случаях, когда нет изменений функции почек.
При проведении пробы Квика на белых крысах животным подкожно в паховую область вводят 3 мл 5% -раствора бензойнокислого натрия в физиологическом растворе и 80,1 мг гликокола, растворенного в 3 мл 0,9% раствора хлористого натрия. Затем их помещают в обменные клетки на 18 часов; в течение которых собирают мочу.
В мочу крысы добавляют сернокислый аммоний (0,5 г на 1,0 мл), после растворения которого мочу отфильтровывают. На фильтре обычно остается осадок. В отфильтрованную мочу добавляют крепкую соляную кислоту (1-2 мл) до покраснения красной бумаги Конго. Пробу оставляют стоять для выпадения осадка не менее 2-х часов.
Для определения содержания гиппуровой кислоты титрованием осадок, промытый на фильтре до нейтральной реакции промывных вод, слегка подсушивают, чтобы его удобнее было снять с фильтра. Можно и сразу смыть из промывалки осадок с фильтра в химический стакан, на котором нанесена метка 100 мл. До этой метки наливают воду и доводят почти до кипения. Гиппуровая кислота при этом растворяется. Для титрования берут точно 10 мл и титруют 0,5 н. раствором едкого натра в присутствии фенолфталеина до розовой окраски.
Расчет. При определении количества гиппуровой кислоты методом титрования расчет количества выделившейся гиппуровой кислоты производят следующим образом. Например: объем мочи составляет 10 мл. На титрование 5 мл пошло 1,16 мл раствора NaOH: 1 мл 0,5 н раствора NaOH соответствует 0,0895 г гиппуровой кислоты, отсюда 1,16 мл х 0,0895= 0,104 г гиппуровой кислоты.
В норме у человека выделяется за сутки 2,8-3,0 г гиппуровой кислоты.
Ответы на тесты контроля исходного уровня знаний
Вид 1: 1-А. 2-В. 3 – 4. 4-Д.
Вид2: 2. 1-А,2-А,3-Б,4-А,5-Б. 2.2:1-В,2-Б,3-А,4-Г.
Вид 3: 1- 1,3; 2 - 4 .
Вид4 :1-В; 2-Д; 3-Е.
Ответы на ситуационные задачи
Задача 1
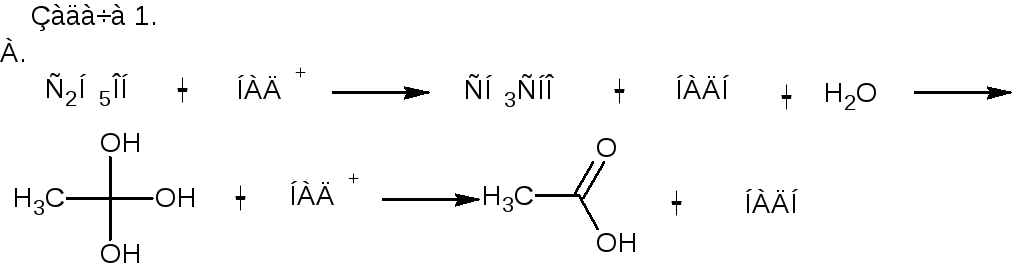
Б. Ацетальдегиддегидрогеназа.
