
- •Раздел I. Методические указания и контрольные работы…………… 7
- •Раздел II.Самостоятельная работа студентов в период лабораторно-
- •РАздел I. Методические указания и контрольные работы по биологической химии
- •Распределение материала по контрольным работам Контрольная работа №1
- •Контрольная работа №2
- •Контрольная работа №3
- •Литература Основная:
- •1.Обмен руклеопротеинов
- •2.Обмен хромопротеинов
- •1.Введение в фармацевтическую биохимию. Микросомальное окисление
- •2.Конъюгация ксенобиотиков
- •Распределение вопросов контрольных работ по вариантам
- •Раздел II. Самостоятельная работа студентов в период лабораторНо – экзаменационной сессИи Модуль 1. Белки. Ферменты. Цель занятия:
- •План занятия
- •1.1. Белки
- •1.2. Ферменты
- •1.1. Дан трипептид гли – ала – вал
- •Примеры тестов для контроля исходного уровня знаний по теме «Ферменты»
- •Примеры ситуационных задач по теме «Белки»
- •Работа № 2. Количественное определение белка сыворотки крови биуретовым методом.
- •Фотоэлектроколориметр
- •Работа №3. Высаливание белков сыворотки крови сернокислым аммонием
- •Эталоны ответов к тестовым заданиям по теме «Белки»
- •План занятия
- •1.1. Наиболее токсичен при гипервитаминозе…
- •1.2Витамина в12 …
- •2.1.Фермент – кофермент – функция.
- •2.2. Витамин – антивитамин
- •1.3.Минуя стадию образования пирувата, в ацетил-КоА превращаются…
- •3.1. В состав пируватдегидрогеназного комплекса входят…
- •3.2. Примерами субстратного фосфорилирования являются реакции
- •3.3. Скорость окисления ацетата в цтк снижают…
- •2.1. Анилиновая проба на витамин д.
- •2.2. Реакция с серной кислотой.
- •5.1. Реакция с гидросульфитом натрия.
- •5.2. Реакция с раствором уксусно-кислой меди.
- •1. Обмен углеводов. Сахар крови. Регуляция сахара крови
- •1.1. В пентозный путь катаболизма вовлекается сразу … молекул глюкозо-6-фосфата
- •1.1. Ферменты, участвующие в расщеплении жиров в желудочно-кишечном тракте относятся к классу …
- •Эталоны ответов на ситуационные задачи по теме «Обмен углеводов» Задача 1.
- •1.1 Серотонин синтезируется из…
- •2.2 Установление соответствия:
- •Задача 1.
- •Эталоны ответов на ситуационные задачи Задача 1.
- •1.3 Развитие метгемоглобинемии может быть обусловлено:
- •3.2. В реакциях инактивации активных форм кислорода участвуют:
- •3.3. В основе детоксикации ядовитых веществ в печени лежат процессы:
- •Задача 1.
- •1. Реакция с хлорным железом.
- •2. Реакция с йодатом калия.
- •Ответы на ситуационные задачи
- •Контрольные вопросы
- •1.2. Первая фаза биотрансформации включает все перечисленные реакции,
- •1.3. Биотрансформация сульфаниламидов осуществляется с участием:
- •2.2. Установление локализации реакции биотрансформации:
- •3.2. Фармацевтическая биохимия изучает:
- •Примеры ситуационных задач
- •Задача 2
- •Некоторые биохимические показатели жидких сред организма
Эталоны ответов на ситуационные задачи по теме «Обмен углеводов» Задача 1.
Эффект Пастера объясняется гораздо меньшей эффективностью анаэробного распада глюкозы - гликолиза, который в анаэробных условиях является единственным источником АТФ. Энергетический выход гликолиза составляет всего 2 моля АТФ на моль глюкозы, тогда как аэробное окисление даст 36 молекул АТФ на 1 молекулу глюкозы. Таким образом, в анаэробных условиях больше глюкозы должно окислятся, чтобы обеспечить энергетические потребности клеток.
Задача 2.
Примерно 90% принятого алкоголя метаболизируется в печени НАД – зависимым ферментом алкогольдегидрогеназой:
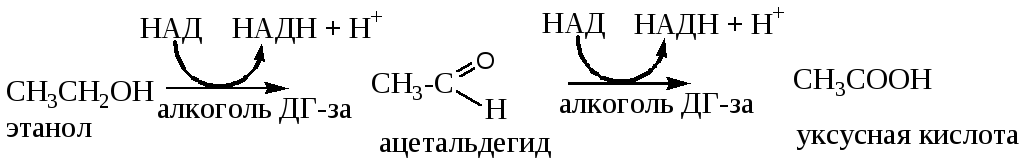
Для окисления 125 г этилового спирта требуется столько же НАД+, сколько и для окисления 500 г глюкозы, поэтому, после приема алкоголя соотношение [ НАД+]/ [НАДН+ Н+] резко снижается вследствие значительного увеличения концентрации восстановленной формы кофермента. Это ведет к смещению лактатдегидрогеназной реакции в сторону образования лактата:
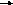
 пируват
+ НАД лактат +НАД +
пируват
+ НАД лактат +НАД +
Пируват – один из главных субстратов глюконеогенеза, поэтому снижение его концентрации резко замедляет скорость синтеза глюкозы, что является причиной гипогликемии.
Задача 3.
В ткани печени фруктоза «вливается» в гликолиз на уровне триозофосфатов:
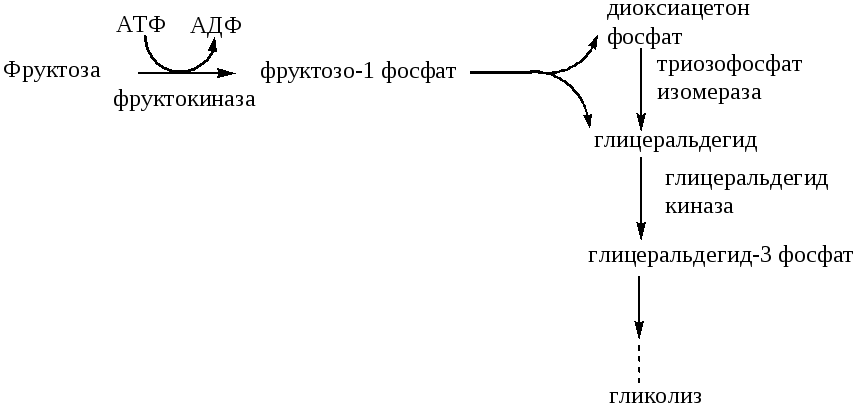
Таким образом, фруктоза «обходит» 2 регуляторные, медленные реакции гликолиза - гексокиназную и фруктокиназную, поэтому окисляется значительно быстрее. Равная скорость выведения фруктозы у больных сахарным диабетом и здоровых объясняется тем, что транспорт фруктозы в клетки не зависит от инсулина. Инсулин также не влияет на активность фруктокиназы, «запускающей» метаболизм фруктозы.
Эталоны ответов к ситуационным задачам по теме «Обмен липидов»
Задача 1.
Панкреатическая липаза активна в пределах рН от 6-8. Бикарбонаты способствуют нейтрализации кислотной пищевой кашицы, поступающей из желудка в тонкий кишечник. Кроме того, смещение рН в щелочную сторону способствует ионизации желчных кислот, а следовательно усиливает их амфифильность и эмульгирующие свойства.
Задача 2.
Митохондриальный фермент ацил- КоА-дегидрогеназа запускает процесс β-окисления жирных кислот:
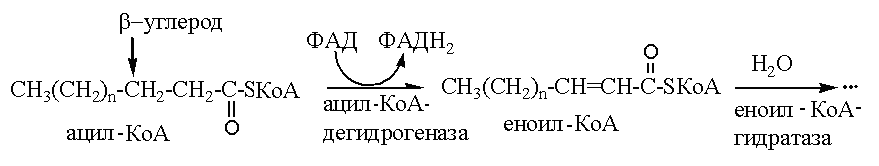
Поэтому у больных с наследственным дефектом ацил- КоА- дегидрогеназы процесс β-окисления жирных кислот нарушен. Снижение утилизации жирных кислот - основного источника энергии при голодании – ведет к повышенному использованию глюкозы. Вследствие этого у таких больных быстро развивается гипогликемия. Снижение синтеза кетоновых тел объясняется уменьшением концентрации ацил-КоА - конечного продукта β- окисления и исходного продукта для синтеза кетоновых тел.
Задача 3.
В плазме крови испытуемого А наиболее значительно будет увеличено содержание ЛПОНП – частиц, ответственные за транспорт эндогенных, т.е. синтезированных in vivo липидов (главным образом триацилглицеринов) из печени в периферические ткани. Большая доза принятых углеводов (почти соответствующая суточной потребности – 400 г) будет активно включаться в липогенез. Образующиеся в ткани печени триглицериды разносятся в эктрагепатические ткани в составе ЛПОНП. В плазме крови испытуемого Б будет так же увеличена концентрация ЛПОНП (по тем же причинам), а также концентрация хиломикронов, т.к. последние ответственны за транспорт экзогенных, т.е. принятых с пищей триглицеридов.
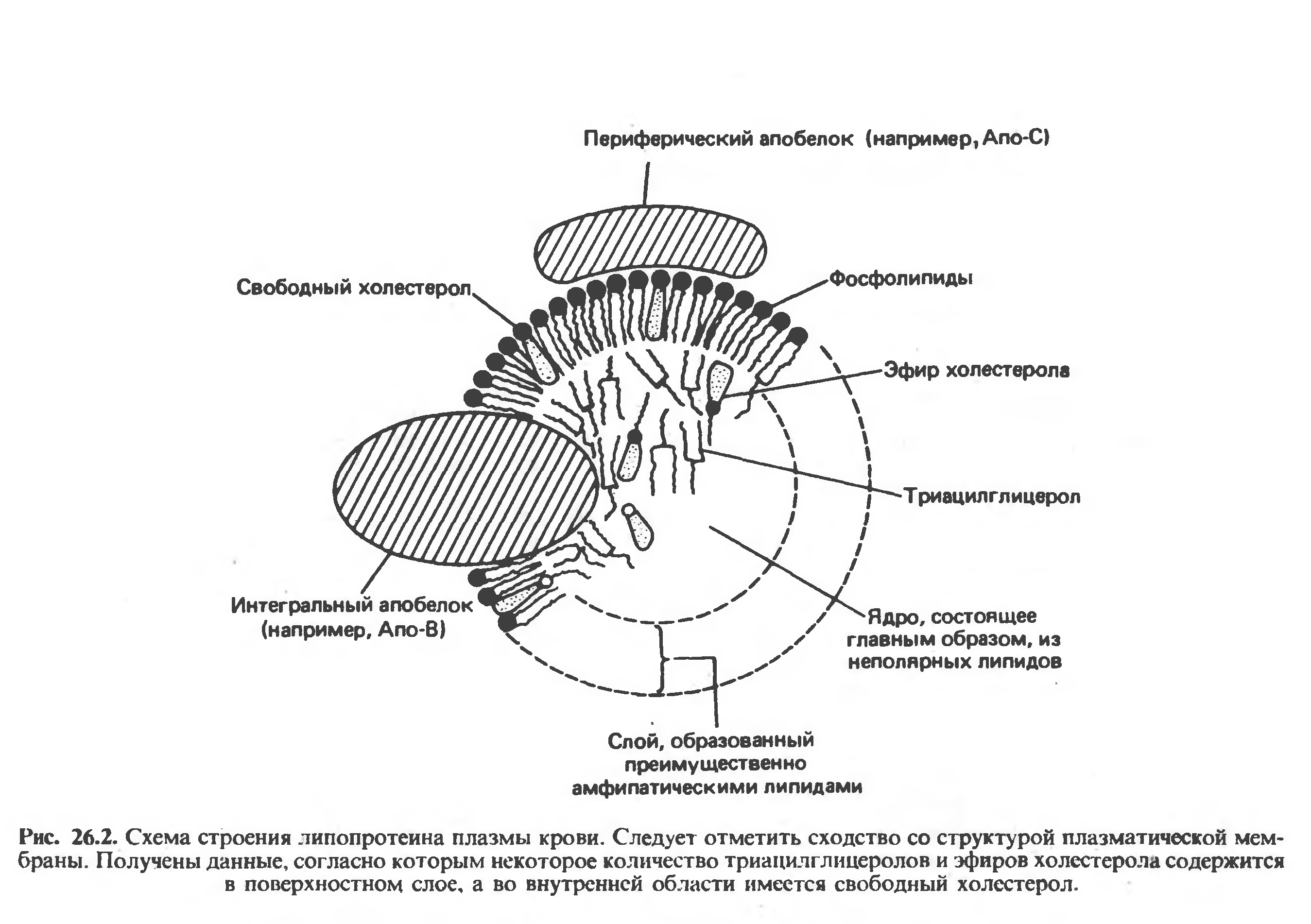
Рисунок 5. Строение липопротеиновой частицы плазмы крови.
Функция плазменных липопротеинов - транспорт гидрофобных липидов в гидрофильной среде плазмы крови.
Модуль 4. Обмен аминокислот и белков.
Цель занятия:
|
Знать |
Уметь |
|
1. Аминокислоты – структурные мономеры белков. Общие свойства природных (протеиногенных) аминокислот. 2.Физико-химические свойства белков 3. Биологическая роль белков. Нормы белка в питании в зависимости от возраста. Белковый минимум. Азотистый баланс. 4.Переваривание белков. Ферменты переваривания. Продукты переваривания, их структура и дальнейшая судьба. 5. Тканевые превращения аминокислот. . Общие пути катаболизма аминокислот (по α-амино- и α-карбоксильной группам), специфические превращения по радикалу. 6. Состав и строение нуклеозидов, нуклеотидов и нуклеиновых кислот; уровни структурной организации РНК и ДНК; типы РНК и их биологическая роль, уровни организации РНК- и ДНК-протеида, строение рибосом. 7. Генетический код и его свойства, этапы реализации генетической информации. 8. Синтез и катаболизм пиримидиновых нуклеотидов. 9.Синтез и катаболизм пуриновых нуклеотидов.Гиперурикемия. Подагра. 10.Обмен гемопротеидов. Желтухи. |
1. Объяснить особенности переваривания белков в желудочно-кишечном тракте, специфику действия отдельных протеолитических ферментов, систему их активации, пути всасывания аминокислот; 2.Определять протеолитическую активность желудочного сока и интерпретировать полученные результаты. . 3. Писать реакции переаминирования и дезаминирования аминокислот, оценить роль пиридоксальфосфата и глутамата в этих процессах. 4. Писать реакции декарбоксилирования аминокислот и оценить роль биогенных аминов для организма. 5.Определять активность трансаминаз в сыворотке крови и интерпретировать полученные результаты. 6.Провести количественное определение мочевой кислоты в сыворотке крови и интерпретировать полученные результаты. 7. Охарактеризовать изменения в обмене пигментов при различных желтухах.
|
План занятия
1.Контроль выполнения задания по самоподготовке, решение тестовых задач исходного уровня.
2.Рассмотрение основных вопросов по теме, решение ситуационных задач.
3. Лабораторная работа.
4. Контроль выполнения лабораторной работы, подведение итогов занятия.
Контрольные вопросы
1. Биологическая роль белков. Нормы белка в питании в зависимост отвозраста. Белковый минимум. Азотистый баланс.
2. Переваривание белков. Ферменты переваривания. Продукты переваривания, их структура и дальнейшая судьба .
3. Представление о механизме активации протеолитических ферментов желудочно-кишечного тракта.
4. Назовите протеолитические ферменты поджелудочной железы и кишечного сока, напишите химизм ферментативного расщепления карбокси- и аминопептидазой выбранного вами пентапептида.
5. С помощью какой лабораторной работы можно определить протеолитическую активность пепсина? В каких единицах выражается активность пепсина?
6. Понятие о клеточном метаболическом пуле аминокислот. Пути образования и использования аминокислот в тканях.
7. Аминокислоты как лекарственные препараты.
8. Остаточный азот крови. Компоненты. Суть метода определения остаточного азота.
9.Тканевый распад белков. Роль лизосомальных ферментов в этих
процессах.
10.Переаминирование аминокислот. Ферменты переаминирования. Механизм реакции. Какой витамин участвует в этом процессе? Биологическое значение переаминирования. Определения трансаминаз в сыворотке крови при инфаркте миокарда, болезнях печени.
11.Тканевые превращения аминокислот. Дезаминирование аминокислот (прямое и непрямое). Роль -кетоглутаровой и глутаминовой кислот в дезаминировании и переаминировании аминокислот. Гликогенные и кетогенные аминокислоты.
12.Декарбоксилирование аминокислот Ферменты декарбоксилирования, характер простетической группы. Образование биогенных аминов. Влияние последних на метаболизм и физиологические функции. Роль аминооксидаз. Ингибиторы аминооксидаз как фармакопрепараты.
13.Особенности обмена фенилаланина и тирозина. Биологическая роль указанных аминокислот. Врожденные нарушения обмена, ферментные блоки. Фенилетонурия, фенилпировиноградная олигофрения, альбинизм, алкаптонурия.
14.Особенности обмена серосодержащих аминокислот. S-аденозилметионин и его роль в процессах метилирования.
15.Особенности обмена глицина и аргинина. Их роль в образовании креатина и креатинфосфата.
16.Особенности обмена дикарбоновых аминокислот. Участие в обезвреживании аммиака.
17.Пути обезвреживания аммиака в тканях: синтез глутамина, восстановительное аминирование аминокислот. Глутаминаза почек. Образование и выведение солей аммония в почках, физиологическая роль этих процессов.
18.Биосинтез мочевины как основной путь обезвреживания аммиака. Объясните механизм включения двух атомов азота в молекулу мочевины. Энергетическая обеспеченность процесса. Количественное определение мочевины.
19.Структура и биосинтез ДНК. Современные представления о репликации ДНК. Роль отдельных ферментов в процессе репликации.
20.Структура и биосинтез РНК. Характеристика РНК-полимеразы и этапов транскрипции: инициации, элонгации, терминации и процессинга РНК.
21. Генетический код и его свойства. Концепция: один ген - один белок, один цистрон - одна подипептидная цепь. Строение информационной РНК.
22.Строение транспортной РНК. Адапторная функция тРНК. Взаимодействие кодон-антикодон. Строение и роль рибосом в синтезе белка.
23.Биосинтез белка. Этапы матричного синтеза белка: рекогниция, инициирующий комплекс и инициация, элонгация, терминация, посттрансляционные изменения белка.
24.Регуляция действия генов и биосинтеза белка. Схема Жакоба и Моно. Биохимические механизмы клеточной дифференцировки и онтогенеза.
25. Биохимические основы биологической эволюции, наследственности и изменчивости.
26.Молекулярные механизмы мутаций и их последствия. Мутагенные агенты. Система биохимического контроля структуры ДНК.
27.Обмен нуклеопротеинов. Переваривание и всасывание нуклеопротеинов. Ферменты переваривания. Конечные продукты переваривания.
28.Представьте схему основного и дополнительного путей синтеза пуриновых нуклеотидов. Разъясните участие витаминов, аминокислот и СО2 в данном процессе.
29.Основной и дополнительные пути тканевого синтеза пиримидиновых нуклеотидов.
30.Распад ДНК и РНК в желудочно-кишечном тракте, ферменты распада. Тканевой распад ДНК и РНК, химизм деградации, ферменты деградации.
31.Особенность и химизм тканевого распада пуриновых и пиримидиновых нуклеотидов. Конечные продукты.
32.Нарушение обмена пуриновых оснований. Подагра, ее симптоматика.
33.Переваривание и всасывание железосодержащих хромопротеинов. Особенности всасывания экзогенного железа в кишечнике.
34.Синтез железосодержащих хромопротеинов в тканях. Глицино-янтарный цикл Шемина.
35.Тканевой распад гемоглобина, роль клеток РЭС и печени. Прямой и непрямой билирубин. Химизм образования прямого билирубина.
36.Нарушение пигментного обмена. Желтухи, механизм их возникновения. Биохимические показатели при желтухах, дифференциальная диагностика желтух.
37.Количественное определение билирубина в сыворотке по методу Йендрашека. Диагностическое значение определения, цифры нормального содержания.
38.Механизм образования пигментов мочи и кала.
Примеры тестов контроля исходного уровня знаний
Вид 1.
