- •Раздел I. Методические указания и контрольные работы…………… 7
- •Раздел II.Самостоятельная работа студентов в период лабораторно-
- •РАздел I. Методические указания и контрольные работы по биологической химии
- •Распределение материала по контрольным работам Контрольная работа №1
- •Контрольная работа №2
- •Контрольная работа №3
- •Литература Основная:
- •1.Обмен руклеопротеинов
- •2.Обмен хромопротеинов
- •1.Введение в фармацевтическую биохимию. Микросомальное окисление
- •2.Конъюгация ксенобиотиков
- •Распределение вопросов контрольных работ по вариантам
- •Раздел II. Самостоятельная работа студентов в период лабораторНо – экзаменационной сессИи Модуль 1. Белки. Ферменты. Цель занятия:
- •План занятия
- •1.1. Белки
- •1.2. Ферменты
- •1.1. Дан трипептид гли – ала – вал
- •Примеры тестов для контроля исходного уровня знаний по теме «Ферменты»
- •Примеры ситуационных задач по теме «Белки»
- •Работа № 2. Количественное определение белка сыворотки крови биуретовым методом.
- •Фотоэлектроколориметр
- •Работа №3. Высаливание белков сыворотки крови сернокислым аммонием
- •Эталоны ответов к тестовым заданиям по теме «Белки»
- •План занятия
- •1.1. Наиболее токсичен при гипервитаминозе…
- •1.2Витамина в12 …
- •2.1.Фермент – кофермент – функция.
- •2.2. Витамин – антивитамин
- •1.3.Минуя стадию образования пирувата, в ацетил-КоА превращаются…
- •3.1. В состав пируватдегидрогеназного комплекса входят…
- •3.2. Примерами субстратного фосфорилирования являются реакции
- •3.3. Скорость окисления ацетата в цтк снижают…
- •2.1. Анилиновая проба на витамин д.
- •2.2. Реакция с серной кислотой.
- •5.1. Реакция с гидросульфитом натрия.
- •5.2. Реакция с раствором уксусно-кислой меди.
- •1. Обмен углеводов. Сахар крови. Регуляция сахара крови
- •1.1. В пентозный путь катаболизма вовлекается сразу … молекул глюкозо-6-фосфата
- •1.1. Ферменты, участвующие в расщеплении жиров в желудочно-кишечном тракте относятся к классу …
- •Эталоны ответов на ситуационные задачи по теме «Обмен углеводов» Задача 1.
- •1.1 Серотонин синтезируется из…
- •2.2 Установление соответствия:
- •Задача 1.
- •Эталоны ответов на ситуационные задачи Задача 1.
- •1.3 Развитие метгемоглобинемии может быть обусловлено:
- •3.2. В реакциях инактивации активных форм кислорода участвуют:
- •3.3. В основе детоксикации ядовитых веществ в печени лежат процессы:
- •Задача 1.
- •1. Реакция с хлорным железом.
- •2. Реакция с йодатом калия.
- •Ответы на ситуационные задачи
- •Контрольные вопросы
- •1.2. Первая фаза биотрансформации включает все перечисленные реакции,
- •1.3. Биотрансформация сульфаниламидов осуществляется с участием:
- •2.2. Установление локализации реакции биотрансформации:
- •3.2. Фармацевтическая биохимия изучает:
- •Примеры ситуационных задач
- •Задача 2
- •Некоторые биохимические показатели жидких сред организма
2.1. Анилиновая проба на витамин д.
В сухую пробирку налить 5 капель рыбьего жира, 15 капель хлороформа и 5 капель анилинового реактива (15 частей анилина и 1 часть концентриро
ванной соляной кислоты). Осторожно нагреть на спиртовке и отметить появление красного окрашивания.
2.2. Реакция с серной кислотой.
В пробу налить 1 каплю масляного раствора витамина Д, 4 капли хлороформа, перемешать и добавить 2 капли концентрированной серной кислоты. Встряхнуть и отметить появление ярко-желтого окрашивания, переходящего в буро-красное.
Работа 3. Качественная реакция на витамин Е с азотной кислотой.
В сухую пробирку налить 5 капель 1% раствора токоферола, прибавить 10 капель концентрированной азотной кислоты и встряхнуть. После отстаивания эмульсии отметить появление красного окрашивания в верхнем слое.
Работа 4. Качественная реакция на викасол с щелочным раствором
цистеина
Викасол – синтетический аналог витамина К1 - в присутствии цистеина в щелочной среде окрашивается в лимонно-желтый цвет.
Техника выполнения работы. На сухое часовое стекло наносят 5 капель раствора викасола, добавляют 5 капель раствора цистеина и 1 каплю 10% раствора едкого натра. Появляется лимонно-желтое окрашивание.
Работа 5. Качественные реакции на витамин PP.
5.1. Реакция с гидросульфитом натрия.
В пробирку на кончике скальпеля поместить порошок витамина РР, прилить 0,5-1,0 мл 10% раствора бикарбоната натрия и 0,5-1,0 мл свежеприготовленного 5% раствора гидросульфита натрия. Отметить появление продукта восстановления витамина РР желтого цвета.
5.2. Реакция с раствором уксусно-кислой меди.
К 1 мл 0,1% раствора никотиновой кислоты добавить 1 мл 10% раствора бикарбоната натрия, прилить равный объем 5% раствора уксусно-кислой меди.
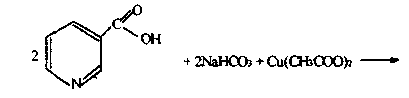
никотиновая кислота
Отметить появление голубого окрашивания и выпадения осадка медной соли синего цвета, образующегося по следующей реакции
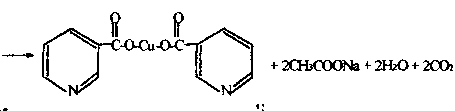
медная соль никотиновой кислоты синего цвета
Работа 6. Реакция восстановления рибофлавина.
Реакция основана на способности рибофлавина восстанавливаться. Окрашенный в желтый цвет рибофлавин при восстановлении приобретает розовый цвет, а затем обесцвечивается, так как восстановленная форма витамина В2 бесцветна. Механизм реакции может быть представлен следующим уравнением
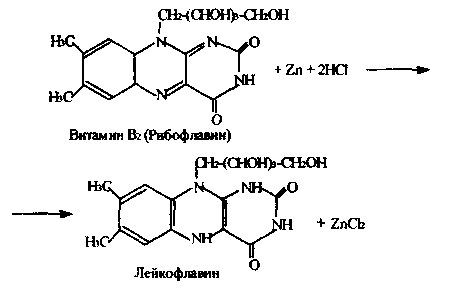
Техника выполнения работы. 10 капель взвеси рибофлавина в воде (0,025%) налить в пробирку, добавить туда же 5 капель концентрированной соляной кислоты и поместить небольшой кусочек металлического цинка. Выделяющийся водород восстанавливает рибофлавин и раствор изменяет окраску из желтой в красную и розовую, а затем обесцвечивается.
Работа 7. Качественная реакция на витамин В6.
Принцип метода. Витамин В6 при взаимодействии с раствором хлорного железа образует комплексную соль типа фенолята железа красного цвета.
Техника выполнения работы. К 5 каплям 1% раствора витамина В6 приливают равное количество 1% раствора хлорного железа и перемешивают. Развивается красное окрашивание.
Работа 8. Определение тиамина в поливитаминных препаратах.
Принцип метода основан на способности тиамина окисляться феррицианидом калия в щелочной среде в тиохром, который после экстракции из раствора бутиловым спиртом дает в ультрафиолетовых лучах сине-голубое окрашивание.
Ход работы. Драже из поливитаминов размять в ступке, добавить 30 мл 0,1н раствор НСl и тщательно размешать. В 3 пробирки добавить:
1. Контроль - 5 мл 0,1 н р-р НСl.
2. Опыт - 1 мл р-ра витаминов + 4 мл дистиллированной воды.
3. Стандарт - 5 мл стандартного р-ра тиамина.
Во все пробирки прилить по 1,5 мл окислительной смеси, осторожно встряхнуть до полного перемешивания, во все пробирки налить по 5 мл н-бутанола, интенсивно встряхивать в течение 5 минут. Подождать расслаивания жидкости. Все пробирки помещают в штатив флуороскопа и сравнивают флуоресценцию р-ра в 3-х пробирках.
Работа 9. Определение рибофлавина в поливитаминных препаратах.
Принцип метода. Основан на способности рибофлавина давать в ультрафиолетовых лучах желто-зеленую флюоресценцию, интенсивность которой зависит от концентрации рибофлавина.
Ход работы. Экстракт готовится как в предыдущей работе.
В 3 пробирки добавить:
1. Контроль - 7 мл воды.
2. Опыт - 2 мл экстракта из драже + 5 мл воды.
3. Стандарт - 1 мл стандартного р-ра + 5 мл воды.
Помещают пробирки в штатив флуороскопа и сравнивают флюоресценцию в 3-х пробирках.
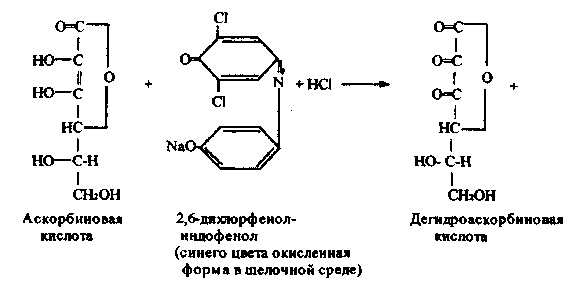
Работа 10. Количественное определение аскорбиновой кислоты
в лекарственных растениях по Тильмансу.
Метод основан на способности аскорбиновой кислоты восстанавливать 2,6-дихлорфенолиндофенол, который в кислой среде имеет красную окраску,
при восстановлении обесцвечивается; в щелочной среде окраска синяя. Реакцию проводят в кислой среде для предотвращения разрушения витамина С.
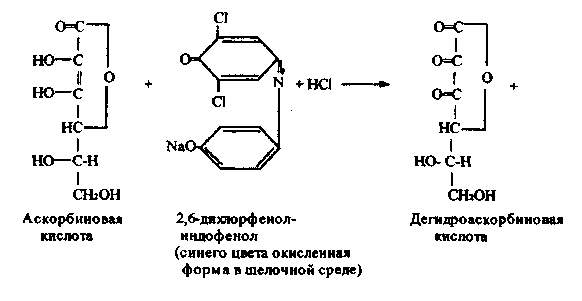
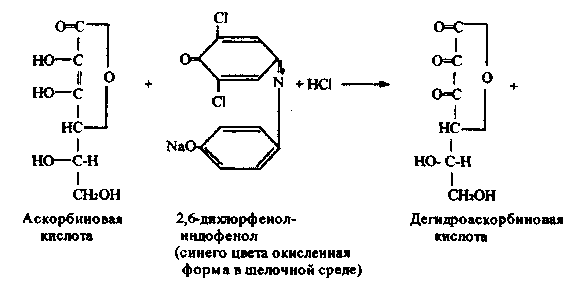
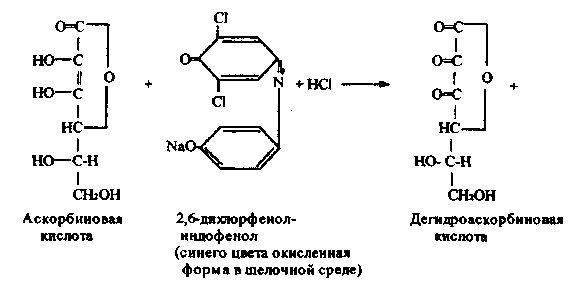
 Химизм
реакции:
Химизм
реакции:
Техника выполнения работы. На аптечных весах берут навески лекарственного сырья по 0,5 г (шиповник, очищенный от семян – 0,2 г). Исследуемый материал растирают в ступке с 5 мл 2% раствора НС1. Вытяжку фильтруют через тонкий слой ваты в мерную колбу на 100 мл. Извлечение витамина С из той же навески повторяют 3 раза с 5 мл соляной кислоты, фильтруя каждый раз полученную вытяжку в ту же мерную колбу. Содержимое колбы доводят до метки дистиллированной водой. Для титрования отбирают 10 мл
вытяжки в стаканчик и титруют 0,001 н раствора 2,6-дихлорфенолиндофенола до розовой окраски, сохраняющейся в течение 30 сек.
Содержание витамина С в растительном сырье (кг) производят по формуле:
0,088А1001000 Х= , где
10В
X – содержание аскорбиновой кислоты в мг/кг;
0,088- масса аскорбиновой кислоты, соответствующая 1 мл 0,001н раствора 2,6-ДХФИФ, мг;
А - результат титрования 0,001 н раствором 2,6-дихлорфенолиндофенолом, мл;
В - навеска исследуемого материала, г;
100- разведение взятой пробы;
1000 – коэффициент пересчета на 1 кг сырья;
10 – объем жидкости, взятый на титрование, мл.
Результаты исследования оформить в виде таблицы и сделать вывод о значении исследованного растительного материала как источника витамина С. В выводе указать, целесообразно ли применение данного лекарственного растения с целью профилактики С-витаминной недостаточности.
|
Материал |
Навеска, г |
Объем 2,6-ДХФИФ |
Содержание аскорбиновой кислоты, мг/кг |
|
|
|
|
|
Работа 11. Количественное определение витамина Р в чае по Левенталю.
В основе метода лежит способность рутина окисляться перманганатом калия. В качестве индикатора применяется индигокармин, который вступает в реакцию с перманганатом калия после того, как окислится весь рутин (флавон).
Техника выполнения работы. К 100 мг чая приливают 50 мл горячей дистиллированной воды и проводят экстракцию в течение 5 мин. 10 мл экстракта чая отмеривают в колбочку, добавляют 10 мл дистиллированной воды, 5 капель 0,1% раствора индигокармина (появляется синее окрашивание). Титруют из микробюретки 0,05 н раствором КМп04 до появления устойчивой желтой окраски.
Содержание витамина Р в чае рассчитывают по следующей формуле:
3,2АV100 Х= , где
V2P1000
Х- содержание витамина Р в образце, в %;
3,2- стандартный пересчетный коэффициент (экспериментально установлено, что 1 мл 0,05 н раствора КМn04 окисляет 3,2 мкг рутина);
А- результат титрования 0,05 н раствором перманганата калия, мл;
V- объем, в котором растворена взятая для анализа навеска, мл;
100- общее количество вещества для расчета процентного содержания, г;
V2- объем раствора, взятого для титрования, мл;
Р- навеска, мг;
1000- перевод микрограммов в миллиграммы.
.
Работа 12. Количественное определение пировиноградной кислоты в моче
Принцип метода. Пировиноградная кислота является одним из промежуточных продуктов углеводного обмена. Пировиноградная кислота взаимодействует с 2,4-динитрофенилгидразином в щелочной среде, образуя 2,4-динитрофенилгидразоны пировиноградной кислоты желто-оранжевого цвета, интенсивность окрашивания которых пропорциональна концентрации пировиноградной кислоты.
Гидразоны α-кетоглутаровой, щавелевоуксусной, дегидроаскорбиновой кислот в щелочной среде нестойки и быстро разлагаются.
Ход работы. Контрольная и опытная пробы ставятся одновременно, пользуются сухой химпосудой. Берут 2 пробирки: в контрольную наливают 1мл воды в опытную 1 мл мочи. Зачем в обе пробирки приливают по 1 мл 2,5% спиртового раствора КОН, перемешивают в течение 1 минуты, а затем приливают по 0,5мл 0,1 % раствора 2,4-динитрофенилгидразина и оставляют стоять на 15 минут при комнатной температуре. Колориметрируют на ФЭК против контроля на реактивы (проба с водой) в кювете толщиной 5мм с синим светофильтром. Расчеты выполняют по калибровочному графику, при этом находим содержание ПВК в моче в мкг/мл. Найденную величину умножаем на суточный диурез (1500 мл для мужчин и 1200 мл для женщин) и получаем содержание ПВК в суточной моче. В норме экскреция ПВК с мочой составляет 10-25 мг в сутки (113,7-283,9 мкммоль/сут).
Увеличение выделения ПВК с мочой наблюдается при авитаминозе и гиповитаминозе В1. Содержание ПВК в крови и экскреция с мочой возрастает также при сахарном диабете, сердечной недостаточности, гиперфункции гипофизарно-адреналовой системы. При наркозе содержание ПВК в крови, напротив, снижается.
Работа 13. Ферменты биологического окисления. Качественное определение активности сукцинатдегидрогеназы мышц.
Сукцинатдегидрогеназа окисляет янтарную кислоту в фумаровую. Коферментом СДГ является флавинадениндинуклеотид. В условиях опыта в качестве акцептора водорода при окислении сукцината используется натриевая соль 2,6-дихлорфенолиндофенола.
В водном растворе окисленная форма 2,6-дихлорфенолиндофенола окрашена в синий цвет, восстановленная форма - бесцветна. Активность СДГ мышц определяется при добавлении к мышечной кашице растворов сукцината и натриевой соли окисленной формы 2,6-дихлорфенолиндифенола. Если СДГ активна, то интенсивность синей окраски ослабляется благодаря восстановлению красителя.
Химизм реакции:
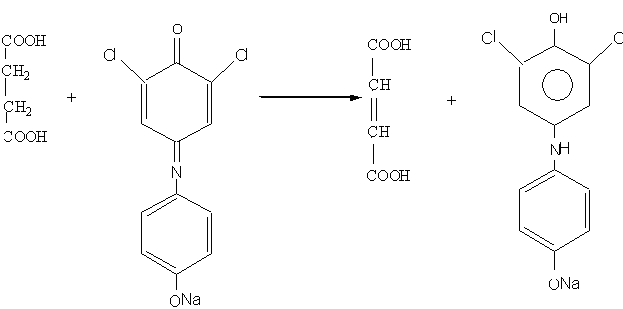
сукцинат окисленная форма восстановленная форма
Ход работы. В 2 пробирки отмерить по 3мл фосфатного буфера с рН 7,4. В одну пробирку добавить 5 капель 5% раствора янтарной кислоты и для нейтрализации 5 капель 0.1нраствора едкого калия, в другую прилить 10 капель дистиллированной воды. В обе добавить по 1мл 0,001н раствора 2,6-дихлорфенолиндофенола и по 50 мг хорошо измельченной ткани поперечнополосатой мышечной ткани только что убитого животного. Обе пробирки поместить в термостат на 20 минут при 37С. Затем сравнить интенсивность окраски в контрольной и опытной пробирках. Сделать выводы.
Работа14. Определение активности пероксидазы в растительном
материале по методу А. Н. Бояркина.
Принцип метода. Метод основан на непрерывном измерении светопоглощения бензидиновой сини, образующейся при окислении бензидина под действием пероксидазы.
Реакция описывается уравнением:
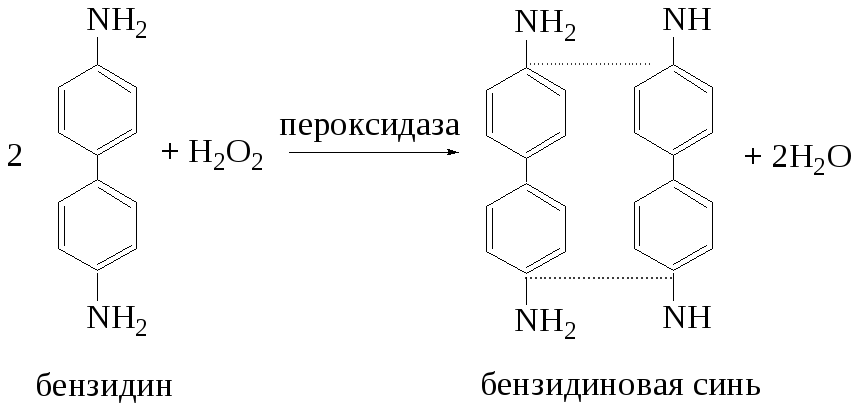
Ход определения. Навеску 100 мг растительного материала (свежие листья растений) помещают в ступку и растирают, прибавляя порциями 10 мл дистиллированной воды. Растертую массу переносят в мерную колбу вместимостью 25 мл и доводят водой до метки. Содержимое колбы настаивают 10 мин, а затем сливают в центрифужные пробирки и центрифугируют 10 мин при 3000 об/мин.
Ставят кюветы в кюветодержатель прибора: слева контрольную и справа опытную. Шкалу правого отсчетного барабана устанавливают на нулевую отметку и с помощью оптических клиньев приводят стрелку гальванометра в нулевое положение.
Правый отсчетный барабан ставят на деление 0,250 (исходная экстинкция), при этом стрелка гальванометра отклоняется в сторону.
В левую (контрольную) кювету добавляют 2 мл воды, а в правую (опытную) вносят 2 мл раствора пероксида водорода пипеткой с широким носиком (чтобы сильная струя перемешала жидкость в кювете). Одновременно с первой каплей жидкости включают секундомер.
В опытной кювете раствор синеет, по мере нарастания интенсивности окраски, стрелка гальванометра приближается к нулевому положению. Отмечают время от начала приливания раствора пероксида водорода до достижения стрелкой гальванометра нулевого положения. Повторяют определения трижды и берут среднее значение времени.
Расчет. Активность фермента рассчитывают по формуле
![]()
где
Х-активность пероксидазы, Е*с![]() *кг
*кг![]() (Е-единица экстинкции); ∆Е – изменение
экстинкции, равное 0,250;t-время
реакции, с; d-толщина
слоя кюве
(Е-единица экстинкции); ∆Е – изменение
экстинкции, равное 0,250;t-время
реакции, с; d-толщина
слоя кюве
ты, равная 2; 1000-коэффициент перерасчета граммов в килограммы;
0,1-навеска, г; 2-объем пробы, мл.
![]()
Оформление работы. Рассчитать и сравнить активность пероксидазы в исследуемом материале; в выходе отметить биологическое значение фермента.
Вывод.
Практическое значение работы. Пероксидаза выполняет две функции: собственно пероксидазную, т.е. окисляет вещества с участием пероксида водорода, и оксидазную, т.е. катализирует окисление субстратов за счет молекулярного кислорода без участия пероксида водорода. Этот фермент проявляет пероксидазную активность в отношении практически всех фенолов (пирокатехин, пирогаллон, галлонавая кислота, гваякол и др.), ароматических аминов (бензидин, п-фенилендиамин и др.), аскорбиновой кислоты, нитритов и т.д.
В то же время пероксидаза, обладая оксидазной функцией, способна участвовать в окисление флороглюцина, НАД●Н2, НАДФ●Н2, индолилуксусной кислоты, оксалата, фенилпирувата и т.д.
В практике широко используют определение активности пероксидазы для оценки метаболизма ростовых веществ, лигнина и других вторичных продуктов обмена при физиологических и патологических процессах. Переоксидаза, выделенная из хрена, широко используется как аналитический реагент при проведении клинико-биохимических исследований. Поэтому метод измерения активности фермента необходим для контроля качества продажного препарата фермента.
Работа 14. Восстановление цитохрома С.
Цитохромы участвуют в митохондриальной дыхательной цепи в качестве переносчиков электронов от флавопротеидов к кислороду. Кислород активируется и соединяется с ранее ионизированными атомами водорода, образуя воду. При восстановлении красный раствор цитохрома С бледнеет.
Ход работы. В пробирку прилить 0,001% раствор цитохрома С. В другую пробирку с газоотводнойтрубкой налить немного соляной кислоты и бросить кусочек металлического цинка. Закрыть пробирку пробкой с газоотводной трубкой и пропускать пузырьки выделяющегося водорода через раствор цитохрома С. Через некоторое время отметить изменение интенсивности окраски раствора фермента.
Работа 15. Обнаружение активности цитохромоксидазы.
При добавлении к срезам тканей α-нафтола и парафенилендиамина происхо дит окрашивание тканей вследствие образования индофеноловой сини. Эта реакция катализируется цитохромоксидазой.
|
Химизм реакции:
|
О2
|
|
|
α – нафтол n- фенилен диамин |
|
индофеноловая синь |
Ход работы. На часовое стекло взять срез свежей ткани, например печени или мышцы, на него нанести по 1 капле 1% спиртового раствора α-нафтола и 1% водного раствора парафенилендиамина. Появление синего окрашивания на срезе ткани указывает на присутствии в ней активной цитохромоксидазы.
Работа16. Качественные реакции на пигменты хлоропластов растений .
А) Экстрагирование пигментов из листьев крапивы. Метод основан на способности хлорофилла и других пигментов под действием горячего спирта, переходить в раствор. При этом хлорофилл при взаимодействии со спиртом превращается в этилхлорофиллид – сложный эфир, в котором остаток фитола замещен остатком этилового спирта.
Ход определения. 0,5 г сушеной крапивы растирают в ступке с 5,0 мл этилового спирта, переносят в пробирку и нагревают на водяной бане при 90-1000С до закипания спирта. Содержимое фильтруют через бумажный фильтр в другую пробирку. Фильтрат, содержащий хлорофиллид, хлорофилл, ксантофилл и другие пигменты, имеет зеленый цвет с интенсивной красной флюресценцией. Его используют для исследования.
Б) Разделение пигментов по Краусу. Метод основан на различной способности пигментов растворяться в бензине: хлорофилл, хлорофиллид растворимы, а ксантофилл нерастворим в нем.
Ход определения. К 10 каплям полученного фильтрата прибавляют равный объем бензина, содержимое тщательно встряхивают, постукивая пальцем по дну пробирки. Наблюдают за окраской пигментов, содержащихся в разных растворителях.
В) Осаждение хлорофилла. Метод основан на способности эфирных групп хлорофилла при омылении раствором гидроскида бария образовывать бариевые соли хлорофиллидов А и В, нерастворимых в воде; жидкость над осадком имеет желтую окраску вследствие присутствия в вытяжке каротина и ксантофилла.
Ход определения. К 10 каплям фильтрата добавляют 20 капель раствора гидроксида бария и тщательно взбалтывают. Наблюдают за происходящими изменениями.
Г) Восстановление хлорофилла аскорбиновой кислотой. Метод основан на способности аскорбиновой кислоты восстанавливать хлорофилл, приобретающий вследствие этого желтое окрашивание.
Ход определения. К 10 каплям фильтрата добавляют 2 капли воды, несколько кристалликов аскорбиновой кислоты и в течение 3-5 мин нагревают в водяной бане при 70-800С. Наблюдают за изменением окраски.
Д) Получение феофитина из хлорофилла. Метод основан на способности соляной кислоты связывать ион магния, входящий в состав хлорофилла, с образованием феофитина, имеющего оливково-бурый цвет.
Ход определения. К 5 каплям фильтрата прибавляют 1 каплю раствора соляной кислоты. Наблюдают за изменением окраски.
Эталоны ответов к тестовым заданиям по разделу «Витамины».
Вид1.1. – а; 2 – в;
Вид 2.1. 1 –г –b; 2-в –e; 3-д-d; 4-Е –a; 5-А-c; 6-Б-e; 7-3-f; 8-ж-g.
Вид 2.2. 1-б; 2-е; 3-а,г; 4-ж; 5-д; 6-з;
Вид 2.3.-1-б;2-б;3-б,а;4-в;5-в,г;6-в,а;
Вид 3.1.-1,3; 2 – 2.4.
Вид4.1. – А(+++), 4.2 – А(+++).
Эталоны ответов на ситуационные задачи по теме «Витамины»
Задача 1.
Ответ.Коферментная форма витамина Вс – тетрагидрофолиевая кислота (ТГФК) играет роль переносчика одноуглеродных групп (метильного, формильного радикалов) при биосинтезе тимина, пуриновых нуклеотидов, поэтому при недостатке фолиевой кислоты нарушается процесс синтеза ДНК. Нарушение биосинтеза ДНК в клетках костного мозга, осуществляющих эритропоэз, приводит к анемии, сопровождающейся выбросом в периферическую кровь молодых клеток – макроцитов (мегалобластов) с низким содержанием ДНК.
Антагонисты фолиевой кислоты – аминоптерин, метотрексат, являющиеся ее структурными аналогами, напротив, тормозят синтез ДНК и используются в онкологии при лечении опухолевых заболеваний (лейкозов).
Задача 2.
Ответ. Аскорбиновая кислота, а также янтарная кислота и ионы Fe++ необходимы для реакции гидроксилирования остатков лизина и пролина в ходе постсинтетического созревания молекулы тропоколлагена. Затем часть остатков гидроксилизина и гидроксипролина гликозилируется. В свою очередь, гликозильные остатки участвуют в образовании поперечных ковалентных сшивок между молекулами тропоголлагена в ходе образования коллагенового волокна.
Биофлавоноиды, относимые к витамину Р (от англ. рermeability – проницаемость), образуют совместно с витамином С единую окислительно-
восстановительную систему, стабилизируют основное вещество соединительной ткани в том числе и путем ингибирования гиалуронидазы.
Задача 3.
Ответ. Нормальный желудочный сок содержит специфический гликопротеин, необходимый для всасывания витамина В12. Заболевания желудка, сопровождающиеся снижением секреции желудочного сока и его компонентов (атрофический гастрит, рак желудка), сопровождаются нарушением всасывания кобаламина, что является причиной развития пернициозной анемии (болезнь Аддисона- Бирмера). Пероральное введение одного витамина В12 в данном случае неэффективно. Наиболее эффективными являются внутримышечные иньекции, или же препараты витамина В12 совместно с одновременным приемом желудочного сока.
Эталоны ответов к тестовым заданиям по разделу «Энергетический обмен»
Вид1. 1.- а, 2- В, 3- Г;
Вид2.1. 1-в, 2-а, 3-б, 4-г, 5-в;2.2. 1-г, 2-в, 3-а, 4-б;2.3. 1-А; 2-В; 3-Д; 4-Б4 5-Г; 6-А;
Вид 3.1.1,2,3;Вид 3.2. 1, 3; Вид 3.3. 4;
Вид4.1. D (-+-); 2. С(+--).
Эталоны ответов на ситуационные задачи
Задача 1.
Ответ. Энергия гидролиза АТФ составляет –7,3 ккал/моль, следовательно, гидролиз 12,5 молекул АТФ высвобождает 12,57,3 =91,3 ккал/моль энергии, тогда как образование этого количества АТФ требует 273 ккал. Эффективность составляет 91,3100/273=33,4%.
Задача 2.
Ответ. В результате альдольной конденсации щавелевоуксусной кислоты и меченого по указанным положениям ацетила образуется лимонная кислота со следующим распределением радиоактивной метки
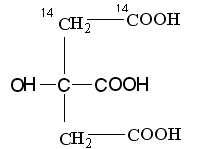
Углеродные атомы, имеющие происхождение из меченого ацетила, в ходе первого оборота цикла окисляться не будут, поэтому радиоактивная метка
будет обнаруживаться в центральных атомах регенерированного ЩУК
(НООС-14СН214СО-СООН). В ходе второго оборота, после конденсации ацетила и меченого ЩУК, будет образовываться лимонная кислота:
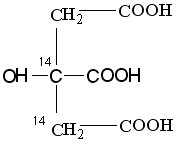
поэтому, в ходе второго оборота меченые углероды окислительному декарбоксилированию подвергаться не будут и выделится ЩУК со следующим распределением радиоактивной метки НООС-СН214СО-14СООН. Таким образом, 14СО2 будет выделяться в ходе третьего оборота цикла.
Задача 3.
Ответ. Активность ферментов определяется при концентрациях субстрата, обеспечивающих V max, поэтому состав инкубационной среды по прямой реакции должен содержать субстрат – яблочную кислоту. Достижение V max требует и поддержания оптимального значения рН, следовательно, должен использоваться соответствующий буфер. Вследствие того, что НАД-зависимые дегидрогеназы непрочно связывают кофермент, требуется добавление к среде определения и кофермента – окисленной формы НАД. Для определения активности фермента по обратной реакции (по убыванию светопоглощения) среда будет содержать оксалоацетат, восстанновленный НАД и соответствующий буфер.
Модуль 3. Обмен и функции углеводов. Обмен и функции липидов.
|
Цель занятия: | |
|
Знать |
Уметь |
|
1.Углеводы.их строение,свойства,классификация, биологические функции. 2.Основные углеводы пи щи,их переваривание до моносахаридов в желудочно-кишечном тракте. 3.Пути поступления и использования глюкозы в клетке. 4.Сахар крови, механизмы его регуляции. 5.Обмен гликогена,его регуляция. Гликогенозы. 6.Этапы. ключевые ферменты,энергетическую эффективность анаэробного и аэробного дихотомического окисления глюкозы. 7.Этапы, биологическая роль глюконеогенеза. 8.Этапы, биологическая роль пентозофосфатного окисления глюкозы. 9.Липиды, их структура, свойства, биологическая роль. 10.Переваривание липидов в желудочно-кишечном тракте:желчные кислоты, панкреатическая и кишечная липазы,транспорт ресинтезированных липидов,хиломикроны.Липопротеинлипаза, ее роль. 11.Тканевой липолиз, окисление жирных кислот и глицерина, их энергетическая эффективность. 12.Биологические функции кетоновых,кетонемия,кетонурия. 13.Биосинтез жирных кислот,триацилглицеринов, холестерина. 14.Функции и обмен фосфоглицеридов. 15.Регуляция обмена липидов, его нарушения. |
1.Представить структуру основных моно- и дисахаридов. 2.Интерпретировать содержание глюкозы в крови и результаты теста на сахарную нагрузку. 3.Написать последовательность реакций синтеза и распада гликогена, их роль и гормональную регуляцию. 4.Представить основные пути катаболизма глюкозы: последовательность этапов гликолиза,полного аэробного распада , пентозофосфатного пути. 5.Представить схематически глюконеогенез из аминокислот, глицерина и молочной кислоты. 6.Определять содержание холестерина в крови ферментативным методом. 7.Интерпретировать изменения содержания липидов и липопротеинов в крови. |
План занятия
1.Контроль выполнения задания по самоподготовке, решение тестовых задач исходного уровня.
2.Рассмотрение основных вопросов по теме, решение ситуационных задач.
3. Лабораторная работа.
4. Контроль выполнения лабораторной работы, подведение итогов занятия.