
основы меаллургических процессов
.pdfКоличество расплава и корунда до начала образования кристаллов муллита определяется отношением отрезков 3–7 и 3–П. В результате превращения весь корунд израсходуется и система будет состоять из расплава и муллита в отношении 3–6 : 3–П. Последующее охлаждение от температуры t3 до tn (1595 °C) вызовет дополнительное выделение кристаллов муллита и обогащение жидкости кремнеземом в соответствии с линией П–Э. По достижении эвтектической температуры, 1595 °C, система становится условно инвариантной, так как содержит три фазы – кремнезем, муллит и расплав, поэтому отвод тепла не будет вызывать изменения температуры до тех пор, пока не исчезает жидкая фаза с образованием двойной эвтектики SiO2 + 3Al2O3·2SiO2 (S + A3S2).
В этой системе на значительном интервале содержания Al2O3 существует довольно развитая область твердожидкого состояния. Нижней границей полного затвердевания сплавов является эвтектическая температура (1595 °C).
Система CaO–Al2O3. В этой системе имеются две эвтектики, характеризующиеся температурами 1395 и 1400 °C, три конгруэнтно плавящихся соединения: 12CaO·7Al2O3 (C12A7); CaO·Al2O3 (CA) и CaO·2Al2O3 (CA2). Плавление называется конгруэнтным, если состав расплава совпадает с составом твердого химического соединения, из которого расплав образовался. Кроме этого, имеются два инконгруэнтно плавящихся соединения: 3CaO·Al2O3 (C3A), устойчивое до температуры 1539 °C, и CaO·6Al2O3, устойчивое до 1903 °C (рис. 8.9).
На диаграмме необходимо отметить выклинивающуюся область жидкого состояния. Около 1500 °C начинают затвердевать расплавы в интервале концентраций 45–55 % Al2O3.
Система CaO–SiO2. Эта система характеризуется тремя эвтектиками при температурах 2070 ± 10, 1460 и 1436 °C (рис. 8.10). В этой системе существуют два конгруэнтно плавящихся соединения α- 2CaO·SiO2 (α-C2S) – 2130 ± 10 °C и CaO·SiO2 (CS) – 1544 °C. Кроме того, имеются два инконгруэнтно плавящихся соединения: 3CaO·2SiO2 (C3S2) – устойчивое до 1464 °C и 3CaO·SiO2 (C3S); устойчивое в интервале температур 1250–1800 ± 20°C. Расслаивание в этой системе наступает около 1690 °C при содержании SiO2 ≈ 73 %. Фазовые переходы 2CaO·SiO2 (C2S) при давлении 0,1 МПа можно представить следующей схемой:
C2S 725o C C2S 1420 5 C C2S 2130 10 C L .
161
8.11. Строение шлаков
Рентгеноструктурные исследования твердых оксидов и силикатов показали, что основные оксиды имеют решетку типа NaCl. Элементарной ячейкой различных модификаций SiO2 является тетраэдр, в центре которого расположен катион кремния, а по вершинам – четыре аниона кислорода. Таким образом, кристаллические оксиды имеют ионное строение. Значительная доля ковалентной связи обусловливает высокую стабильность кремнекислородных тетраэдров. Кристаллические силика-ты и силикатные стекла также имеют ионное строение, причем заряды ионов кислорода оказываются различными в зависимости от того, какие катионы их окружают.
Поскольку в общем случае в многокомпонентном растворе оценка зарядов ионов затруднена, а на границе с металлом ионы обмениваются целым числом электронов, равным их валентностям, то вместо зарядов ионов в твердых и расплавленных силикатах принимают их валентности, например, Ca2+, O2- и т.д. При малых концентрациях SiO2 в оксидных системах кремнекислородные тетраэдры разделены катионами. С повышением доли SiO2 тетраэдры начинают объединяться вершинами, образуя цепочки, кольца и более сложные структуры.
Существование различных комплексных анионов подтверждено экспериментально. Например, обнаружены анионы SiO 44 , Si 2O67 и др. Аналогично в фосфатах обнаружены анионы PO34 , P2O74 , P3O105 . Рентгеноструктурные исследования жидких оксидов SiO2, FeO,
бинарных систем CaO–SiO2, FeO–SiO2, MgO–SiO2 и других, показали, что кремнекислородные тетраэдры существуют как в жидком SiO2, так и в силикатных расплавах более сложного состава.
Эти данные позволяют заключить, что жидкие шлаки представляют собой ионные расплавы, состоящие из одноатомных катионов металлов, вносимых основными оксидами, анионов кислорода O2- и многоатомных кремнекислородных анионов Si xOzy различной
степени сложности: от простейшего тетраэдра SiO 44 при малых концентрациях SiO2 до цепочек большой протяженности и других сложных структур, получающихся полимеризацией тетраэдров при высоких содержаниях SiO2.
Катионы алюминия, железа, ванадия как металлов, дающих амфотерные оксиды, могут замещать кремний в кремнекислородных тетраэдрах, а могут находиться в октаэдрической координации как
162
катионы основных металлов. Наряду с этим в шлаках допускают наличие комплексных анионов AlO2 ; AlO ; FeO2 ; VO2 ; TiO44 и др.
Фосфор образует с кислородом, подобно кремнию, устойчивые комплексные анионы, простейшим из них является также тетраэдр PO34 . Эти простые анионы с повышением содержания фосфора также могут быть полимеризованы с образованием, например, P2O74 , P3O96 и других
более сложных комплексов.
Сера находится в шлаках в форме одноатомного аниона, окруженного катионами основных металлов.
Эти особенности строения подтверждаются и анализом физикохимических свойств ионных расплавов. Так, их высокая вязкость при больших концентрациях SiO2 обусловлена присутствием полимеризованных ионов Si xOzy . Высокие значения поверхностного
натяжения (300–600 мДж/м2) свидетельствуют об отсутствии в шлаках молекул с насыщенными внутренними связями. Поверхностное натяжение молекулярных жидкостей не превышает 50 мДж/м2. Если бы в оксидном расплаве были незаряженные молекулы даже в малых концентрациях, то, имея слабое силовое поле, они вытеснялись бы в поверхностный слой, снижая ζ до десятков мДж/м2.
Электрическая проводимость большинства шлаков составляет 0,1–1,0 Ом-1·см-1 и возрастает с повышением температуры, что характерно для ионных расплавов. Только при высокой концентрации ионов переменной валентности железа, марганца, хрома, ванадия оксидные и оксисульфидные расплавы наряду с ионной обладают сравнительно высокой электронной проводимостью. По величине электронной проводимости их можно отнести к полупроводникам.
8.12. Физико-химические свойства шлаков
Плотность и мольные объемы
Плотность и мольный объем являются структурно-чув- ствительными свойствами. Обычно изучают их зависимость от состава и температуры. Влияние состава определяется в основном изменением коэффициента упаковки или координационного числа и характеризуется изменением свободного объема. Зависимость от температуры связана с изменением межатомного расстояния вследствие увеличения амплитуды колебания атомов. Обе эти характеристики необходимы для расчетов кинетических свойств ионных расплавов, таких, как вязкость, электрическая проводимость, коэффициенты диффузии.
163
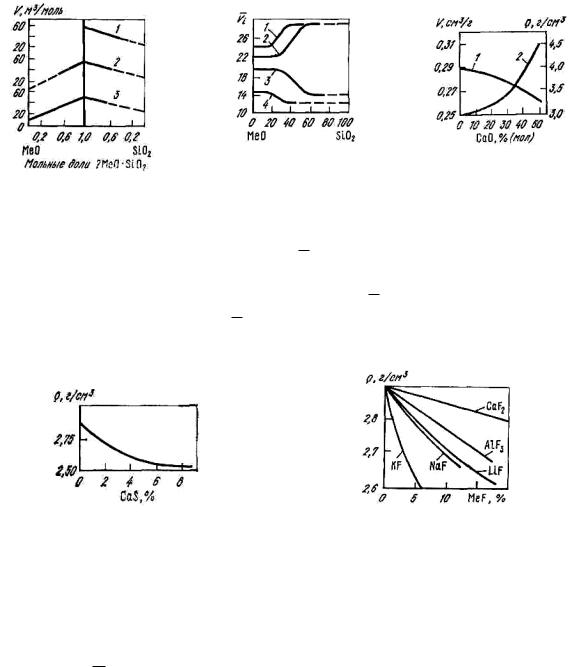
Вблизи температур плавления плотность FeO составляет 4,8
(1673 K), SiO2 – 2,07 (2033 K) и MnO – 4,60 г/см3 (2123 K). Парциальные мольные объемы компонентов в системе MnO–SiO2 практически постоянны во всем диапазоне составов, а в расплавах CaO–SiO2 и FeO–SiO2 они изменяются лишь вблизи соединений (рис. 8.11, 8.12). Эти изменения свидетельствуют о перестройке структуры расплава вблизи составов, соответствующих ортосиликатам.
Рис. 8.11. Изотермы мольных объемов квазибинарных расплавов
MeO– Me2SiO4 иMe2SiO4– SiO2 при 1673K: 1 – CaO–
SiO2; 2 – MnO–SiO2; 3 – FeO–SiO2
Рис. 8.12. Парциальномольные объемы компонентов в расплавах MeO–
SiO2: 1,2 – VSiO2 соответственно в расплавах FeO– SiO2 и CaO–SiO2; 3 – VCaO ;
4 – VFeO
Рис. 8.13. Влияние замены FeO на CaO в системе CaO–FeO– SiO2 на плотность
(1)и удельный объем
(2)расплава
Рис. 8.14. Зависимость плотности |
Рис. 8.15. Влияние содержания |
||
расплавов системы CaO–SiO2–CaS |
|||
фторидов |
на плотность системы |
||
от содержания CaS |
CaO–Al2O3 |
при 1550 °C |
|
|
|||
Парциальные мольные объемы компонентов в тройных и более сложных системах при данном содержании SiO2 вдали от соединений слабо изменяются при изменении состава. Это позволяет использовать
значения Vi , полученные для бинарных сплавов, к описанию концентрационной зависимости объемов в более сложных системах:
164
k |
|
||
V xi |
|
i . |
|
V |
(8.22) |
||
i=1 |
|
||
Мольные объемы квазибинарных систем MnO–Me2SiO4 |
и SiO2– |
||
Me2SiO4 линейно изменяются при изменении состава (рис. 8.11). Влияние замены FeO на CaO в системе CaO–FeO–SiO2 на
плотность ρ и удельный объем расплава, содержащего 21–25 % SiO2, приведены на рис. 8.13. На рис. 8.14 показано влияние CaS на плотность шлака при основности 1,0. На рис. 8.15 приведено влияние фторидов на плотность расплавов системы CaO–Al2O3–MeF.
Поверхностные свойства
Значения поверхностного натяжения чистых оксидов вблизи точек плавления довольно высоки, мДж/м2: SiO2 – 390, MnO – 620, FeO
–630, Al2O3 – 670.
Вбольшинстве бинарных систем поверхностное натяжение линейно изменяется с концентрацией, причем замена одного основного
оксида другим мало сказывается на значениях ζ, а добавление SiO2 вызывает его линейное снижение (рис. 8.16, 8.17). Сравнительно слабые изменения ζ при изменении состава обусловлены особенностями строения оксидных расплавов, состоящих из сравнительно крупных
анионов кислорода, между которыми размещаются катионы металлов: Fe2+, Ca2+, Mn2+, Mg2+, Si4+, Р5+. При введении в оксидный расплав
сульфидов, даже в случае близких значений энергии связи Me–O и Me– S, поверхностное натяжение снижается, так как радиус аниона серы больше, чем кислорода и на каждой единице поверхности разместится меньше молей сульфида, чем молей оксида (рис. 8.18).
При описании поверхностного натяжения двухкомпонентных и более сложных оксидных расплавов можно использовать уравнение:
k |
|
V |
|
||||
xiexp |
i |
i |
|
|
, |
(8.23) |
|
|
|
|
|||||
i=1 |
|
RT |
|
V |
|
|
|
где i ; – парциально-мольная поверхность;
165
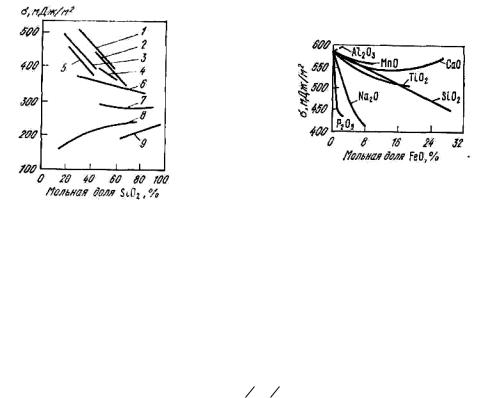
Рис. 8.16. Изотермы поверхностного |
Рис. 8.17. |
Поверхностное |
||
натяжения |
бинарных |
расплавов |
натяжение |
расплавов, |
MeO (Me2O)–SiO2 вблизи ликвидуса: |
содержащих |
оксид железа, |
||
1 – FeO–SiO2; 2 – Mn–SiO2; 3 – CaO– |
при 1400 oC |
|
||
SiO2; 4 – Mg–SiO2, 5 – BaO–SiO2; 6 – |
|
|
||
Li2O–SiO2; 7 |
– Na2O–SiO2; |
8 – PbO– |
|
|
SiO2; 9 – K2O–SiO2
fN2 3 |
|
2 3 |
; |
(8.24) |
|
V |
|||||
i |
A i |
|
|
||
i – работа выхода i-гo компонента из объема раствора на поверхность:
i i i i RTln i , |
|
(8.25) |
где i ; – поверхностное натяжение чистого i-го компонента; |
i |
– его |
мольная поверхность; α – структурный коэффициент, определяющий долю недостающих связей у частицы на поверхности; i – коэффициент
активности; V , V – мольные объемы растворов соответственно в поверхностном слое и в объеме при равновесии.
Строго говоря, уравнение (8.25) получено для описания поверхностных свойств металлических расплавов. При описании поверхностного натяжения двухкомпонентных и более сложных оксидных систем уравнением (8.25) оказалось, что работа выхода компонентов слабо меняется при изменении состава.
166
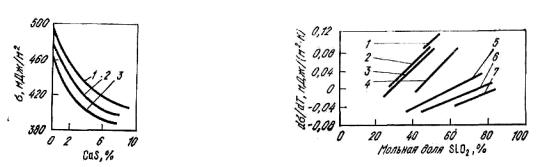
Рис. 8.18. Влияние содержания CaS |
Рис. 8.19. Температурные коэффи- |
||||
на |
поверхностное |
натяжение |
циенты |
поверхностного |
натяжения |
расплавов: 1,2,3 – основность шлака |
бинарных |
оксидных |
расплавов: |
||
соответственно 1,2; 1,0; 0,8 |
1 – MgO–SiO2; 2 – MnO–SiO2; 3 – FeO– |
||||
|
|
|
SiO2; 4 – CaO–SiO2; 5 |
– Li2O–SiO2; |
|
|
|
|
6 – Na2O–SiO2; 7 – K2O–SiO2 |
|
|
Это позволяет использовать для приближенных расчетов поверхностного натяжения шлаков уравнения:
|
|
|
|
|
RT |
|
|
k |
|
|
|
||
i |
|
|
ln |
xiFi ; |
(8.26) |
||||||||
|
|||||||||||||
|
|
|
|
|
|
|
i 1 |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||
x |
|
|
xi F |
|
|
; |
|
|
|
(8.27) |
|||
|
k |
|
|
|
|
|
|
|
|||||
|
i |
|
|
|
|
|
|
|
|
|
|
||
|
|
xi Fi |
|
|
|
|
|
|
|||||
|
|
i 1 |
|
|
|
|
|
|
|
|
|
||
Fi exp |
|
|
|
|
|
, |
(8.28) |
||||||
|
i |
|
|
1 |
|
||||||||
|
|
|
|
|
RT |
|
|
|
|
||||
где xi – мольная доля i-го компонента в поверхностном слое.
С повышением температуры поверхностное натяжение изменяется практически линейно (рис. 8.19).
Вязкость
Вязкость – структурно-чувствительное свойство, являющееся важной кинетической характеристикой расплавов, имеющей теоретическое и практическое значение. Вязкость шлаков находится, как правило, в пределах 0,1–1,0 Па·с, что на два порядка и более выше вязкости жидких металлов. Это объясняется наличием в шлаках сравнительно крупных единиц течения в виде кремнекислородных комплексов различной степени сложности. Зависимость вязкости от температуры описывается уравнением:
167
|
E |
|
|
A exp |
|
. |
(8.29) |
|
|||
|
RT |
|
|
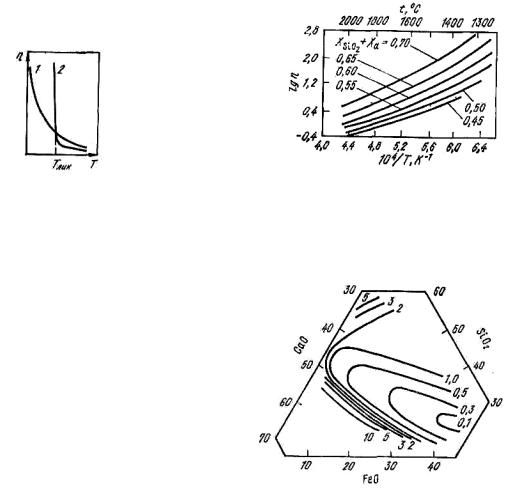
На рис. 8.20 приведена зависимость вязкости от температуры кислых (1) и основных (2) шлаков. Влияние температуры на вязкость алюмосиликатных расплавов в зависимости от их состава приведено на рис. 8.21. Вязкость системы CaO–SiO2–FeO–Al2O3 при 10 % Al2O3 и 1300 °C представлена на рис. 8.22.
Рис. 8.20. Зависимость вязкости |
Рис. 8.21. Зависимость вязкости |
от температуры кислых (1) и |
алюмосиликатных расплавов от |
основных (2) шлаков |
температуры и состава |
Рис. 8.22. Диаграмма вязкости шлаков системы CaO–SiO2–
FeO–Al2O3 при 10 % Al2O3 и 1300oC
Диффузия в ионных расплавах
Знание коэффициентов диффузии Di необходимо при анализе кинетики высокотемпературных гетерогенных реакций с участием шлака: скорости этих процессов часто лимитируются диффузионными звеньями.
168
Плотность диффузионного потока JD |
частиц i-го сорта можно |
|||||
|
|
|
|
|
i |
|
определить соотношением: |
|
|
|
|
|
|
JD |
Di |
C |
|
d |
. |
(8.30) |
|
|
|||||
i |
RT |
|
i dx |
|
||
В ионных расплавах диффузионный поток ионов обусловлен не только градиентом химического потенциала, но и электростатическими
силами. Плотность полного потока заряженных частиц Ji |
определяется |
градиентом электрохимического потенциала i , как |
|
i i ZiF , |
(8.31) |
где i – химический потенциал i-й частицы; Zi |
– ее заряд; |
– электрический потенциал фазы; F – постоянная Фарадея.
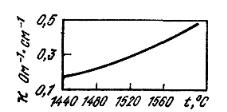
Рис. 8.23. Зависимость электрической проводимости шлака,
содержащего 50,05 % SiO2; 9,9 % Al2O3; 50,05 % CaO от температуры
В общем случае справедливо выражение:
J |
|
|
Di |
C |
|
d i |
. |
(8.32) |
|
|
|
||||||
|
i |
|
RT |
|
i dx |
|
||
Удельная электрическая проводимость χ характеризует способность ионов сорта i переносить электрический заряд под действием градиента электрохимического потенциала. Диффузия ионов одного знака может привести к накоплению электрического заряда на межфазных границах, т.е. к появлению градиента потенциала d 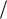 dx .
dx .
Количественная связь Di и η может быть описана соотношением:
Dn const ; |
(8.33) |
i |
|
169
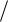
где n E 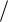 ED .
ED .
Температурная зависимость удельной электрической проводимости выражается уравнением:
0 exp E |
RT . |
(8.34) |
На рис. 8.23 представлена температурная зависимость электрической проводимости шлака системы CaO–SiO2–Al2O3.
При содержании оксидов переходных металлов более 10 % шлаки становятся смешанными проводниками. В ряде случаев может преобладать доля электронной проводимости, что может быть объяснено нарушением стехиометрии расплава.
170
