
основы меаллургических процессов
.pdf
1 |
|
|
0 |
|
|
c |
0 |
co |
|
|
|
f |
|
f 2 |
|
|
|
. |
(6.49) |
||
|
|
|
|
|
|
|||||
A |
|
D |
|
|
|
0 0 |
|
|||
Химический режим восстановления реализуется обычно при сравнительно невысоких температурах и очень пористом продукте восстановления. При этом перепад концентраций газа-восстановителя по толщине слоя продукта будет практически отсутствовать (рис. 6.7). Суммарная скорость процесса равна скорости химической реакции при c = c0. Кроме того, химический режим реагирования при восстановлении твердых оксидов металлов возможен также на начальных стадиях процесса, когда еще не образовался значительный слой продукта восстановления. Выражение для общей скорости процесса будет иметь вид:
x kr0T 1 1 KP Si c0 co . |
(3.50) |
Для сферической частицы скорость процесса (при T = const, c0 = |
|
const) может быть представлена уравнением: |
|
dg d kS , |
(6.51) |
где k – коэффициент пропорциональности; g – масса прореагировавшего оксида.
На основании вышеизложенного поверхность реагирования будет
равна: |
|
|
|
|
|
|
|
|
|
|
4 r0 fr0 2 . |
|
(6.52) |
||||
Масса прореагировавшего оксида будет: |
|
|
||||||
g 4 3 r03 0 4 3 r0 |
fr0 3 0 . |
(6.53) |
||||||
Тогда |
|
|
|
|
|
|
|
|
|
dg |
4 r |
r |
fr |
2 |
df |
. |
(6.54) |
|
|
|
||||||
|
d |
0 0 |
0 |
0 |
|
d |
||
|
|
|
|
|
|
|
||
131

С учетом выражения (6.53) и после интегрирования кинетическое уравнение имеет вид:
r0 0f k . |
(6.55) |
Для удобства обработки экспериментальных данных используют уравнение:
r |
1 1 13 |
|
k |
. |
0 |
0 |
|
|
В ряде случаев для расчетов используется связывающее f и η (уравнения (6.54) или (6.56)).
Поскольку r0/D значительно меньше, чем 1/A, слагаемым в выражении (6.48) можно пренебречь. Тогда
fA c0 co .
0r0
Если ввести параметр времени, равный:
x |
|
|
0r0 |
|
||
A c0 |
co , |
|||||
|
|
|||||
то
f  x ,
x ,
(6.56)
выражение,
то вторым
(6.57)
(6.58)
т.е. относительное продвижение фронта реагирования пропорционально времени реагирования. Или, другими словами, толщина восстановленного слоя растет линейно во времени. Необходимо отметить, что экспериментальные данные показывают зависимость скорости продвижения фронта реагирования от многих факторов. Для восстановления оксидов железа при 1000 °C она составляет
~0,05 мм/мин.
Рассмотренный режим восстановления может быть реализован, если оксидная фаза плотная и имеется четкая граница фаз, а также в случае свободного доступа газа-восстановителя ко всем плотным зернам, составляющим пористую макрочастицу. В последнем случае r0
– радиус зерна и скорость восстановления не зависит от радиуса.
132
Глава 7 ЗАКОНОМЕРНОСТИ НАУГЛЕРОЖИВАНИЯ МЕТАЛЛОВ
7.1. Науглероживание железа оксидом углерода
Восстановительная среда, состоящая из СО и СО2, обладает способностью не только восстанавливать оксиды до металлов, но и образовывать углеродосодержащие конденсированные фазы с участием этих металлов. С одной стороны это связано с возможностью распада СО и выделения C, с другой стороны – со способностью металлов образовывать растворы и соединения с углеродом.
В отсутствии металла имеем выражения:
2CО Ств |
СО2 ; |
К |
pCO |
аC |
. |
(7.1) |
|
2 |
|||||
|
|
1 |
p2 |
|
|
|
|
|
|
|
CO |
|
|
Вприсутствии металла, в зависимости от его природы, состава газовой фазы и внешних условий могут образовываться различные углеродосодержащие конденсированные фазы.
Они являются нежелательными, если ставится задача получения чистого металла.
Вто же время в технике имеет широкое распространение процесс специального науглероживания поверхности металлов, их цементации различными углеродосодержащими средами, карбюризаторами, которые могут быть газообразными, жидкими и твѐрдыми.
После дополнительной термообработки в этом случае обеспечивается повышение поверхностной твѐрдости изделий при достаточной вязкости материала в объѐме.
Наиболее подробно изучены Fe3C, Fe2C, Fe4C. Из них при температурах восстановления железа имеет значение карбид Fe3C, входящий в состав сплавов железа в виде структурной составляющей – цементита.
Fe2C получается при обработке Fe2O3 или Fe оксидом углерода в области температур до 225 ºC; при 300-400 ºC Fe2C переходит в Fe3C (цементит).
Fe3C неустойчив при T > 1000 K, однако может образовываться как промежуточное соединение.
Закономерности науглероживания или цементации железа могут быть выявлены на примере его взаимодействия с оксидом углерода
(рис.7.1).
133
2СО |
С |
CO2 ; |
|
|
K2 |
|
|
pCO2 |
|
a C |
; |
|
(7.2) |
|
|
|
|
p2 |
|
|
|||||||||
|
Fe |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
CO |
|
|
||
2CO 3Fe |
Fe C CO |
|
; |
К |
|
|
pCO2 |
|
aC Fe3C |
; |
(7.3) |
|||
|
3 |
|
|
p2 |
||||||||||
|
|
3 |
2 |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
CO |
|
|
|
2CO |
CFe C |
CO2 . |
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
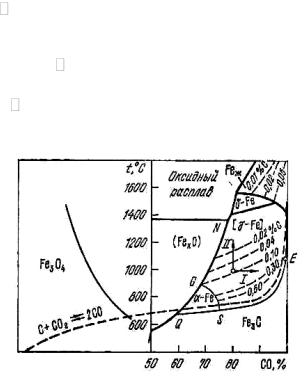
Рис. 7.1. Диаграмма равновесий науглероживания железа оксидом углерода
Для определения результатов взаимодействия газовой атмосферы с металлом необходимо рассмотреть углеродный потенциал газовой фазы πC. Он характеризует науглероживающую способность атмосферы относительно науглероживаемой конденсированной фазы и представляет собой величину химического потенциала углерода,
отсчитываемого от стандартного состояния, где aC = 1:
|
|
O |
|
|
|
pCO2 |
|
C |
C |
C |
C |
RT ln aC |
RT ln |
|
RT ln K1, (7.4) |
|
|||||||
|
|
|
|
|
|
pCO |
|
|
|
|
|
|
|
2 |
|
– активность углерода, которую создает газовая фаза в науглероживаемой конденсированной фазе. Свойства газовой фазы, как науглероживающей, можно выразить следующим образом:
|
С |
pC |
|
o |
|
|
|
|
а |
|
; |
pC aCpC |
; |
C RTln pC |
, |
(7.5) |
|
po |
||||||||
|
|
C |
|
|
|
|
|
|
134
|
– давление насыщенного пара углерода атомарного над |
где pC |
графитом, принимаемое как стандартное; pC – давление пара углерода атомарного над данной углеродсодержащей фазой с участием металла;
poC – то же, выраженное в долях pC .
Температурная зависимость K1 выражается уравнением:
lg K |
|
|
9001 |
9,28 . |
(7.6) |
|
|
|
|||||
1 |
|
T |
|
|
||
|
|
|
|
|
||
За стандартное состояние углерода в конденсированных фазах |
||||||
принят графит, т.е. должна учитываться реакция: |
|
|||||
Cгр |
3Fe Fe3C |
(7.7) |
||||
и энергия Гиббса этой реакции: |
|
|
|
|
||
G0 |
|
|
6380 |
5,92T ; |
(7.8) |
|
463 1115K |
|
|
|
|
||
G0 |
|
|
2475 |
2,43T . |
(7.9) |
|
1116 1808 |
|
|
|
|
||
Уравнение (7.7) позволяет определить активность углерода в Fe3C в равновесии с насыщенным раствором углерода в γ-Fe.
Энергию Гиббса Fe3C можно представить как сумму химических потенциалов:
GFe C CFe3C |
|
3 FeFe3C ; |
|
|
(7.10) |
|
|
3 |
|
|
|
|
|
oFe |
FeFe3C ; |
|
GFe c CFe3C |
|
3 oFe . |
(7.11) |
|
|
|
3 |
|
|
|
Если карбид Fe3C нестабилен и распадается на графит и насыщенный раствор углерода в железе, то
GFe C GCo |
|
3 oFe ; |
CFe3C GoC ; |
(7.12) |
||||
|
|
3 |
|
|
|
|
|
|
|
C |
Go |
RTln a |
C |
. |
(7.13) |
||
|
C |
|
|
|
|
|
||
Из уравнений (7.12) и (7.13) видно, что активность углерода в Fe3C больше, чем в графите.
Если за стандартное состояние принят графит, для которого aCгр 1, то для Fe3C aCFe3C 1.
135
Если посмотрим на рис. 7.1 науглероживания, то мы видим: область Fe (феррита) соответствует незначительному науглероживанию железа (до 0,032% при температуре 738 oC).
Область Fe (аустенита) характеризуется широким интервалом от содержаний <0,02 – до 2%. Эта область является рабочей областью условий для процессов цементации, поэтому она исследована наиболее полно.
Области Fe |
|
и |
Feж |
характеризуются |
малым |
содержанием |
||||||||||||
углерода в растворах. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Из уравнения при p 0,1 МПa : |
|
|
|
|
|
|
||||||||||||
KP |
|
pCO2 |
|
|
|
|
|
%CO 2 |
p |
; |
(7.14) |
|||||||
pCO |
2 |
aC |
100 %CO aC 100 |
|||||||||||||||
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
1 |
|
|
|
|
%CO |
2 |
p |
|
|
|
|
|||
a |
|
|
|
|
|
|
|
|
|
|
, |
|
|
(7.15) |
||||
C |
|
KP |
100 %CO 100 |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
||||||||||
можно определить активность aC , которая особенно важна для области аустенита Fe .
Величина aC может быть определена и без KP непосредственно из цементационной диаграммы с использованием линий равновесия, как
a |
C |
(p2 |
/ p |
CO |
|
) |
C,Fe |
/(p2 |
/ p |
CO |
) |
C |
. |
|
CO |
|
2 |
|
CO |
|
2 |
гр |
|||||
|
|
|
|
|
|
|
|
|
|
|
Таким образом, зависимость aC f CO/ CO2 является простой и
не вызывает затруднений в ее определении по диаграмме. То есть мы видим, что для определения активностей необходимы наиболее точные экспериментальные данные для диаграммы равновесий науглероживания.
Цементационная диаграмма удобна для выбора условий науглероживания и обезуглероживания железа в зависимости от основных факторов – состава газовой фазы и температуры. Она позволяет в количественной форме определить результаты процесса. Из нее видно влияние повышения содержания CO в газовой фазе.
Предельное науглероживание происходит при смещении условий в область Fe3С, предельное обезуглероживание – при достижении области α–Fe (феррита) и составов γ–Fe (аустенита) вблизи области вюстита.
136

Кривая, разделяющая области вюстита и аустенита, отражает одновременно протекающие превращения:
3FeO 3CO |
3Fe 3CO2 , |
3Fe 2CO |
Fe3C CO2 , |
а также
3FeO 5CO |
Fe3C 4CO2 . |
Фактор давления для таких систем должен отразиться на величине углеродного потенциала газовой атмосферы. Это может быть учтено количественно при выражении в уравнении для πC состава газа через объемные проценты:
|
|
RTln %CO 2 |
|
|
p |
RTln K . |
(7.16) |
|
C |
|
|
||||||
|
%CO2 |
|
|
100 |
1 |
|
||
|
|
|
|
|
||||
При повышении давления равновесные линии смещаются в сторону более низких содержаний CO в газовой фазе. При понижении давления – смещаются в другую сторону. Углеродный потенциал снижается.
Этот аспект влияния давления важен для металлов, имеющих повышенное химическое сродство к углероду и легко образующих в процессах восстановления карбиды с высокой термодинамической устойчивостью. В отличие от железа и других металлов, образующих термодинамически неустойчивые карбиды (Mo → Mo2С; Co → Co3C; Mn → Mn3C), активность углерода в них меньше, чем у графита и понижается в последовательности: Al4C3; CoC2; Cr23C6; Mn3C; SiC; ZrC; TiC.
Наличие таких примесей в сплавах железа влияет на результаты цементации, повышая содержание [C] в Fe, т.е. понижая активность углерода в Fe.
Для промышленных систем науглероживания протекает обычно в присутствии твердого углерода (имеющегося в избытке). Процесс происходит через газовую фазу, состав и свойства которой определяются наличием углерода. Пределы науглероживания при этом устанавливаются положением на цементационной диаграмме кривой газификации углерода относительно границ существования
137

углеродосодержащих фаз. Изменение давления (для данного случая) не приводит к большим изменениям состава металла, так как линия равновесия реакции газификации перемещается одновременно с равновесными линиями для углеродсодержащих фаз железа. Некоторых изменений результатов можно достичь изменением активности твердого углерода.
7.2. Науглероживание железа метаном
Активными карбюризаторами металла являются углеводороды, которые при нагревании диссоциируют на углерод и водород, например для CH4:
CH |
4 |
C |
2H |
2 |
; Ho |
75130Дж ; Go 46240 26,96T (Дж). |
|
ГР. |
|
298 |
|
Образующиеся газовые атмосферы, вследствие смещения равновесия реакции диссоциации направо с повышением температуры и понижением давления, увеличивают при этом свой углеродный потенциал. Таким образом, влияние этих факторов противоположно тому, которое имеет место для реакции распада оксида углерода.
Эти особенности метана проявляются и в реакциях науглероживания с его участием, являющихся эндотермическими:
CH4 C 2H2 ; |
+ H; |
(7.17) |
|
CH4 3Fe |
Fe3C 2H2 ; |
+ΔH. |
(7.18) |
Выражение константы равновесия является одинаковым для всех реакций науглероживания в данной системе и имеет вид:
|
|
|
p2 |
a |
C |
|
|
K |
|
|
H2 |
|
. |
(7.19) |
|
7.17 |
pCH |
|
|||||
|
|
|
|
|
|||
|
|
|
|
|
|
||
|
|
|
|
4 |
|
|
|
На диаграмме цементации метаном (рис. 7.2), в отличие от аналогичной диаграммы для цементации оксидом углерода, отсутствуют области оксидов железа, так как в газовой фазе не содержатся окислители. Области α-Fe и Fe3C имеют на диаграмме большую протяженность при сужении области существования аустенита. Она расположена при малых содержаниях CH4. Это свидетельствует о высокой науглероживающей способности метана и в
138
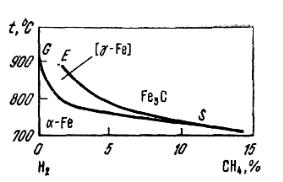
то же время о необходимости точного контроля состава газа для получения заданного содержания углерода.
Направление равновесных линий на диаграмме соответствует знаку теплового эффекта реакций науглероживания железа метаном. С понижением температуры расширяется область обезуглероживания железа с получением малоуглеродистой фазы α-Fe. Равновесное содержание углерода в ней будет тем ниже, чем меньше примеси метана в водороде. Величина коэффициента активности углерода и в этом случае определяется относительно стандартного состояния углерода – графита. При пересчете активностей на молярные или процентные доли углерода необходимо (это касается и системы с CO и CO2) учитывать концентрации углерода в аустените, соответствующие активности углерода, равной 1.
Рис. 7.2. Диаграмма равновесий науглероживания железа метаном
Практически процесс обезуглероживания поверхностных слоев железа реализуется при так называемом светлом отжиге. Состав газовой фазы и температура при этом подбираются такими, чтобы окислялся лишь углерод, а поверхность железа оставалась неокисленной (светлой). В атмосфере H2–CH4 такие условия обеспечиваются отсутствием в карбюризаторе окислительных составляющих. При использовании в качестве карбюризатора CO имеющаяся или появляющаяся по реакциям цементации составляющая газовой смеси CO2 вызывает при изменении условий опасность окисления одновременно с углеродом и железа. В этом случае реализуется так называемый темный отжиг с образованием на поверхности металла пленки вюстита.
139
Глава 8 МЕТАЛЛУРГИЧЕСКИЕ РАСПЛАВЫ
8.1. Общая характеристика металлургических расплавов
Многие металлургические процессы протекают с участием жидких фаз: металлической, оксидной (шлаковой), сульфидной (штейновой), солевой (галогениды металлов и соли кислородных кислот). Взаимодействие между жидкими фазами, а также с обычно присутствующей газообразной фазой зависит от структуры (строения) и свойств металлургических расплавов.
В соответствии с принятой классификацией жидкостей, учитывающей их природу и строение, их подразделяют на следующие виды: 1) с водородными связями (вода, спирты, органические кислоты); 2) с молекулярными связями (бензол, расплавленные парафины, нафталин и др.); 3) с ионными связями (оксидные и сульфидные расплавы, расплавы солей, водные растворы солей, кислот, щелочей); 4) металлические, для которых характерно взаимодействие катионов со свободными электронами.
Оксидные и сульфидные расплавы, участвующие в металлургических процессах, являются многокомпонентными жидкостя-ми, для которых характерно сложное строение. Причем во многих случаях в них наряду с преимущественно ионной межчастичной связью проявляется и ковалентная связь, что предопределяет их микронеод-нородное строение. Для расплавленных солей, относящихся также к ионным жидкостям, характерно сильное межчастичное взаимодействие и высокая концентрация ионов в единице объема. В сложных солевых расплавах также неисключено проявление микронеоднородного строе-ния, связанное с образованием комплексных ионов, т.е. возникновением ковалентных связей.
Чистые жидкие металлы имеют относительно простое строение, в отличие от промышленных металлических расплавов, которые являются многокомпонентными жидкостями, включающими не только металлические, но и металлоидные составляющие. Это обстоятельство и предопределяет их сложное строение.
Под структурой или строением металлургических расплавов понимают количественное описание взаимного расположения в пространстве составляющих их частиц, т.е. в случае жидких металлов – атомов, а у оксидных и сульфидных расплавов – ионов. Взаимное расположение в пространстве частиц будет обусловливаться характером и величиной сил взаимодействия между ними. В свою очередь,
140
