
основы меаллургических процессов
.pdf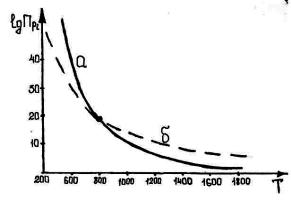
объясняется тем, что по абсолютной величине Ho298 (1.27) > Ho298 (1.37).
2. При температуре 810 °C кривые на рис. 1.2 пересекаются, и это значит, что KP (1.27) = KP (1.37), следовательно, ∆G (1.27) = ∆G (1.37).
Рис.1.2. Логарифмическая зависимость парциального давления газов от температуры: a – горение CO, б – горение H2
PO2 (CO2 ) = PO2 (H2O) , следовательно, |
%CO2 2 |
%H2O 2 |
||
%CO |
2 |
%H2 |
2 . |
|
|
|
|
||
Поэтому при 810 °C и одинаковых исходных концентрациях CO и H2, обладают одинаковым сродством к O2, или CO 2 и H2O одинаково прочные.
3. При температуре более 810 °C константа равновесия реакции (1.27) становится меньше константы равновесия реакции (1.37), следовательно, при высоких температурах H2 обладает большим сродством к O2, чем CO, или H2O прочнее, чем CO2. С повышением температуры неравенство указанных величин увеличивается. В области температур ниже 810 °C получается обратное соотношение.
1.11. Реакция водяного газа
СO2(г) + Н2(г) → CO(г) + H2O(г) – эндотермическая; (1.40)
Ho298 = 9838 кал.
Эту реакцию можно представить как сумму последовательно протекающих превращений:
21

2CO2 2CO O2
+
2H2 O2 2H2O
_______________________________
2CO2 2H2 O2 2CO O2 2H2O
Такая запись эквивалентна другой записи:
2H2 O2 2H2O H2
–
2CO2 2CO O2 H3
_______________________________
2H2 2CO2 2H2O 2CO 2ΔH4
По закону Гесса тепловые эффекты суммируются в таком же порядке, как и реакции:
H |
|
|
|
|
1 |
H |
|
H |
. |
(1.41) |
|
4 |
|
|
|
2 |
|||||||
|
|
|
2 |
|
3 |
|
|
||||
|
|
|
|
|
|
|
|
|
|||
Так как ∆G не зависит от пути процесса, то можно проводить |
|||||||||||
такие же действия: |
|
|
|
|
|
|
|
|
|
|
|
G4 |
1 |
G2 G3 ; |
(1.42) |
||||||||
2 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
||
G2 G3 2 G4 .
Выразив в уравнении (1.42) ∆G4 через стандартные величиныGo 4,476Tlg KP и сократив на – 4.576Т, получим:
lg K4 |
1 |
lg K |
2 lg K3 ; |
(1.43) |
||||||
2 |
||||||||||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||||
K4 |
|
K2 |
|
|
|
|||||
|
K |
. |
|
(1.44) |
||||||
|
|
|
|
|||||||
|
|
|
|
|
3 |
|
|
|
|
|
При расчетах равновесия термодинамические величины (∆H; ∆G; KP) суммируются в таком же порядке, как и уравнения реакций:
22
KP |
|
PH2OPCO |
f T . |
(1.45) |
||
PCO2 |
PH2 |
|||||
|
|
|
|
|||
Выразим парциальное давление через объемные проценты, %i:
K4 |
|
%CO %H2O |
|
||
|
|
. |
(1.46) |
||
%CO2 |
|
||||
|
|
%H2 |
|
||
В данном уравнении Pобщ не фигурирует. Это связано с тем, что реакция при не слишком высоких давлениях протекает без изменения объема. По принципу Ле-Шателье давление не влияет на равновесие.
Так как при 810 °C Kp(2) = Kp (3), следовательно, будут равны энергии Гиббса: ∆G(2) = ∆G(3), то из уравнения (1.44) и (1.42) следует,
что Kp реакции (1.40) при 810 °C будет =1, а ∆G = 0, это означает, что если все четыре реагента находятся в стандартном состоянии, то при температуре 810 °C система равновесна.
Если KP4 = 1, ∆G = 0, то система обратима. Реакция эндотер-
мическая и в соответствии с принципом Ле-Шателье, с повышением температуры равновесные концентрации CO и H2O увеличиваются, следовательно, CO2 и H2 уменьшаются, то есть KP4 будет расти.
В широком интервале температур KP не сильно отличается от 1, реакция, следовательно, обратимая (табл. 1.3).
Таблица 1.3
Логарифмическая зависимость константы равновесия от температуры для реакции водяного газа
Т, К |
lgK4 |
K4 |
500 |
– 2.057 |
0.009 |
1000 |
– 0.135 |
0.739 |
1083 (810 ºC) |
0 |
1 |
1500 |
0.435 |
2.72 |
2000 |
0.647 |
4.73 |
2500 |
0.866 |
7.34 |
С помощью правила фаз найдем, сколькими величинами нужно задаться для определения равновесного состава газа.
K = 3; Ф = 1; C = K–Ф+2 = 3–1+2=4.
23

Следовательно, для определения равновесного состава газа нужно задать 4 параметра (температура, давление и две концентрации). Так как реакция идет без изменения объема, то влиянием давления можно пренебречь.
1.12.Термодинамика реакции горения с участием твердого углерода
Реакция горения углерода с CO2:
C(гр) + CO2(г) → 2CO(г), ∆Нº298 = 41080 кал. (1.47)
Графит окисляется за счет CO2 с поглощением тепла, этот процесс играет важную роль в шахтных печах, но так же идет обратная реакция:
2CO(г) → C(гр) + CO2(г),
в восстановительных металлургических процессах. Необходима оценка состояния равновесия.
C = K – Ф + 2 = 2 – 2 +2 = 2.
Равновесная концентрация:
%СО = f(Т, p). |
(1.48) |
Она не зависит от концентрации исходного газа, так как реакция эндотермическая, повышение температуры смещает равновесие вправо, то есть равновесная концентрация CO увеличивается, а концентрация CO2 уменьшается. В гетерогенных реакциях изменение объема определяется только разностью числа молей газообразных веществ: продуктов и реагентов.
Данное превращение сопровождается повышением объема. С повышением давления равновесие сместится влево.
P2
KP CO ; (1.49)
PCO2
lg K1 |
|
8916 |
9,113 . |
(1.50) |
|
T |
|||||
|
|
|
|
24
Таблица 1.4
Логарифмическая зависимость константы равновесия от температуры горения с участием твердого углерода
T, K |
lgKp |
500 |
– 8.7 |
1000 |
0.2 |
1500 |
3.19 |
2000 |
4.65 |
3000 |
6.16 |
Из таблицы 1.4 следует, что при повышении температуры Kp увеличивается. Вблизи 1000 K, примерно 700 °C, KP = 1, то есть в зоне умеренных температур, реакция идет обратимо. В области высоких температур реакция идет необратимо в сторону образования CO, так как K1 >> 1. Соответственно при низких температурах реакция идет в противоположном направлении.
Особенности выше приведенной реакции в том, что границы обратимости находятся в пределах от 400 до 1000 °C.
1.13. Равновесный состав газа и направление протекания процесса
Из уравнения (1.49) выразим парциальные давления через объемные проценты, %i:
|
|
%CO 2 |
P |
|
%CO 2 |
P |
|
|
||
Kp |
|
|
P |
общ |
|
P |
общ |
. |
(1.51) |
|
%CO2 |
P 100 |
100 %CO P 100 |
||||||||
|
|
|
|
|
||||||
Впромышленных условиях смесь CO и CO2 образуется в результате взаимодействия твердого углерода, находящегося в избытке с кислородом воздуха, при этом в системе присутствует третий компонент – азот. В равновесном газе кислород отсутствует, так как процесс идет при его недостатке. Введение азота повышает число степеней свободы, и система имеет степень свободы C=3, следовательно, для определения равновесного состава газа нужно знать температуру, давление и концентрацию.
Впростом случае при наличии в газе CO и CO2 условие равновесия определяется уравнением (1.51), содержащим три величины, графически изображается в трехмерном пространстве (P, T, % CO) в виде изобары (рис. 1.3).
25
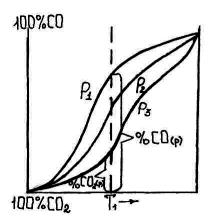
Рис. 1.3. Зависимость состава газовой смеси CO–CO2 от температуры и давления
Каждая точка на вертикальной оси одновременно показывает процентное содержание %CO и %CO2, так как их сумма равна 100. Пользуясь принципом Ле-Шателье, можно установить, что P1 < P2 < P3.
Из рисунка 1.3 видно, что при T1 = const изменению давления от P1 до P2 соответствует уменьшение объемного процентного содержания %CO и равновесие реакции (1.47) смещается влево, в сторону уменьшения объема.
|
%CO Ф2 |
Pобщ |
|
%CO P2 |
Pобщ |
|
||||||
G RT ln |
|
|
|
|
|
ln |
|
|
|
|
|
. |
%CO2 |
|
|
|
100 |
%CO2 |
|
|
|
100 |
|||
|
Ф |
|
P |
|
||||||||
|
|
|
|
|
|
|
|
|
||||
Если Робщ = const, то
|
|
2 |
|
|
2 |
|
|||
G RT ln |
%CO Ф |
ln |
%CO P |
. |
(1.52) |
||||
%CO2 |
|
|
|
||||||
|
Ф |
|
%CO2 |
|
|
|
|
||
|
|
|
|
|
|
P |
|
||
Нарисуем график, которым можно пользоваться для установления направления процесса (рис. 1.4).
26
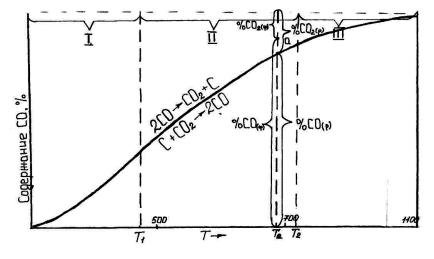
Рис. 1.4. Зависимость концентрации CO от температуры
Левое поле диаграммы соответствует реакции диссоциации CO, ниже кривой реакция взаимодействия с углеродом (С + СО2).
Рассмотрим фигуративную точку а, лежащую выше кривой равновесия, которая принадлежит неравновесной системе. Как видно из графика, объемные проценты COф больше процентов COр:
% CO2ф < %CO2р. |
(1.53) |
Из неравенства (1.53) следует, что
%CO 2 |
|
%CO 2 |
|
|||
|
Ф |
|
P |
. |
(1.54) |
|
%CO |
|
%CO |
|
|||
2 |
Ф |
|
2 |
P |
|
|
И по уравнению (1.52) следует, что
∆G = G2 – G1 > 0,
G2 > G1,
где G2 и G1 – значения изобарного потенциала у веществ в левой части химической реакции CO2 и C и в правой – CO.
Так как самопроизвольно процессы идут в сторону уменьшения ∆G, то реакция при указанных условиях протекает влево, таким образом, точки выше кривой характеризуют неравновесные системы, в которых возможен односторонний процесс распада CO, а точки ниже
27
кривой отвечают неравновесным системам, в которых возможна реакция:
C + CO2 → 2CO.
Исходя из этого, различают три области (рис. 1.4):
I – Область низких температур до 400 oC, KP << 1, равновесный газ содержит почти 100 % CO2. Изобара сливается с осью абсцисс, и реакция идет необратимо в сторону распада CO.
II – Область умеренных температур 400 – 1000 oC, KP ≈ 1, и в равновесном газе в одинаковых концентрациях содержится CO и CO2, реакция идет практически необратимо.
III – Область высоких температур более 1000 oC, KP >> 1, и равновесный газ содержит около 100 % CO, реакция идет необратимо в сторону образования CO:
C+ CO2 → 2CO.
1.14.Реакции неполного и полного горения углерода
Взаимодействие C с O2 может идти по двум направлениям:
2C(гр) + O2(г) → 2CO(г); |
∆Hº298(1) = – 53150 кал. |
(1.55) |
||
C(гр) + O2 → CO2(г); |
∆Hº298(2) = – 94220 кал. |
(1.56) |
||
Рассмотрим |
соотношение |
между |
термодинамическими |
|
параметрами в системе C и O2.
Непосредственно изучить равновесие реакции (1.55) и (1.56) невозможно, так как они необратимы и протекают совместно. Кроме того, эти процессы осложняются вторичными процессами, то есть CO,
образующееся по реакции (1.55) взаимодействует: |
|
|
2CO + O2 → 2CO2; |
∆H3; |
(1.57) |
CO2 + C → 2CO; |
∆H4. |
(1.58) |
Если реакции (1.55) и (1.56) находятся в равновесии, то в равновесии будут находиться и реакции (1.57), (1.58). Реакции (1.57) и (1.58) изучены экспериментально и их термодинамические характе-ристики используют для косвенного расчета равновесия реакций (1.55) и (1.56), которые экспериментально определить нельзя.
Если сложить реакции (1.57) и (1.58), то получим реакцию (1.56).
28
Все термодинамические параметры можно выразить в виде систем уравнений:
H1 H3 2 H4 ;H2 H3 H4
G1 |
|
G3 2 G4 |
|
|
|
|
|
|
|
||||||||
o |
|
|
o |
|
|
|
|
|
o |
|
|
|
|
|
|
|
|
Go Go Go |
|
; |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|||||||||||
2 |
|
3 |
|
|
|
|
|
4 |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
lg K1 lg K3 2lg K4 ; |
|
|
|
||||||||||||||
lg K2 lg K3 lg K4 |
|
|
|
|
|||||||||||||
K1 K3 K42 ; |
|
|
|
|
|
|
|
|
|
|
|||||||
K2 K3 K4 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
lg |
P2 |
|
|
11670 |
9,157 |
|
|
||||||||
lg K |
|
|
CO |
|
|
|
|
|
|
; |
|
||||||
|
|
|
|
|
|
|
|
|
|
||||||||
1 |
|
|
PO2 |
|
|
|
|
|
T |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Go |
53400 41,9T ; |
|
|
|
|||||||||||||
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
lg K |
|
lg |
|
PCO |
2 |
|
|
20586 |
|
0,044 |
; |
||||||
2 |
|
PO2 |
|
|
T |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Go2 94200 0,2T .
(1.59)
(1.60)
(1.61)
(1.62)
(1.63)
(1.64)
(1.65)
(1.66)
Таблица 1.5
Логарифмическая зависимость констант равновесия от температуры неполного и полного горения углерода
T, K |
lg K1 |
lg K2 |
500 |
32,60 |
41,20 |
1000 |
20,80 |
20,60 |
1500 |
16,93 |
13,74 |
2000 |
14,99 |
10,30 |
3000 |
13,05 |
6,91 |
Из таблицы 1.5 следует, что с повышением температуры константа равновесия KP обеих реакций уменьшается. Это объясняется экзотермичностью реакций.
29
Так как будет:
1.∆H2 > ∆H1 , то интенсивность изменения K2 больше K1;
2.В широком интервале температур KP реакции больше 1, следовательно, реакции необратимы, это говорит о нормальном сродстве углерода с кислородом;
3.При 700 oC ≈ 1000 K, KP1 = KP2, тогда
CO2 + C → 2CO, ∆G = 0,
следовательно, в соответствии с уравнениями (1.60) и (1.62) K1, K2 и K3 равны между собой, значит, и ∆G1 = ∆G2 = ∆G3. При температуре 700 oC нормальное сродство одинаково;
4.При температуре выше 700 oC Кр1 > Кр2 > Кр3 , то есть реакция (1.55) идет полнее, чем (1.56) и (1.57). С увеличением температуры эти неравенства усиливаются;
5.В области температур меньше 700 oC получают обратные соотношения.
30
