
основы меаллургических процессов
.pdf
плоскости. Электрон каждого атома участвует в связях со всеми тремя соседями. Поэтому каждая связь является двойной лишь на одну треть, а не на половину, как это имеет место у молекулы бензола. Силы взаимодействия между базисными плоскостями малы, если в последние включить и коллективизированные четвертые электроны атомов, и имеют характер вандерваальсовых (точнее дисперсионных).
Рис. 2.10. Распределение электронной плотности между базисными плоскостями графита
Кристалл графита можно рассматривать как слоистый своеобразный металл, роль катионов в котором играют базисные плоскости, а «свободными» электронами являются коллективизированные четвертые.
Изложенные особенности структуры графита позволяют объяснить ряд его характерных свойств.
Электропроводность. Как известно, электропроводность графита близка к таковой для металлов как по абсолютной величине (~ 103 Ом–1 см–1), так и по знаку температурного коэффициента. Последний составляет 4∙10–3 град–1. Металлический характер проводимости является следствием наличия коллективизированных электронов. Этим же вызвана и непрозрачность графита, в отличие от алмаза.
Механические свойства. В противоположность алмазу, являющемуся весьма твердым минералом, графит легко истирается. Его твердость – всего лишь 0,5–1 (по шкале Мооса). Однако эти числа характеризуют механические свойства графита лишь вдоль базисных плоскостей, по которым происходит скалывание слоев. В направлении, перпендикулярном базисным плоскостям, твердость значительно выше и равна 5–6. Значительная анизотропия механических свойств объясняется резким различием энергий связи внутри базисных плоскостей и между ними.
51
Слабая связь между базисными плоскостями в графите приводит к тому, что между ними могут внедряться атомы других элементов, следовательно, происходит объемное растворение или абсорбция. Так же имеет место поглощение веществ поверхностью (адсорбция).
Существует классификация комплексов поверхностных соединений, образованных при взаимодействии углерода и кислорода:
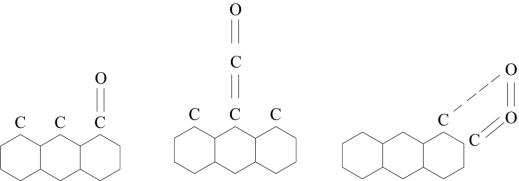
1. Кетогруппа (рис. 2.11 а).
Когда образуется кетокомплекс, адсорбированные атомы кислорода соединяются прочно с атомами углерода базисной плоскости, который связан с двумя соседними атомами углерода в кристаллической решетке.
а б в
Рис. 2.11. Адсорбция кислорода поверхностью углерода:
а) кетогруппа; б) кетенный комплекс; в) перекисный комплекс
2. Кетенный комплекс (рис. 2.11 б).
Кислород связан с атомом углерода в решетке через другой атом углерода. Этот комплекс менее прочен, чем в кетогруппе (рис. 2.11 а) и при температуре 600 oC разрушается с отрывом молекулы CO.
3. Перекисный адсорбированный комплекс (рис. 2.11 в).
На краевых атомах базисных плоскостей углерода удерживаются слабо деформированные молекулы кислорода. Разрушение такого комплекса идет с десорбцией CO2.
2.11. Взаимодействие углерода с кислородом
Существовали две точки зрения на возможность протекания реакции. Одни считали, что первоначально образуется углекислый газ CO2. Другие – что образуется угарный газ CO.
2C O2 2CO |
(2.39) |
||
– первичные реакции. |
|||
C O2 CO2 |
|
||
|
(2.40) |
||
52
2CO O |
|
2CO |
|
|
(2.41) |
|
2 |
2 |
– вторичные реакции. |
||||
|
|
|
||||
C CO2 2CO |
|
|
(2.42) |
|||
Первая теория возникла на основании экспериментальных данных, полученных в результате горения в неподвижном и малоподвижном слое углерода.
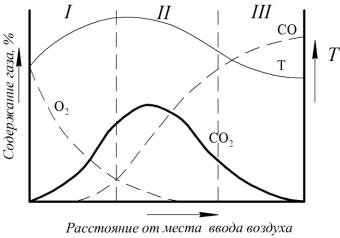
Из слоя горячего кокса на разных расстояниях от места ввода воздуха отбирали пробы газа, которые затем подвергали химическому анализу (рис. 2.12).
Рис. 2.12. Зависимость состава газовой смеси от концентрации вдуваемого кислорода и температуры
На основе исследований окислительную зону подразделяют на две части, I и II.
I – По мере расходования кислорода повышается температура и увеличивается содержание CO2, следовательно, этому следует экзотермическая реакция:
C O2 CO2 ,
которая считается первичной.
II – Кислород практически отсутствует, а уменьшение содержания CO2 сопровождается увеличением CO. Здесь развивается эндотермическая реакция (2.42).
III – Газовая смесь состоит из угарного газа и азота. Эта область называется восстановительной.
53

Согласно второй теории считается, что в начале образуется окись углерода CO, но в присутствии кислорода она очень быстро догорает до CO2 и фиксируется как продукт вторичного реагирования.
По второй теории полагают, что в первой области наблюдают суммарный результат двух неразделимых последовательных реакций:
C 12 O2 CO
CO 12 O2 CO2
CO2 CO2.
2.12.Механизм первичного реагирования
Для определения механизма первичного реагирования Лангмюр применил следующую методику.
Гладкую угольную нить нагревали до заданной температуры электрическим током. Помещали ее в запаянный сосуд, в котором создавали высокое разрежение. Малое давление, 10-2 мм рт. ст., обеспечивало быстрый отвод продуктов реакции от нити к стенкам сосуда.
Взаимодействие углекислого газа и углерода устранялось тем, что углекислый газ вымораживался на стенках сосуда, охлаждаемого снаружи жидким воздухом. Таким образом, прекращалась реакция (2.42) из-за малых концентраций реагентов.
Исследования показали, что получается смесь угарного CO и углекислого газа CO2, в которой с ростом температуры содержание CO2 уменьшается, а CO растет.
Механизмы взаимодействия идут по следующей схеме:
1. При низких температурах с поверхности графита выделяется CO2. Это объясняется разрушением перекисного комплекса (рис. 2.11 в). Реакция идет по следующему пути:
C(реш) O2(адс) CO2(г) . |
(2.43) |
2. При высоких температурах химическая адсорбция кислорода приводит к тому, что поверхность графита покрывается кетокомплексами (рис. 2.11 а), которые затем разрушаются по схеме:
54
2C |
O |
|
2 |
C |
O |
|
2CO . (2.44) |
|
(реш) |
|
2(г) |
|
|
(реш) |
|
|
|
|
|
|
(адс) |
|
||||
Следовательно, в результате образуется смесь с одинаковым содержанием CO и CO2.
C(реш) O(адс) C(реш) O2(г) CO(г) CO2(г) . (2.45)
2.13.Горение углерода в доменной печи и в слое материала
Вреальных условиях процессы осложнены вторичными реакциями и физическими явлениями (диффузией, теплообменом и др.)
1. Процессы в слое материала.
Процесс горения в слое углерода в первой части окислительной зоны представляется в следующем виде. При взаимодействии кусков
кокса с кислородом дутья одновременно возникает смесь CO2 и CO. Идет развитие гомогенной реакции:
2CO O2 2CO2 , |
(2.46) |
которая подтверждается тем, что куски горящего кокса окружены пламенем с характерным синим свечением. CO2 восстанавливается за счет углерода до CO (по уравнению 2.42), который затем догорает до
CO2.
Вывод. На всем пути движения газа в кислородной зоне происходит непрерывное догорание CO и его регенерация или превращение на твердой поверхности реакции (2.42).
Эта реакция является дополнительным источником окисления углерода и способствует увеличению скорости процесса.
2. Процессы в доменной печи.
Кокс горит в доменной печи в изолированных зонах, у фурм. Фурма – это устройство, при помощи которого в печь вводится
воздушное дутье, нагретое до 800 oC.
Вэти очаги непрерывно поступает сверху растворенный кокс, нагретый током газа до 1500 oC. В результате этого при горении возникают температуры выше 2000 oC.
Врезультате исследований было определено, что кокс горит перед фурмами не в слое, а во взвешенном состоянии. Следовательно, струя
55
дутья образует у фурм полости, в которых возникает вихревое движение газа, приводящее к циркуляции горячих кусков кокса.
В доменной печи окислительная зона состоит из двух частей:
I – область циркуляции (кислородная зона), глубина которой зависит от кинетической энергии дутья. Глубина зоны 1200–1500 мм;
II – область развития реакции:
C CO2 2CO .
Глубина области 100–200 мм.
Процесс горения в печи завершается необратимой при высоких температурах реакцией взаимодействия углерода с углекислым газом. Это говорит о том, что весь кислород дутья полностью прореагировал с углеродом и образовал CO, то есть суммарный процесс – это необратимая реакция неполного горения.
Таким образом, общее количество углерода, сгорающего в единицу времени, и производимость печи определяется количеством кислорода, вводимого в единицу времени, но не скоростью самого процесса.
56
Глава 3 ТЕОРИЯ ДИССОЦИАЦИИ И ПРОЧНОСТИ КАРБОНАТОВ
3.1. Термодинамика образования и диссоциации карбонатов
Карбонаты ряда элементов: Ca, Mg, Fe, Mn – при реагировании разлагаются на оксиды.
CaCO3 CaO CO2 .
Рассмотрим термодинамику соотношения:
MeO T |
|
CO2 |
MeCO3 T |
|
, H<0. |
|
|
|
|
Обратный процесс идет с поглощением тепла.
Рассмотрим случай: отсутствует растворение между твердыми фазами и веществами, то есть когда оксид и карбонат являются твердыми чистыми фазами. Общее количество фаз Ф=3 (MeO, CO2, MeCO3), количество компонентов K=2.
C K Ф 2 2 3 2 1.
Одновариантная система означает, что давление зависит только от температуры.
K |
|
a MeCO |
|
|
|||
|
|
|
3 |
, |
(3.1) |
||
a MeO |
a CO |
||||||
|
|
|
|||||
|
|
|
|
2 |
|
|
|
K |
1 |
|
f (T) , |
(3.2) |
|||
|
|
|
|||||
PCO2 |
|||||||
|
|
|
|
||||
P |
1 |
|
f (T) . |
(3.3) |
|||
|
|||||||
CO |
|
|
|
|
|
|
|
2 |
K |
|
Равновесное парциальное давление CO2 в реакции образования или диссоциации карбоната называется упругостью диссоциации карбоната.
Для оценки прочности карбонатов или нормального сродства оксидов с углекислым газом пользуются стандартным изменением энергии Гиббса G.
57
Go RT ln K |
, |
|
P |
|
|
Go RT ln P |
. |
(3.4) |
CO |
|
|
2 |
|
|
Из уравнения (3.4) упругость диссоциации PCO2 так же, как и –
G°, служит мерой сравнительной прочностью карбонатов.
Чем больше G, чем меньше PCO2 , тем выше сродство. С умень-
шением прочности карбонат способен полнее диссоциировать и упругость диссоциации при равновесии увеличивается.
При увеличении температуры константа KP равновесия экзотермической реакции уменьшается, а упругость диссоциации PCO2
возрастает, следовательно, прочность карбоната уменьшается.
О направлении реакции судят по знаку G и уравнению изотермы химической реакции:
G RT ln ПP |
ln K , |
|
|
|
|
|
|
||||||
|
|
|
|
|
i |
|
|
|
|
|
|
||
|
|
1 |
|
|
|
1 |
|
PCO |
|
|
|||
G RT ln |
|
|
|
ln |
|
RT ln |
|
2 |
. |
(3.5) |
|||
|
|
|
|
|
|
||||||||
|
PCO2 Ф |
|
|
|
|
PCO2 Ф |
|
|
|||||
|
|
PCO2 |
|
|
|
||||||||
Вывод. Знак G определяется |
соотношением |
значений |
PCO |
и |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
PCO2 Ф . |
|
|
|
|
|
|
|
|
|
|
|
|
|
Упругость диссоциации |
|
PCO |
отражает |
свойства карбоната |
и |
||||||||
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
зависимость от температуры (рис. 3.1), а давление фактическое не связано с температурой, а характеризует состав среды.
Рассмотрим следующие случаи:
1)PCO2 Ф PCO2 . В системе избыток CO2 по сравнению с
равновесной концентрацией. При этом из уравнения (3.5) видим, что G<0, следовательно, реакция идет в сторону образования карбоната;
2) PCO2 Ф PCO2 . Изменение энергии Гиббса больше нуля, процесс
смещается в сторону диссоциации карбоната;
3) PCO2 Ф PCO2 . Изменение энергии Гиббса равно нулю, система находится в равновесии.
58
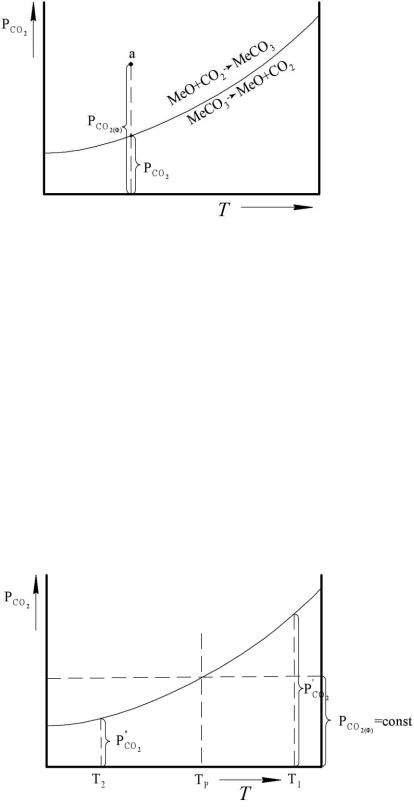
Рис. 3.1. Зависимость упругости диссоциации от температуры
Точки вне кривой отвечают произвольным фактическим давлениям углекислого газа CO2. Точки, находящиеся на кривой, относятся к равновесным системам и характеризуют упругость диссоциации карбоната, которая с ростом температуры возрастает.
Область выше кривой равновесия – это неравновесные системы, где соблюдается условие (1) (пример: точка a на рис. 3.1), и в них возможно лишь образование карбоната.
Область ниже кривой отвечает условию (2) – только диссоциация карбоната.
На практике существует необходимость определять направление процесса в газовой фазе постоянного состава. Например, в атмосфере воздуха. Укажем, что давление углекислого газа фактическое постоянно, PCO2 Ф const .
Рис. 3.2. Схема для определения направления процесса
59
Из рисунка 3.2 видно, что равновесие системы осуществимо при
температуре TP. |
При любых |
других температурах равновесие |
невозможно. Если T1>TP, то PCO2 Ф |
|
|
PCO2 , реакция смещается в сторону |
||
диссоциации карбоната. |
|
|
При T1<TP, |
|
|
PCO2 PCO2 Ф – в сторону образования карбоната. |
||
Таким образом, TP – температура, выше которой идет процесс диссоциации карбоната, и ее называют температурой начала разложения в газовой фазе с постоянным парциальным давлением углекислого газа.
3.2. Упругость диссоциации различных карбонатов
CaO CO |
2 |
|
CaCO |
|
; |
|
|
Ho –42920 кал. |
(3.6) |
||||||
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|||
MgO CO |
2 |
MgCO |
; |
|
Ho –26470 кал. |
(3.7) |
|||||||||
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
||
FeO CO |
2 |
|
FeCO |
; |
|
|
Ho –24840 кал. |
(3.8) |
|||||||
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
||
lg P |
lg K |
HTo |
|
|
STo |
; |
(3.9) |
||||||||
|
|
|
|
|
|||||||||||
CO |
|
|
|
|
|
|
|
4,567T |
4,567 |
|
|
||||
2 |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
lg P |
|
A |
|
B; |
|
|
|
|
|
A, B=const. |
(3.10) |
||||
|
|
|
|
|
|
|
|||||||||
CO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
T |
При невысоких температурах давление PCO2 определяется первым
слагаемым или тепловым эффектом. Чем оно больше, тем меньше упругость карбоната (диссоциации), тем прочнее соединение. Прочность от FeCO3 к CaCO 3 увеличивается.
Для кальция (карбонатная) зависимость имеет вид (табл. 3.1):
lg P |
8920 |
7,54 . |
(3.11) |
CO |
T |
|
2 |
||
|
Данные таблицы 3.1 показывают, что в интервале температур от 600 до 1000 oC реакция (3.6) практически протекает обратимо.
В области низких температур, когда давление PCO2 много меньше
единицы, трудно обеспечить условия для разложения карбоната. А при высоких температурах эти условия реализуются легко.
60
