
основы меаллургических процессов
.pdfГлава 11 ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ПРОЦЕССОВ ИСПАРЕНИЯ,
ВОЗГОНКИ И КОНДЕНСАЦИИ
11.1. Общая характеристика процессов испарения, возгонки и конденсации в металлургии
Явления испарения, возгонки и конденсации имеют место во многих металлургических процессах. С одной стороны, эти явления являются нежелательными, так как приводят к потерям металлов и их соединений. С другой стороны, на этих явлениях основан целый ряд производственных процессов получения металлов и различных соединений, имеющих большое значение в металлургическом производстве. Как в первом, так и во втором случаях для снижения потерь металлов и, соответственно, проведения процессов получения и рафинирования металлов в оптимальном технологическом режиме необходимо знать общие закономерности явлений испарения, возгонки и конденсации применительно к металлургическим системам. Причем в связи с развитием вакуумной металлургии эти вопросы приобретают еще большее значение. Следует подчеркнуть, что производственные процессы, основанные на этих явлениях, касаются получения и рафинирования не только сравнительно легколетучих металлов и их соединений, но их можно использовать и для получения трудно- и весьма труднолетучих металлов. При этом предусматривается перевод этих металлов в легкоиспаряющиеся соединения и последующее их разложение. Особое место занимает процесс ректификации, при помощи которого представляется возможным достичь 100 %-ной степени разделения сплава на компоненты при малом различии их температур кипения (до 0,5 °C) и получить металлы высокой степени чистоты.
На явлениях испарения, возгонки и конденсации основаны следующие наиболее распространенные технологические процессы:
1.Дистилляционные способы получения летучих металлов (Zn, Cd, Hg и др.). В них обычно имеют место восстановительные или окислительные процессы с получением паров металлов и последующей их конденсации.
2.Ректификационные методы рафинирования (Zn, Cd, Hg, щелочные металлы и др.). В них происходит разгонка металлов из сплавов в ректификационной колонне, в которой имеет место противоточное взаимодействие жидкости и пара, сопровождающееся явлениями тепло- и массообмена.
231

3.Фракционная разгонка, предусматривающая периодическую разгонку, при которой фракционно отбирают конденсат через определенные промежутки времени.
4.Непрерывная разгонка, при которой осуществляется непрерывное испарение рафинируемого металла и периодический или непрерывный отбор конденсата.
5.Молекулярная дистилляция, предусматривающая вакуумную дистилляцию при таких соотношениях давлений и геометрических размерах аппарата, при которых молекулы вещества достигают поверхности конденсации без возможных столкновений.
6.Процессы хлорирующего обжига и разделения галогенидов и оксихлоридов (Ti, Zr, V, Mo, Si и др.).
7.Транспортные реакции (Ti, Zr, Nb, Be, Al и др.).
11.2.Термодинамика процессов испарения и возгонки чистых
металлов
При испарении жидкого или возгонке твердого металла в замкнутом сосуде (при отсутствии остаточных газов) с течением времени наступает динамическое равновесие между конденсированной
ипаровой фазами: жидкость–пар – αисп; твердая фаза–пар – αсубл, где αисп
иαсубл – теплоты испарения и сублимации, Дж.
Всоответствии с правилом фаз, равновесие в этих однокомпонентных системах моновариантное и, следовательно, характеризуется давлением насыщенного пара p, которое однозначно определяется температурой, т.е. p = f (T).
Температурная зависимость давления насыщенного пара в общем виде может быть получена из уравнения Клаузиуса – Клайперона для идеального пара:
dp dT L T V |
V |
, |
(11.1) |
|
|
ж |
п |
|
|
где Vж и Vп – молярные объемы жидкости и пара.
При переходе жидкости в пар объемом Vж можно пренебречь и допустив, что пар ведет себя как идеальный газ по формуле:
Vп RT / p , |
(11.2) |
тогда получаем уравнение (11.1) в виде:
232
1 |
|
dp |
|
L |
. |
(11.3) |
|
p |
dT |
RT2 |
|||||
|
|
|
|
Интегрируя уравнение (11.3), приходим к выражению:
lg p |
1 |
|
L |
dT i . |
(11.4) |
19,15 |
T2 |
Для решения уравнения (11.4) необходимо знать зависимость постоянной i от температуры. Для сравнительно узкого температурного интервала допускаем, что L не зависит от температуры, и получаем упрощенное выражение уравнения (11.4):
|
|
|
|
|
lg p |
|
L |
i ; |
(11.5) |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
2,303RT |
|||||
|
|
|
|
|
lg p |
A |
B , |
|
(11.6) |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
T |
|
|
||
где A |
L |
|
|
L |
; B – постоянная величина для данного вещества. |
|||||
|
|
|
||||||||
2,303R |
19,15 |
|||||||||
Если учесть температурную зависимость теплоты испарения, то |
||||||||||
можно получить более точное уравнение: |
|
|
||||||||
|
|
|
|
lg p A B/ T Cln T DT , |
(11.7) |
|||||
где A, B, C, D – константы, определяемые из термодинамических функций.
На основе уравнения (11.6) представляется возможным построить диаграмму фазовых равновесий для однокомпонентной системы
(рис.11.1).
Кривая OA характеризует зависимость упругости пара над твердым телом (кривая сублимации). Линии OC и OD – кривые плавления, причем OC для веществ, объем у которых увеличивается при плавлении (большинство металлов), а OD – для веществ с уменьшением объема при плавлении (вода, висмут, германий, кремний, некоторые сорта чугуна). Для большинства веществ повышение давления вызывает некоторое повышение температуры плавления. Это вытекает из уравнения Клаузиуса–Клайперона (11.1), справедливого и для равновесия твердое тело – жидкость. Поскольку для большинства
233
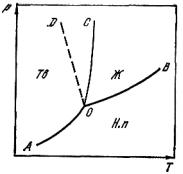
металлов Vж > Vтв, то с повышением давления dT/dp > 0, т.е. с увеличением давления будет повышаться температура плавления.
Подобное заключение можно сделать также из правила смещения равновесия. Повышение давления смещает равновесие в сторону образования фазы с меньшим объемом, т.е. расширяет область твердой фазы. Следует отметить, что наклон кривой OA больше, чем OB, так как теплота сублимации больше, чем теплота испарения. Точка O носит название тройной точки и отвечает нонвариантному равновесию. Следует отметить, что тройная точка не совпадает с точкой плавления. Так, например, для воды координаты тройной точки имеют следующие значения T = 0,008 °C, р = 460 Па.
Рис. 11.1. Диаграмма фазовых равновесий для однокомпонентной системы: Ж – жидкость; Тв – твердое состояние, Н. п. – насыщенный пар.
Давление пара зависит от кривизны поверхности жидкости. В случае выпуклой поверхности давление больше, а в случае вогнутой – меньше по сравнению с давлением пара над плоской поверхностью. Это имеет практическое значение при испарении из капилляров (пористые тела).
Величина добавочного, связанного с кривизной поверхности, давления описывается формулой Лапласа:
|
1 |
|
1 |
|
|
|
|
p 2 |
|
|
, |
(11.8) |
|||
|
|
||||||
r1 |
r2 |
|
|
||||
где p – капиллярное давление, Па; ζ – поверхностное натяжение, МДж/м2; r1, r2 – радиусы кривизны в двух взаимно перпендикулярных плоскостях, м.
Если поверхность (r1=r2) и p=2ζ/r, то
234
|
|
2 V |
|
|
|
p p0 exp |
|
м |
|
, |
(11.9) |
|
|||||
|
|
RTr |
|
|
|
где р – упругость пара над плоской поверхностью. Па; VM – молярный объем жидкости, м3/моль; T – температура, K; R – универсальная газовая постоянная, Дж/(моль·К); минус – вогнутый мениск; плюс – выпуклый.
Из других факторов необходимо рассмотреть влияние вакуума на процесс испарения. Если жидкость при внешнем давлении pвн находится в равновесии с паром, парциальное давление которого равно p, то с увеличением внешнего давления молярная свободная энергия жидкости изменится на Vжdpвн (где Vж – объем одного моля жидкости). Соответственно изменится и свободная энергия пара Vпdp. Фазы находятся в равновесии, поэтому
Vжdpвн Vпdp . |
(11.10) |
Поскольку Vп = RT/p, уравнение (11.10) примет вид:
V dp |
|
|
RT |
dp ; |
(11.11) |
||||
вн |
|
||||||||
ж |
|
|
p |
|
|
||||
|
|
|
|
|
|
|
|||
dp |
|
Vж |
dp |
|
|
. |
(11.12) |
||
|
|
вн |
|||||||
p |
RT |
|
|
|
|||||
|
|
|
|
|
|||||
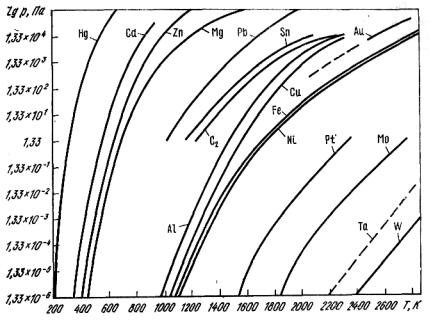
Рис. 11.2. Зависимость давления паров металлов от температуры
235

В связи с тем, что объем жидкости с изменением внешнего давления практически не изменяется, то интегрирование уравнения
(11.12) дает:
ln |
p1 |
|
Vж |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|||||
p2 |
RT |
pвн |
pвн ; |
|
|||||||
|
|
|
|
|
|
|
|
||||
p1 |
|
|
|
|
Vж |
|
|
|
|
|
|
|
|
exp |
|
|
|
|
|
||||
p2 |
|
|
|
|
pвн |
pвн . |
|||||
|
|
|
|
RT |
|
|
|
|
|||
(11.13)
(11.14)
При переходе от нормального давления pвн = 0,1 МПа к глубокому вакууму и, учитывая числовое значение R, соотношение между давлениями насыщенного пара при нормальном давлении остаточных газов (p1) и в глубоком вакууме (p2) примет вид:
p1 p2 exp 0,0122Vж T . |
(11.15) |
На первый взгляд, переход от нормального внешнего давления к вакууму должен вызывать уменьшение парциального давления пара. Однако, как показывают расчеты, это влияние настолько мало, что им можно пренебречь. Действительно, для цезия, имеющего среди металлов максимальное значение отношения Vж  Tпл (Vж = 71 см3/моль
Tпл (Vж = 71 см3/моль
и Tпл = 301,5 K), изменение давления составит всего лишь 0,26 %, т.е. p1/p = 1,0026. Для других металлов это изменение составит сотые и тысячные доли процента.
Таким образом, термодинамическое влияние вакуума на процесс испарения других металлов невелико и его можно не принимать во внимание. Как будет показано ниже, вакуум оказывает существенное влияние на кинетику процесса испарения и возгонки.
На основе экспериментальных данных для металлов получены температурные зависимости упругости паров ряда металлов, которые обобщены на рис. 11.2. Условно по степени летучести металлы можно разделить на следующие группы:
1) летучие – ртуть, рубидий, цезий, калий, кадмий, натрий, цинк, магний;
2)среднелетучие – стронций, литий, кальций, барий, сурьма,
свинец;
3)малолетучие – олово, марганец, хром, серебро, бериллий, алюминий, медь, золото, железо, никель;
4)весьма малолетучие – платина, молибден, тантал, вольфрам.
236
11.3. Термодинамика процесса испарения в двухкомпонентных системах
Связь между составом пара и жидкости в идеальных системах установлена законом Рауля.
Для бинарной системы, состоящей из компонентов A, а, B (более летучий компонент B),
p |
A |
po |
x ; |
p |
B |
po x , |
(11.16) |
|
A |
A |
|
B B |
|
где pA, pB – парциальное давление пара компонентов A и B над раствором; Па; poA , poB – упругость пара чистых компонентов; Па; xA, xB
– молярные доли компонентов.
Общее давление pAB над идеальным раствором равно сумме парциальных давлений и имеет вид:
p |
AB |
p |
A |
p |
B |
po x |
po x . |
(11.17) |
|
|
|
A A |
B B |
|
Общее давление пара над многокомпонентным раствором равно сумме парциальных давлений компонентов:
k |
|
pобщ pi p1o x1 po2 x2 pok xk . |
(11.18) |
i 1
Вреальных металлических растворах наблюдаются отклонения от линейной зависимости (закон Рауля) между давлением пара и его
составом, что обусловлено различием энергии межчастичного взаимодействия ( AA , BB , AB ). Отклонение может быть положительным
(рис. 11.3, а) и отрицательным (рис. 11.3, б).
Положительные отклонения при образовании металлических растворов характеризуют более слабые межчастичные взаимодействия ( AA AB и BB AB ) по сравнению с такими же взаимодействиями в
идеальном растворе. Образование этих растворов сопровождается увеличением молярного объема раствора и поглощением тепла.
237
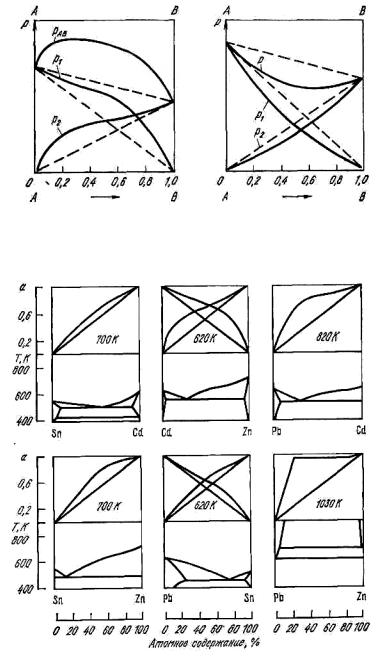
Рис. 11.3. Отклонение от закона Рауля: а – положительное;
б – отрицательное
Рис. 11.4. Сопоставление диаграмм состояния сплавов и кривых активности а при положительных отклонениях от закона Рауля
238
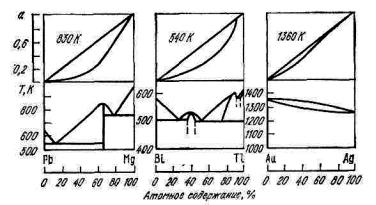
Рис. 11.5. Сопоставление диаграмм состояния сплавов и кривых активности a при отрицательных отклонениях от закона Рауля
Положительные отклонения применительно к металлическим расплавам наблюдаются в двойных системах, в которых компоненты образуют эвтектику (Sn–Zn), в системах с ограниченной растворимостью в твердом состоянии (Pb–Cd, Sn–Cd, Pb–Sn, Al–Sn), a также в системах с ограниченной растворимостью в жидком состоянии (Pb–Zn) (рис. 11.4). В случае Pb–Zn проявляются силы взаимного отталкивания разнородных атомов, приводящие к расслоению сплавов.
Отрицательные отклонения от идеальных растворов характеризуют более сильное взаимодействие между разнородными частицами Образование этих растворов
сопровождается уменьшением молярного объема и выделением тепла. Отрицательные отклонения характерны для систем, в которых образуются химические соединения или непрерывный ряд твердых растворов (Pb–Mg, Bi–Te, Au–Ag) (рис.11.5).
В реальных растворах концентрация компонентов заменяется активностью ai = γixi. Чем больше активность, тем выше давление насыщенного пара над раствором. Коэффициент активности γi характеризует степень отклонения от идеальности. Для сплавов с положительными отклонениями γi > 1, а для сплавов с отрицательными отклонениями γi < 1.
На основе закона Рауля, используя уравнение зависимости молярной доли компонентов в растворе от величин упругостей паров чистых компонентов ( poA , poB ) и общего давления ( pAB ):
xB pAB poA / poB poA |
(11.19) |
239
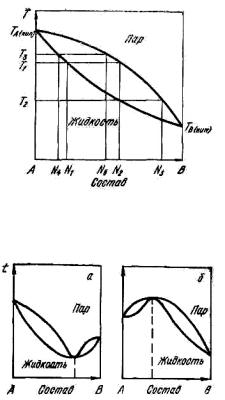
представляется возможным построить диаграмму равновесия жидкость– пар для двухкомпонентного идеального раствора (рис. 11.6).
Верхняя кривая (кривая пара) указывает состав пара, равновесного с жидкостью, и показывает температуру начала конденсации пара заданного состава. Нижняя кривая (кривая жидкости) указывает состав жидкости равновесный с паром и дает температуру кипения жидкости заданного состава.
Рис. 11.6. Диаграмма равновесия жидкость–пар для идеального двухкомпонентного раствора
Рис. 11.7. Диаграммы равновесия жидкость–пар для растворов с положительным (а) и отрицательным отклонением (б) от закона Рауля
Как следует из рис. 11.6, пар всегда обогащен тем компонентом, прибавление которого к жидкости повышает давление пара над ней или, иными словами, пар обогащен более летучим компонентом. Это правило известно как первый закон Коновалова, оно используется для теоретического обоснования разделения сплавов путем их ректификации.
Для металлических растворов, имеющих достаточно ярко выраженные положительные или отрицательные отклонения от закона Рауля, на диаграммах равновесия жидкость–пар (рис. 11.7) характерно
240
