
основы меаллургических процессов
.pdf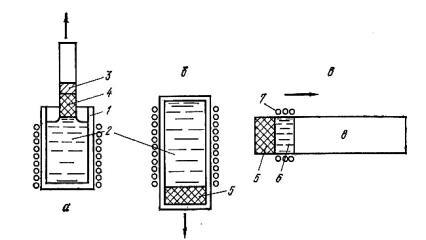
Рис. 10.3. Схемы перекристаллизационных способов очистки:
а – вытягивание монокристаллов из расплава; б – нормальная направленная кристаллизация; в – зонная плавка; 1 – тигель; 2 – расплав; 3 – затравка; 4 – вытягиваемый кристалл; 5 – затвердевшая часть слитка; 6 – расплавленная зона; 7 – нагреватель; 8 – твердая исходная часть слитка
Одним из первых способов очистки расплавов от примесей является метод вытягивания кристаллов из расплава, предложенный Чохральским в 1916г. Им были получены нитевидные монокристаллы олова, свинца, цинка и некоторых других металлов.
Сущность способа вытягивания из расплава (рис. 10.3, а) состоит в том, что в расплав, находящийся при строго определенной температуре, опускают затравку в виде небольшого кристалла того же состава, что и расплав. Затем затравку, находящуюся на поверхности расплава, постепенно с малой скоростью поднимают вверх, при этом затравка увлекает за собой столбик расплава, который, попадая в зону с более низкой температурой, охлаждается и кристаллизуется. При кристаллизации происходит перераспределение примеси, и если примесь понижает температуру плавления металла, то кристаллизующийся металл будет обеднен примесью.
Способ нормальной направленной кристаллизации (предложен Бриджменом в 1926 г.) предусматривает расплавление в тигле и выдержку (для гомогенизации) расплава при определенной температуре (рис. 10.3, б). Затем тигель с расплавом постепенно выводится из зоны высоких температур, при этом происходит затвердевание, причем кристаллизация носит направленный характер в сторону отвода тепла. При кристаллизации происходит перераспределение примесей между твердой и жидкой фазами, поэтому получившийся слиток, если примесь
211
понижает температуру плавления, будет обогащен в хвостовой его части примесью.
Сущность способа зонной перекристаллизации или зонной плавки
(разработан Пфанном в 1952 г.) состоит в том, что вдоль твердого слитка (так называемой загрузки) медленно передвигается узкая расплавленная зона, создаваемая специальной печью или индуктором (рис. 10.3, в). Таким образом, начиная с одного конца слитка, эта узкая зона расплавленного металла постепенно перемещается к другому концу, при этом в процессе кристаллизации также происходит перераспределение примеси с одного конца слитка к другому.
Все вышеуказанные методы основаны на закономерностях кристаллизации сплавов. Как в методе вытягивания из расплава, так и в методе нормальной направленной кристаллизации имеется один фронт кристаллизации. В то время как в зонной плавке наряду с фронтом кристаллизации имеется и фронт плавления. В этом заключается принципиальное различие между этими способами очистки металлов от примесей, что и обусловливает различие в распределении примеси по длине слитка.
Задачей этих способов очистки является наиболее полное удаление из металла примеси. Как известно, в металле присутствуют растворимые и нерастворимые примеси. В процессе кристаллизации происходит перераспределение этих примесей. Нерастворимые примеси (оксиды, нитриды, сульфиды) всплывают на поверхность затвердевающего слитка или погружаются в донную часть, растворимые примеси перераспределяются между жидкой и твердой фазами в соответствии с коэффициентом распределения.
Рафинирование металлов от примесей методами вытягивания из расплава, нормальной направленной кристаллизацией и зонной плавкой основано на различии между растворимостью примесей в жидком и твердом металле, а также на очень медленной диффузии примесей в твердой фазе. Оценка эффективности очистки вещества от примесей кристаллизацией из расплава может быть осуществлена на основе равновесного и эффективного коэффициента распределения.
10.6. Равновесный и эффективный коэффициент распределения
Под коэффициентом распределения примеси понимается отноше-
ние ее концентраций в твердой и жидкой фазах:
K0 cтв / сж . |
(10.18) |
212
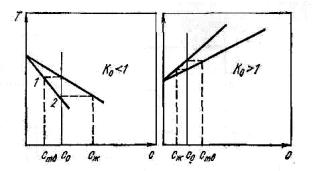
Коэффициент распределения, относящийся к равновесным условиям, т.е. равновесию между жидкой и твердой фазами, носит название равновесного коэффициента распределения. Значение равновесного коэффициента распределения может быть определено исходя из диаграмм состояния основное вещество – примесь. Величина K0 изменяется в пределах от 10 до 10–4, т.е. может быть больше или меньше единицы. В том случае, если примесь понижает температуру плавления основного вещества (рис. 10.4, а), тогда значение K0 меньше единицы. Если добавка примеси повышает температуру плавления вещества, то K0 больше единицы (рис. 10.4, б).
Рис. 10.4. Участки диаграмм состояния металл–примесь для K0 < 1 (а) и K0> 1 (б)
Чем больше расстояние между линиями солидуса и ликвидуса, тем в большей степени K0 отличается от единицы. Если величина K0 близка к единице, то эффективность очистки уменьшается. Чем больше величина K0 отличается от единицы, тем выше степень рафинирования.
В том случае, если компоненты (А и В) образуют между собой идеальные жидкие и твердые растворы и при этом теплота смешения компонентов равна нулю, а теплота плавления обоих компонентов не изменяется с температурой, то значение коэффициента распределения примеси B, согласно Ван Лаару, примет вид:
lnK0(B) ln |
xB |
тв |
|
H |
|
1 |
|
1 |
|
|
|
|
B |
|
|
, |
(10.19) |
||||
|
|
|
|
|
||||||
|
xBж |
R |
T |
|
TB |
|
||||
где xBтв и xBж – молярные концентрации примеси B соответственно
твердой и жидкой фазам; НВ – энтальпия плавления примеси B; TB – температура плавления компонента B. Таким образом, для идеальных растворов значение lnK0 представляет собой линейную функцию обратной абсолютной температуры (1/T K).
213
Для разбавленных растворов, в которых имеет место взаимодействие между частицами растворителя и растворенного вещества, следует учитывать теплоту смешения. При условии, если теплота смешения не зависит от температуры, коэффициент распределения примеси выража-ется следующим уравнением:
|
|
lnK0(B) HB HсB |
RT HB RTB , |
(10.20) |
где |
Hс |
– энтальпия смешения. В |
случае образования |
регулярных |
|
B |
|
|
|
растворов значение коэффициента распределения может быть определено на основе соотношения:
lnK |
0(B) |
H |
B |
H |
Ж |
H |
ТВ |
RT S R , |
(10.21) |
|
|
|
|
|
|
||||
где НВ – энтальпия плавления компонента B; НЖ = (1 |
– сЖ)2–ωж; |
||||||||
HТВ = (1 – ств)3–ωтв; S – энтропия кристаллизации; ωж и ωтв – постоянные, не зависящие от температуры, характеризующие
межчастичное взаимодействие в жидком и твердых растворах и называемые энергиями смешения (энергия взаимообмена, параметры взаимодействия).
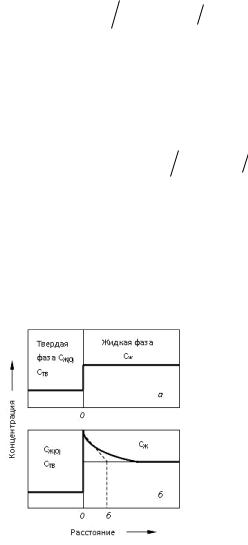
Рис. 10.5. Схема распределения примесей на границе раздела твердой и жидкой фаз при кристаллизации расплава в равновесных (а) и неравновесных (б) условиях
Расчет величины K0 может быть выполнен на основе двойных диаграмм равновесия металл – примесь, однако его точное определение затруднено, так как фазовые диаграммы для малых концентраций примеси обычно недостаточно точны. При очень малых концентрациях примеси можно воспользоваться законами бесконечно разбавленных
214

растворов и считать линии солидуса и ликвидуса близкими к прямым. Таким образом, при малых концентрациях примеси отношение состава твердой фазы cтв к составу жидкой cж, т.е. K0 не зависит от концентрации и является величиной постоянной.
При более высоких концентрациях примеси, когда имеют место значительные отклонения от законов разбавленных растворов, линии ликвидуса и солидуса обычно искривляются, величина K0 зависит от концентрации и не является постоянной величиной.
Для приближенной оценки K0 можно к линиям ликвидуса и солидуса провести касательные из точки плавления чистого компонента и по отношению отрезков, отсекаемых касательными на прямой параллельной оси абсцисс, определить K0(А) И K0(В).
Как уже отмечалось, K0 относится к равновесным условиям. В этом случае кристаллизация расплава протекает очень медленно. Концентрация растворенного вещества (примеси) будет одинаковой во всем объеме жидкой фазы. Концентрация примеси в затвердевшей фазе будет составлять K0-ю часть концентрации в жидкости, т.е. примесь будет распределяться между жидкой и твердой фазами в строгом соответствии с законом распределения (рис. 10.5).
При более быстром затвердевании будет иметь место иное распределение примеси. В этом случае движущийся фронт кристаллизации оттесняет растворенную примесь быстрее, чем та успевает диффундировать в основную часть жидкой фазы, поэтому впереди фронта кристаллизации возникает слой расплава толщиной δ (рис. 10.5), обогащенный примесью. В этих неравновесных условиях зависимость между концентрацией примеси в твердой фазе и жидкости оценивается так называемым эффективным коэффициентом распределения:
KЭФ сТВ сЖ . |
(10.22) |
Эффективный коэффициент распределения связан с равновесным следующим соотношением:
KЭФ |
|
|
K0 |
. |
(10.23) |
|
K0 |
1 K0 exp f D |
|||||
|
|
|
|
215
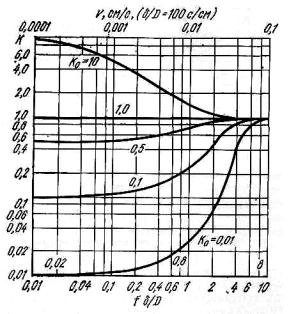
Рис. 10.6. Зависимость эффективного коэффициента распределения K примеси от приведенной скорости роста fδ/D
Безразмерная величина fδ/D носит название приведенной скорости роста и включает три параметра: f – скорость перемещения фронта кристаллизации, см/с; δ – толщину диффузионного слоя, см; D – коэффициент диффузии примеси в расплаве, см2/c. Таким образом, на основе значений f, δ, D и равновесного коэффициента распределения K0 представляется возможным определить значение KЭФ.
Изменение величины критерия fδ/D соответственно изменяет значение KЭФ. Причем увеличение его смещает KЭФ в сторону единицы независимо от значения K0. Наоборот, уменьшение критерия fδ/D приближает значение KЭФ к K0 (рис. 10.6). Из трех величин f, δ и D наибольшее влияние на значение KЭФ и на степень приближения его к K0 оказывает скорость кристаллизации. Чем меньше скорость перемещения фронта кристаллизации, тем ближе значения эффективного коэффициента распределения к его равновесному значению, т.е. если f→0, то KЭФ → K0. Чем выше скорость перемещения фронта кристаллизации, тем ближе значение KЭФ к единице, т.е. если f → ∞, то KЭФ → 1. На толщину диффузионного слоя δ влияют скорости диффузии и кристаллизации. Так, при скорости кристаллизации 1 мм/мин и коэффициенте диффузии примеси в расплаве 10–4–10–6 см2/с толщина диффузионного слоя составляет ~0,07 см. При больших скоростях кристаллизации величина δ уменьшается, а при меньших – увеличивается. При этом, чем меньше скорость кристаллизации, тем на большее расстояние от фронта кристаллизации распространяется
216
примесь, но перепад концентрации примеси на границе твердая–жидкая фаза будет меньше.
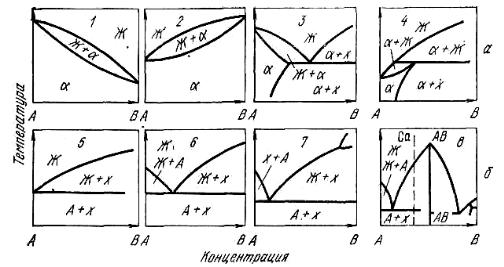
Рис. 10.7. Характерные типы диаграмм состояния металл (A)
– примесь (B): а – значительная; б – незначительная растворимость в твердом состоянии
Наоборот, при больших скоростях кристаллизации толщина слоя будет уменьшаться, но соответственно возрастать перепад концентрации примеси. Приближению KЭФ к K0 способствует искусственное перемешивание расплава. При перемешивании уменьшается перепад концентрации на границе твердая – жидкая фаза и возрастает скорость выравнивания концентрации примеси в расплаве. Таким образом, в общем случае значение эффективного коэффициента распределения зависит от характера диаграммы состояния, что отражает величина K0, условий затвердевания, скорости перемещения фронта кристаллизации и интенсивности перемешивания в жидкой фазе.
Как уже отмечалось, значение K0 может быть оценено на основе диаграмм состояния металл – примесь. На рис. 10.7 представлены наиболее типичные, простейшие диаграммы состояния. Для систем 1,3,6,7,8 примесь B понижает температуру плавления металла A, поэтому для этих систем K0(B) < 1. Во время кристаллизации примесь в сплавах этих систем перемещается в направлении движения расплавленной зоны и концентрируется в конце слитка.
Для систем 2, 4, 5 характерно повышение температуры плавления компонента A под влиянием примеси B, следовательно, для них K0(В) > 1 и примесь в процессе кристаллизации будет сосредотачиваться в начале слитка. Относительно влияния характера диаграмм состояния на эффективность очистки от примесей следует отметить, что для систем
217
5–8, для которых характерно отсутствие растворимости примеси в твердом металле, а, следовательно, и малая величина K0, имеются благоприятные условия для очистки металла от примеси. Причем примесь будет накапливаться в жидкой фазе и сосредотачиваться в конце слитка, затвердевающего в последнюю очередь. Для систем 1–4 характерно наличие полной растворимости примеси в твердом состоянии. Это также отражается на степени очистки. Более полно будет удаляться примесь из сплавов систем 2 и 4 и в меньшей степени в системах 1 и 3. В сплавах, соответствующих эвтектике, не будет происходить разделения.
10.7. Распределение примесей по длине слитка при нормальной направленной кристаллизации и вытягивании из расплава
Как уже ранее отмечалось, в зависимости от величины коэффициента распределения примесь при перекристаллизационных способах очистки либо будет скапливаться в конце затвердевающего слитка (при K0 < 1) или в начале слитка (при K0 > 1). При этом примесь неравномерно распределяется по длине слитка. Характер распределения примесей зависит от целого ряда факторов: значения K0 (коэффициента распределения), условий кристаллизации, степени перемешивания, способа перекристаллизационной очистки и др.
В связи с тем, что метод нормальной направленной кристаллизации и метод вытягивания из расплава имеют принципиальное сходство: они имеют только фронт кристаллизации, различие сводится к форме и объему жидкой фазы. Рассмотрим применительно к этим методам очистки закономерности распределения примесей по длине слитка. Примем ряд допущений, которые позволяют упростить картину процесса:
1.В жидкой фазе примесь распределяется равномерно, т.е. имеет место идеальное перемешивание.
2.Диффузия примеси в твердой фазе практически отсутствует.
3.Сечение слитка, коэффициент распределения, скорость и условия кристаллизации постоянны и не изменяются по ходу процесса.
Представим, что процесс нормальной направленной кристаллизации или вытягивания из расплава протекает, спустя некоторое время после его начала. Пусть g – масса расплава до кристаллизации, dg –
масса закристаллизовавшегося слоя, cтв – концентрация примеси в твердой фазе, cж – концентрация примеси в расплаве в любой момент кристаллизации, c0 – исходное содержание примеси в расплаве перед началом кристаллизации.
218

Для этих условий дифференциальное уравнение материального баланса элементарного процесса кристаллизации выглядит следующим образом:
cж dcж g dg cтвdg cжg . |
(10.24) |
||||||||||||||||
Преобразуя выражение (10.24) |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
cжg gdcж cжdg dcжdg cтвdg cжg , |
(10.25) |
||||||||||||||||
Получаем: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
gdcж cжdg dcжdg cтвdg 0 . |
(10.26) |
||||||||||||||||
Пренебрегая членом dcжdg , получим: |
|
|
|
|
|
|
|
||||||||||
cтв cж dg gdcж , |
(10.27) |
||||||||||||||||
или |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dg |
|
|
|
dcж |
|
|
|
. |
|
|
(10.28) |
||||
|
|
|
g |
c |
|
|
c |
|
|
|
|
||||||
|
|
|
|
|
|
|
тв |
|
|
|
ж |
|
|
|
|||
В интегральной форме имеет вид: |
|
|
|
|
|
|
|
|
|
|
|
||||||
g0 |
|
dg |
|
с0 |
|
dc |
ж |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
, |
(10.29) |
|||||
|
g |
c |
|
c |
|
||||||||||||
g |
ж |
|
с |
ж |
|
тв |
|
|
|
|
ж |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
где верхние пределы интегрирования отвечают началу образования твердой фазы, нижние – любому моменту процесса кристаллизации; g0 – масса расплава до кристаллизации; gж – масса незакристаллизовавшегося расплава в любой момент кристаллизации (конец кристаллизации отвечает gж = 0). Интегрируя, получаем выражение:
|
|
|
с0 |
dcж |
|
|
|
|||
ln g0 |
gж |
|
|
|
|
|
. |
(10.30) |
||
c |
|
c |
|
|||||||
|
|
|
тв |
ж |
|
|||||
|
|
|
с |
ж |
|
|
||||
|
|
|
|
|
|
|
|
|
||
219
Решение второй части уравнения возможно, если известна зависимость cтв от cж, т.е. известен равновесный коэффициент распределения, тогда cтв = K0cж.
Следовательно,
|
|
|
|
|
|
|
|
|
|
с0 |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|||
ln g0 |
gж |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dcж . |
(10.31) |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
K |
|
|
|
1 c |
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
0 |
|
ж |
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
с |
ж |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Интегрируя выражение (10.31), получаем |
|
|||||||||||||||||||||||||||||
ln g0 |
gж |
|
|
|
|
|
1 |
|
|
|
|
ln |
c0 |
|
|
cж , |
(10.32) |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
K0 |
|
1 |
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
или g |
0 |
|
g |
ж |
K0 1 |
|
c |
0 |
|
|
|
c |
ж |
. |
(10.33) |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Предположим, что g0 = 1, а gж = 1 – gтв, где gтв – доля |
||||||||||||||||||||||||||||||
закристаллизовавшегося расплава. |
Принимая |
во |
внимание, что cж = |
|||||||||||||||||||||||||||
cтв/K0, получаем формулу: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
1 |
|
|
|
|
K0 1 |
|
|
|
|
|
c0 |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
(10.33) |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
1 |
gтв |
|
|
|
|
|
|
|
|
ств |
|
K0 |
|
|
||||||||||||||||
Следовательно, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
1 |
|
|
|
|
|
|
|
c0K0 |
. |
|
|
|
|
|
(10.35) |
|||||||||||
|
1 g |
|
|
|
|
K |
|
1 |
|
|
|
|
|
|
||||||||||||||||
|
тв |
|
0 |
|
|
|
|
|
|
ств |
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
220
