
основы меаллургических процессов
.pdf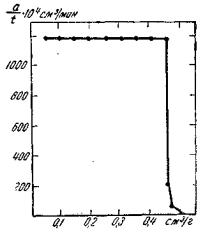
Н.Ф. Ляшко, показали, что первичной пассивационной пленкой, возникающей на железе, является γ-Fe2O3.
Рис. 5.7. Влияние количества адсорбированного кислорода на скорость его поглощения железным порошком
Согласно А. А. Кочеткову, эта пленка формируется и приобретает защитное действие при комнатной температуре и сухом воздухе в течение 15–30 мин. Дальнейший рост ее может произойти лишь при повышении температуры.
На рисунке 5.7 по оси ординат отложена скорость поглощения кислорода a / t 104 cм3 / мин , где t – время, необходимое для адсорбции
a = 0,05 см3 O2. По оси абсцисс указано общее количество O2 (см3), адсорбированное железным порошком. Первые девять порций (0,45 см3 O2) поглощаются быстро, а затем процесс резко замедляется. Скорость адсорбции оказалась пропорциональной давлению кислорода.
Первичная пленка, возникающая при окислении образца при низких температурах, очень тонка и состоит из γ-Fe2O3. По мере нагревания она утолщается и при 150–250 °C перестраивается с наружной стороны в решетку α-Fe2O3. Вблизи железа, однако, остается весьма тонкая прослойка γ-Fe2O3. При 300–400 °C начинается достаточно интенсивное взаимодействие железа с соприкасающимся с ним γ-Fe2O3. Оно сводится к заполнению свободных узлов дырчатой решетки γ-Fe2O3 диффундирующими в нее ионами железа и приводит к появлению слоя Fe3O4.
Расходующаяся при этом прослойка γ-Fe2O3 непрерывно возникает снова вследствие перестройки части α-Fe2O3 в решетку γ-Fe2O3. Поэтому последняя сохраняется в виде тонкой граничной полоски между растущими слоями Fe3O4 и α-Fe2O3. Утолщение α-Fe2O3 происходит за счет окисления железа, достигшего в результате
101
диффузии наружной поверхности окалины, адсорбированным кислородом.
Образование внутреннего вюститного слоя осуществляется при температурах, начиная с которых он становится устойчивым. Последние, как говорилось выше, зависят от природы и содержания легирующих веществ. Процесс заключается в перестройке решетки Fe3O4, вызванной внедрением в нее ионов железа, диффундирующих из металла по направлению к наружной поверхности окалины.
На этом заканчивается формирование отдельных слоев оксидной пленки и начинается их рост, описанный выше.
5.5. Ионно-электронная теория окисления
Процесс окисления металлов можно рассматривать, как результат работы своеобразного гальванического элемента:
|
Me |
MeO |
O2 . |
(5.15) |
В нем металл, |
являясь анодом, посылает свои катионы (и |
|||
электроны) в окалину: |
|
|
|
|
|
Me Me2 2e , |
(5.16) |
||
а на внешней поверхности окисла происходит катодное восстановление газообразного кислорода:
1 |
2 |
O |
2 |
2e O2 . |
(5.17) |
|
|
|
|
В целом, это отвечает реакции окисления:
Me 1 |
2 |
O |
2 |
Me2 O2 MeO , |
(5.18) |
|
|
|
|
по изменению изобарного потенциала (ΔG) которой можно рассчитать электродвижущую силу (Е) элемента:
G Go RT ln |
aMeO |
|
zFE . |
(5.19) |
||
1 |
|
|||||
|
a |
Me |
a |
2 |
|
|
|
|
O |
|
|||
|
|
|
|
2 |
|
|
102
Здесь z – число электронов, участвующих в процессе (z=2); F –постоянная Фарадея (96500 Kл/моль или 23066 кал); ai – активность соответствующих веществ.
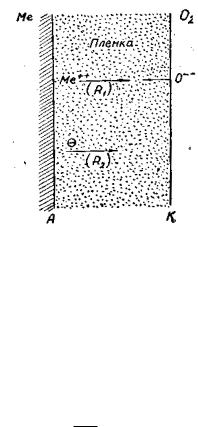
Пленка окисла, обладая смешанной проводимостью, одновременно играет роль электролита, в котором перемещаются катионы Me2+ и анионы O2-, и внешней цепи, по которой движутся электроны (рис. 5.8). Поэтому ее эффективное сопротивление (R) должно слагаться из двух последовательно включенных R1 и R2. Первое из них является электролитическим, а второе – электронным сопротивлением окалины.
Величину R можно выразить через удельную электропроводность
(χ) окисла, числа переноса катиона (nK), аниона (nA) и электрона (ne), а также толщину (y) и сечение (S) окисла:
R |
y |
|
1 |
|
1 |
|
|
y |
. |
(5.20) |
|
|
|
|
|
|
|
|
|||||
|
nK |
nA |
|
S nK nA ne |
|||||||
|
S |
|
ne |
|
|
|
|||||
Рис. 5.8. Схема формирования оксидной пленки:
R1 и R2 – электролитическое и омическое сопротивления
Так как величина Е и R. зависят от парциального давления pO2
кислорода в газовой фазе, то сила тока (I), характеризующая скорость окисления, равна:
I dRdE
103

Известно, что |
p1m |
, а из уравнения (5.19) следует, |
что при |
|||||||||||||||||||||||||
|
|
|
|
|
|
0 |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
aMe= aMeO |
= 1 и aO |
2 |
pO |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
dE |
RT |
d ln p |
|
|
. |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
4F |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Отсюда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I |
dE |
|
RTS 0 nK nA ne |
p1m dp |
|
|
|
. |
|
|
|
||||||||||||||
|
|
|
|
|
|
O |
|
|
|
|
||||||||||||||||||
|
|
|
|
|
dR |
|
|
|
4Fy |
|
|
|
|
O |
2 |
|
2 |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Чтобы найти зависимость I от pO |
при заданной толщине пленки, |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
разделим |
переменные |
и |
проинтегрируем |
|
от |
|
|
давления |
pO |
,М , |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
отвечающего равновесию Me с MeO, до давления pO |
2 |
|
в газовой фазе: |
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I |
RTS 0 nK nA nem |
pO1m |
pO1m ,M |
k 'S |
. |
(5.21) |
|||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
4Fy |
|
|
2 |
2 |
|
|
|
|
|
y |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Обратимся теперь к зависимости толщины окалины (y) от времени окисления (η). Согласно закону Фарадея, число грамм-эквивалентов (dη) окисла, образовавшихся за время dη, равно:
d FI d kFy'S d k Sy d ,
откуда скорость окисления будет:
|
d |
|
|
I |
|
k 'S |
k |
S |
. |
(5.22) |
d |
|
|
|
|||||||
|
|
F |
|
Fy |
|
y |
|
|||
С другой стороны,
Sy ,
M
где γ – удельный; M – грамм-эквивалентный вес MeO.
104
Отсюда
' |
dy |
|
MI |
|
Mk |
|
k" |
, |
(5.23) |
|
d |
SF |
y |
y |
|||||||
|
|
|
|
|
|
что приводит после интегрирования к параболическому закону окисления:
y2 2k .
При этом весьма существенно, что входящие в уравнения константы (k, k' и k") можно заранее вычислить из независимых опытных данных (электропроводности, числа переноса и т.п.) и сравнить с полученными при изучении кинетики окисления. Это позволяет детально проверить исходные положения предложенной теории.
В приведенных выше расчетах предполагалось, что основным фактором, лимитирующим кинетику окисления, является омическое сопротивление окалины. Электродная поляризация, свойственная работе многих гальванических элементов, не принималась во внимание. Можно думать, что затруднения в движении ионов и электронов выражаются не только в существовании омического сопротивления, но и в накоплении продуктов реакции на внутренней и внешней поверхности пленки. Например, при малом числе переноса электронов (ne → 0) может возникнуть катодная поляризация, вследствие отставания подхода электронов к внешней границе окалины. При недостаточной катионной проводимости следует ожидать анодной поляризации, обязанной накоплению на внутренней поверхности окалины ионов металла.
Наличие электродной поляризации осложняет зависимость силы тока от толщины окалины и может привести к другим кинетическим уравнениям, например, не к параболическому, а логарифмическому закону окисления.
5.6. Термодинамика диссоциации окислов
Процесс диссоциации окислов заключается в разложении сложного твердого вещества с образованием более простого и газа, что можно представить стехиометрическим уравнением:
105
AB(ТВ)=A(ТВ)+B(Г) |
(5.24) |
Термодинамический анализ системы железо–кислород осложняется, прежде всего, тем обстоятельством, что в ней образуется относительно большое число самостоятельных фаз как переменного, так и постоянного состава. К ним относятся сравнительно бедные твердые растворы кислорода в различных модификациях железа (α, γ, и δ): вюстит, магнетит, две модификации гематита, твердые и жидкие растворы окислов. В состоянии равновесия сосуществовать друг с другом в этой двухкомпонентной системе могут не более четырех фаз, что следует из условия нонвариантности:
C=K – Ф + 2 = 0; Ф = K + 2 = 4.
Из них три являются конденсированными, а одна – газообразной
(O2).
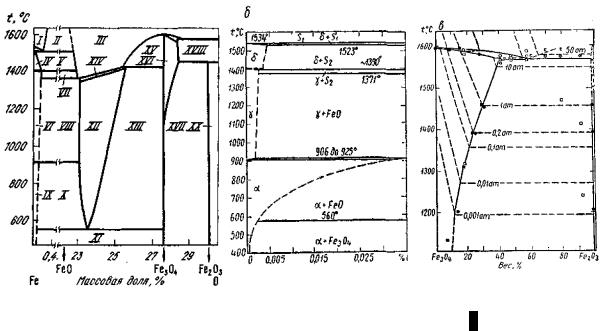
Для того чтобы наглядно видеть, какие фазы в том или ином конкретном случае находятся в равновесии друг с другом, следует пользоваться диаграммой состояния (рис. 5.9, а и б).
Рис. 5.9. Диаграмма состояния системы железо – кислород: aа – общий вид;
б – области устойчивости твердых растворов кислорода в железе, в – частная диаграмма Fe3O4 – Fe2O3
На диаграмме имеются области, соответствующие бивариантным двухфазным системам, состоящим из газообразного кислорода и твердых растворов кислорода (переменного состава) в вюстите XII, в
106
Fe3O4 XVI, в жидком железе I и в расплавленных окислах III. Наряду с ними существуют области, отвечающие моновариантным трехфазным системам, образованным двумя из перечисленных выше насыщенных растворов и газообразным O2. К ним относятся области: II – два насыщенных расплава (I) и (III); V – насыщенные растворы – твердый в
δ-Fe и жидкий (III); VII – твердый в γ-Fe и жидкий (III); VIII – в γ-Fe и вюстит (XII); X – в α-Fe и вюстит (XII); XI – в α-Fe и Fe3O4; XIV –
вюстит (XII) и жидкость (III); XV – Fe3O4 и жидкость (III); XVII – раствор в Fe3O4 (XVI) и гематит и т.п.
Наконец, точки пересечения кривых характеризуют нонвариантные системы с тремя конденсированными фазами. Следует заметить, что фазы, соответствующей формуле закиси железа, не обнаружено ниже 570 °C вообще, а выше этой температуры известным эквивалентом FeO служит вюстит, раствор переменного состава, содержащий кислорода всегда больше, нежели FeO.
Всвязи с этим формулу вюстита можно записать в виде Fe1-yO.
Вего металлической подрешетке имеется небольшое количество (у) вакантных узлов, а также (2у) трехвалентных ионов железа.
Таким образом, при диссоциации в системе железо–кислород, как правило, не происходит распада или возникновения чистых индивидуальных веществ. Обычно конденсированные фазы представляют собой растворы. Поскольку значительная часть поля солидуса соответствует моновариантным системам, то чаще всего имеют дело с равновесием насыщенных твердых растворов и условно называют их по имени близких по составу окислов или металлов. Например, вместо бедных растворов кислорода в железе, пишут Fe, а вместо вюстита – FeO.
Диаграмма показывает, что каждые две равновесно сосуществующие конденсированные фазы представляют собой растворы последовательной степени окисленности. Другими словами, возрастанию содержания кислорода в системе соответствуют (при t>570 °C) следующие переходы: железо, насыщенное кислородом → вюстит → магнетит → магнетит, насыщенный гематитом → гематит.
При температурах ниже 570 °C в этой цепи превращений отсутствует вюстит.
На основании этих, а также других данных А. А. Байковым был сформулирован общий принцип последовательности превращений, который для диссоциации в системе Fe–O можно записать либо в форме
последовательного отщепления кислорода Fe2O3 → Fe3O4 → FeO → Fe, либо металла FeO → Fe3O4 → Fe2O3 → O2.
107
Второе существенное затруднение при термодинамическом анализе процессов диссоциации окислов железа обусловлено недостатком надежных термохимических данных, а также и тем обстоятельством, что единственной фазой, обладающей измеримой упругостью диссоциации, является Fe2O3. Это заставляет прибегать к различным косвенным методам расчета и производить последние по приближенным формулам.
108
Глава 6 ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
6.1. Термодинамические основы процессов восстановления
В металлургии процессы восстановления имеют широкое распространение при получении металлов и сплавов. Типичный процесс восстановления оксидов (MeO) можно представить реакцией:
MeO + B = Me + BO (BO2), |
(6.1) |
где Me – обозначение металлического катиона (в общем случае может быть любой элемент); B, BO (BO2) – восстановитель и его оксидная форма.
Впроцессе восстановления оксида степень окисления атомов восстанавливаемого вещества снижается, а у восстановителя повышается. При этом исходный оксид является окислителем по отношению к восстановителю и приобретает электроны, в то время как восстановитель их отдает. Таким образом, в строгом смысле, процессы восстановления являются окислительно-восстановительными процессами. В металлургии в качестве восстановителей используют твердые, жидкие и газообразные вещества.
Возможно также восстановление путем электролиза водных и солевых растворов. В этом случае необходимо рассматривать условия присоединения электронов к катиону металла.
6.2.Восстановление газообразными восстановителями
Вкачестве газов-восстановителей используют водород, оксид углерода, их смеси, углеводороды. Углеводороды обычно предварительно подвергают конверсии для предотвращения при восстановлении выделения углерода и науглероживания металла.
Если для восстановления используется водород, то анализ термодинамической возможности восстановления оксидов может быть проведен с помощью диаграммы G° = f (T) для реакций образования оксидов металлов и водяного пара. Процесс восстановления в этом случае можно представить уравнением:
MeOK + H2 = MeK + H2O,
где MeOK и Me – конденсированные фазы оксида и металла.
109

Система имеет (С = К – Ф + 2) две степени свободы. Если заданы общее давление и температура, то состав газовой фазы состоящей из H2 и H2O, равновесной с твердыми фазами, определяется путем решения двух уравнений:
KP pH2O / pH2 exp( Go / RT) ; pH2O pH2 pобщ
с учетом, что
%H2 (H2O) pH2 (H2O) 100 .
pобщ
Некоторые металлы, как, например, железо, марганец, вольфрам, молибден и другие, образуют несколько оксидов. Восстановление, как и диссоциация, в этом случае протекает в две или более стадий. Для оксидов железа, например, при температурах выше 840 K восстановление протекает по трехстадийной схеме:
3Fe2O3(T) H2 |
2Fe3O4(T) |
H2O ; |
(6.2) |
2Fe3O4(T) 2H2 |
6FeOT 2H2O ; |
(6.3) |
|
6FeO 6H2 6FeT 6H2O . |
|
(6.4) |
|
При температурах ниже 840 K Fe3O4 восстанавливается сразу до железа, поэтому процесс восстановления Fe2O3 двухстадийный:
3Fe2O3(T) H2 2Fe3O4(T) H2O ; |
(6.5) |
2Fe3O4 8H2 6Fe 8H2O . |
(6.6) |
Одинаковое количество атомов железа, участвующего в каждой реакции, приведено для облегчения оценки относительного количества кислорода на каждой стадии процесса.
На рис. 6.1 линия равновесного состава газа для реакции (6.2) нанесена условно, вследствие необратимости этой реакции газовая фаза практически полностью состоит из паров воды.
Используя рис. 6.1, можно при заданной температуре, общем давлении и парциальном давлении одного из газов определить область существования конденсированной фазы (железа, вюстита, магнетита
110
