
основы меаллургических процессов
.pdf
12 (FeO Cr2O3 ) [Si] [Cr] 12 [Fe] SiO2(т) .
Константа равновесия этой реакции равна:
|
a |
|
a1 2 |
|
a |
SiO2 |
|
||
KP |
|
[Cr ] |
|
[Fe] |
|
. |
|||
|
a1(FeO2 |
Cr O |
) a[Si] |
||||||
|
|
|
|
2 |
3 |
|
|
|
|
Отрицательное значение изменения стандартной энергии Гиббса этой реакции при температурах процесса 1900–2000 K невелико.
Образование раствора хрома в железе, т.е. уменьшение активности [Fe] и [Cr] способствует смещению равновесия вправо. Однако образование силикатов хрома уменьшает полноту восстановления хрома, в результате этого остаточное содержание Cr2O3 в шлаке может быть достаточно высоким (до 28 %). Иногда путем металлотермического восстановления осуществляется получение летучих металлов высокой чистоты. Примером такого процесса может служить алюмино-термическое получение чистого кальция. При атмосферном давлении реакция
2CaO 4 3 Al 2Ca г 2 3 Al2O3 т
осуществляется при температурах выше 2300 °C. Смещение равновесия вправо может быть достигнуто путем понижения давления: при p = 10–5 МПа температура, при которой будет происходить восстановление CaO, снижается примерно до 1200 °C.
В металлургическом производстве определенное распространение имеют процессы с участием галогенидов металлов. Это связано с тем, что исходное сырье содержит галогениды (например, при производстве магния используют карналлит MgCl2·KCl·6H2O, при производстве алюминия – криолит Na2AlF6). Промежуточные продукты технологической цепочки или добавки могут также содержать галогениды (например TiCl, при получении титана, CaF2 в качестве добавок).
Вобщем виде реакцию металлотермического восстановления
|
|
галогенида можно записать: MeГ Ме |
Ме Г Ме . Используя |
значения изменения энергии Гиббса, можно найти для данного галогенида металл-восстановитель и температуру начала восстановления. Примером такой реакции может служить восстановление тетрахлорида титана магнием при получении титана, представленного формулой:
121
TiCl4 2Мg Ti 2МgCl2 ,
для которой G° = 0 при температуре T ≈ 2300 K.
Для восстановления TiCl4 возможно использование в качестве восстановителя других металлов, например кальция, который используется также для получения урана высокой частоты путем восстановления UF4.
6.5. Кинетические особенности восстановления газомвосстановителем и твердым углеродом
Примером восстановления хлоридов при помощи газоввосстановителей может служить процесс восстановления хлорида меди:
Cu2Cl2 г H2 2Cu т 2HCl .
Помимо переменных (T, p, V, xi), определяющих направление реакции и равновесное состояние, скорость процесса зависит от многих других параметров. Применительно к процессам восстановления среди таких параметров находятся размер и форма частиц, наличие катализаторов, состояние поверхности, характеристики продукта реакции и др.
Реакции восстановления являются, как правило, гетерогенными, где реагенты представляют две или более фазы и реакция протекает на границах раздела фаз.
В практике металлургического производства в настоящее время, с одной стороны, возросли возможности получения исходных оксидов с минимальным количеством примесей в результате развития техники обогащения руд. При переработке таких материалов существенное значение имеют кинетические закономерности восстановления чистых оксидов с комплексным учетом явлений тепло- и массообмена, сопровождающих процесс восстановления.
С другой стороны, в большей степени приходится использовать руды, содержащие несколько оксидов, – комплексные руды или концентраты. В ряде случаев необходимо вводить добавки оксидов в шихту. В большинстве реальных металлургических агрегатов в процессах восстановления участвуют не чистые оксиды, а более
122
сложные системы и реакции, которые, как правило, протекают в условиях изменяющихся температур.
Характерной чертой реакций восстановления твердых оксидов газами является локализация их протекания в определенных участках твердого реагента. Эти реакции, как и реакции диссоциации, относятся к топохимическим. Локализация места процесса в твердой фазе проявляется в том, что реакция начинается в определенных точках твердого тела, характеризующихся повышенной реакционной способностью и обычно находящихся на поверхности. Возникнув в определенном месте кристалла, реакция продолжает развиваться в результате продвижения реакционной зоны от центра, на котором началась реакция, в соседние области кристалла.
Так же, как и в случае диссоциации соединений, процесс восстановления твердого оксида газом включает несколько последовательных стадий:
1)диффузию реагентов к межфазной реакционной поверхности;
2)химическую реакцию на межфазной поверхности;
3)диффузию продуктов от межфазной поверхности.
К числу факторов, определяющих скорость процесса восстановления можно отнести:
1)температуру, влияющую на скорость химической реакции и диффузию;
2)химический и минералогический состав, микроструктуру, пористость, форму и размер оксидных частиц;
3)вид газа-восстановителя, состав, парциальное давление газавосстановителя, скорость его движения.
Если в общем виде реакцию восстановления оксида газом представить в виде уравнения:
a
MeOT B MeT BO , (6.31)
б
то суммарная скорость восстановления ω представляет собой разность скоростей протекания реакции в направлениях а и б. Скорости по направлениям а и б для чистого оксида стехиометрического состава можно принять пропорциональными поверхности и парциальным давлением газов. Тогда
|
dgMeO |
(ka pB k |
бpBO )S , |
(6.32) |
|
||||
|
d |
|
|
|
123

где kа и kб – константы скорости реакции в направлениях а и б, соответственно.
В состоянии равновесия ω = 0, а парциальные давления газов
равны равновесным величинам |
pio . |
|
Если |
общее давление pобщ |
||||||
постоянно, а также |
|
|
|
|
|
|
|
|
|
|
pобщ pB pBO poB poBO , |
KP = kа/kб, |
|
||||||||
то |
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
p |
общ |
|
|
|
kaS pB 1 |
|
|
|
|
, |
(6.33) |
||||
|
|
|
|
|||||||
|
|
|
KP |
KP |
|
|
|
|||
где KP – константа равновесия. |
|
|
|
|
|
|
|
|
|
|
Поскольку pобщ poB 1 1 KP , |
используя выражение |
(6.32), |
||||||||
получаем |
|
|
|
|
|
|
|
|
|
|
kaS 1 1 KP pB poB . |
(6.34) |
|||||||||
Вместо парциального давления газа можно использовать |
||||||||||
концентрацию ci или молярную долю xi. В этом случае ci pi |
/ RT , а |
|||||||||
xi pi / p и, таким образом, |
|
|
|
|
|
|
|
|
|
|
AS(cB coB ) , |
|
|
|
|
(6.35) |
|||||
где |
|
|
|
|
|
|
|
|
|
|
A ka RT 1 1 KP ;
ka pобщ 1 1 KP (xB xoB )S . |
(6.36) |
Температурная зависимость скорости восстановления определяется, таким образом, температурными зависимостями kа и KP. Газообразный восстановитель и газообразный продукт реакции диффундируют в противоположных направлениях через поры в твердом
124

слое продукта восстановления и в газовой фазе (пограничном газовом слое, окружа-ющем частицу оксида).
В соответствии с первым законом Фика, поток вещества i через поверхность S в направлении x равен:
j dn DS dc , d dx
где c – концентрация; D – коэффициент диффузии.
Диффузия газообразных составляющих через слой пористого продукта протекает в бинарной смеси восстановителя и продукта его окисления (H2 – H2O, CO–CO2 и др.). Коэффициент взаимной диффузии для бинарной смеси идеальных газов в открытой системе пропорцио-
нален T3 2 и обратно пропорционален давлению pобщ.
Для смеси реальных газов обычно используется коэффициент диффузии, равный:
D D0  p T
p T T0 n ,
T0 n ,
где D0 – коэффициент диффузии в нормальных условиях (T = 273 K; p =
0,1 МПа).
Величина D0 находится для газов в пределах от 0,1 до 1 см2/с
( D0 H2 H2O = 0,75 см2/с и D0 CO CO2 = 0,14 см2/с), величина n = 1,75÷2,0.
Диффузия газов через твердый продукт восстановления зависит также от величины относительной открытой пористости (S0) и так называемой извилистости пор χ. Величина χ определяется как эффективный путь, который проходит газовая молекула при продвижении в направлении диффузии на единицу длины.
Если пористое твердое тело представляет собой конгломерат одинаковых сферических частиц, то 
 2 и в общем случае
2 и в общем случае
D D1 S0 D1 S0 D1S0 ,
 2
2
где ξ = 1/χ (лабиринтный фактор).
Для большинства используемых в металлургии руд и агломератов величина D находится в пределах 0,03–0,3 см2/с.
125
При восстановлении плотной (беспористой) частицы газ не может проникать внутрь плотной беспористой частицы. В результате реакция восстановления протекает на межфазной (реакционной) поверхности оксид–продукт восстановления. В ряде случаев эту поверхность называют поверхностью реагирования.
Поверхность реагирования (реакционная поверхность) перемещается внутрь частицы и геометрически подобна (гомотетична) поверхности исходного образца. Если возник слой продуктов реакции, то для процесса восстановления необходим перенос газавосстановителя через этот слой к поверхности реагирования. В этом случае химическая реакция и диффузия протекают последовательно, поскольку в начале газ переносится к реакционной поверхности, а затем реагирует с оксидом.
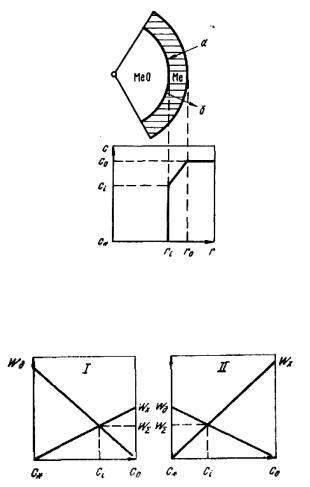
Рис. 6.4. Схема восстановления твердого оксида:
а – направление движения газа-восстановителя; б – направление движения газа, продукта реакции
Рис. 6.5. Схематическое изменение скоростей химической реакции и диффузии при изменении концентрации газа-восстановителя на поверхности: ωx – скорость химического превращения; ωД – скорость диффузии газа-восстановителя; ω∑ – суммарная скорость процесса; с – концентрация газавосстановителя; I – химический режим; II – диффузионный режим
126

Рис. 6.6. Смешанный режим восстановления
Рис. 6.7. Изменение состава газа при восстановлении в химическом режиме:
а – направление движения газа-восстановителя; б – направление движения газа, продукта реакции
Рис. 6.8. Взаимодействие газового потока и слоев восстанавливаемого оксида: а – неподвижный слой; б – встречное: в – попутное; г – скрестное; д – идеального смешения
На рис. 6.4 схематически показан общий случай изменения концентрации газа-восстановителя по радиусу сферической частицы оксида.
При образовании плотного слоя продукта, например железа, диффузия газов через слой продукта затруднена, и процесс восстановления оксида находится в диффузионной области реагирования. Когда образуется пористый слой продукта и доставка газа-восстановителя к поверхности реагирования не лимитирует
127
процесс в целом, имеет место кинетическая область реагирования, а общая скорость определяется скоростью химической реакции.
Если максимально возможные скорости (или обратные им величины сопротивлений) химической реакции и диффузии сопоставимы, то процесс протекает в смешанной области реагирования.
Схематически соотношение скоростей различных стадий процесса и суммарная скорость превращения приведены на рис. 6.5. Скорость химической реакции на поверхности реагирования пропорциональна
( ci cio ) и достигает максимума при ci cio . Скорость диффузии, если в
первом приближении принять градиент |
концентрации постоянным |
||||
(линейное |
изменение |
концентрации |
по |
радиусу), |
будет |
пропорциональна ( c0 ci ) и изменяется с изменением ci, как показано
на рис. 6.6, достигая максимального значения при ci cio .
Поскольку процессы диффузии и химического реагирования протекают последовательно, то количество газа, вступающего в реакцию в единицу времени должно быть равным количеству газа, продиффундировавшего к поверхности реагирования. При этом, так называемом квазистационарном приближении, скорости химической реакции и диффузии должны быть равны. Равенство наступает в точке ci, что и определяет скорость процесса в целом (рис. 6.7, 6.8).
Вид кинетических выражений будет различен для частиц различной формы. Прежде всего, это отличие будет проявляться в разном виде выражения для степени превращения.
Как известно, в общем случае степень превращения α может быть выражена как отношение объема прореагировавшего вещества к начальному объему и для сферической частицы радиусом r0 (или кубической со стороной r):
1 r / r0 3 , |
(6.37) |
а для плоской пластины с толщиной δ0 |
|
1 / 0 , |
(6.38) |
где r, δ – размеры непрореагировавшей части образца к моменту η.
В практических расчетах часто используют величину относительного продвижения фронта реагирования f, которая равна соответственно:
128

f |
r0 r |
1 1 1 3 |
; |
(6.39) |
||
|
||||||
|
r0 |
|
|
|
|
|
f |
0 |
. |
|
(6.40) |
||
|
|
|||||
|
|
|
0 |
|
|
|
Скорость превращения твердого оксида (ω) в молях за единицу времени пропорциональна изменению объема твердого реагента в единицу времени и представлена формулой:
0 |
dV |
, |
(6.41) |
|
d |
||||
|
|
|
где γ0 – коэффициент пропорциональности (число молей в единице объема).
Необходимо отметить, что для сферической частицы
df 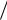 d
d 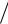 0r0S ,
0r0S ,
а для плоской частицы
df d 0 0S . |
(6.42) |
Кинетические уравнения в случае смешанного режима определяют-ся скоростью химической реакции на поверхности реагирования и диффузией газа к реакционной поверхности, которая зависит от величины коэффициента диффузии и градиента концентрации. Для сферической частицы оксида поток газавосстановителя к реакционной поверхности характеризуется выражением:
|
4 Dr2 |
dc |
. |
|
(6.43) |
|
|
||||
д |
|
dr |
|
||
|
|
|
|
|
|
Интегрируя это выражение (в |
пределах |
r r0 |
и ci c0 ) и |
||
используя квазистационарное приближение, можно получить уравнение скорости диффузии:
129

|
4 r0r |
D c |
|
c |
|
, |
(6.44) |
|
|
0 |
|||||||
д |
r0 |
r |
|
i |
|
|||
|
|
|
|
|
|
|
||
которая равна скорости химической реакции и будет:
Ar2 ci co D |
r0r |
c0 |
ci . |
(6.45) |
||||||
r0 r |
||||||||||
|
|
|
|
|
|
|
|
|
||
При переходе от r к относительной доле превращения f |
||||||||||
концентрационные отношения определяются следующим образом: |
|
|||||||||
|
ci |
co |
1 |
|
|
|
|
|||
|
|
|
|
|
|
|
(6.46) |
|||
|
c0 |
co |
1 r0Af 1 f |
D |
||||||
и позволяют найти связь между f и ( ci co ) из формулы:
0r0 |
df |
|
|
A ci co |
(6.47) |
|
d |
S |
|||||
|
|
|
|
Подставляя (6.47) в (6.46), можно получить уравнение:
|
r |
df |
|
|
A c0 co |
|
|
|
|
|
|
, |
|||
|
|
r Af |
1 f D |
||||
0 0 d |
1 |
||||||
|
|
|
|
|
0 |
|
|
которое после интегрирования (0÷η, 0÷f) приобретает окончательный вид:
1 |
|
r |
f 2 3 2f |
c |
0 |
co |
|
|
|
f |
0 |
|
|
. |
(6.48) |
||
|
|
|
|
|
||||
A |
|
D |
|
|
0r0 |
|
||
Если использовать такой же подход, то и для плоской частицы можно получить зависимость относительной величины продвижения фронта реагирования от концентрации газа-восстановителя по формуле:
130
