
- •Б.Я. Брянский, т.А. Калинина
- •1.1. Основные понятия химической термодинамики 7
- •1. Конспект теоретического материала
- •1.1. Основные понятия химической термодинамики
- •1.1.1. Термодинамическая система
- •1.1.2. Состояния, свойства термодинамической системы.
- •1.2.1. Уравнение состояния термодинамической системы. Нулевой
- •1.2.2. Идеальный газ и его уравнение состояния
- •1.2.3. Реальный газ и его уравнения состояния
- •В критической точке одному давлению соответствует не три объёма, а один (см. Рис.1). Следовательно, для этой точки кубическое уравнение принимает следующий вид:
- •1.3. Первый закон термодинамики
- •1.3.1. Функции состояния и формы обмена энергией
- •1.3.2. Содержание первого закона термодинамики
- •1. При поглощении теплоты система увеличивает внутреннюю энергию и совершает работу:
- •2. При уменьшении внутренней энергии система выделяет теплоту и совершает работу:
- •1.3.3. Расчёт работы
- •1.3.4. Расчёт теплоты. Теплоёмкость
- •1.3.5. Адиабатический процесс
- •1.4. Начальные понятия термохимии
- •1.4.1. Тепловой эффект химической реакции с точки зрения
- •1.4.2. Стандартные молярные энтальпии (смэ) реакций и фазовых
- •1.5. Термохимические расчёты
- •1.5.1. Расчёт стандартной энтальпии реакции через стандартные энтальпии образования участников реакции
- •1.5.2. Расчёт стандартной энтальпии реакции через стандартные энтальпии сгорания участников реакции
- •1.5.3. Расчёт стандартной энтальпии реакции через энергии связей участников реакции
- •1.5.4. Расчёт стандартной энтальпии решётки (цикл Борна-Габера)
- •1.5.5. Расчёт стандартной энтальпии гидратации и
- •1.5.6. Расчёт энтальпии реакции при произвольной температуре
- •1.5.7. Связь энтальпии реакции с изменением внутренней энергии
- •1.6. Энтропия и второй закон термодинамики
- •1.6.1. Энтропия и её статистический смысл
- •1.6.2. Второй закон термодинамики
- •1.6.3. Расчёты изменения энтропии в равновесных процессах
- •1.7. Применение второго закона термодинамики к неизолированным изотермическим системам
- •1.7.1. Энергии Гельмгольца и Гиббса
- •1.7.2. Расчёт энергии Гиббса реакции
- •1.7.3. Термодинамические потенциалы. Соотношения Максвелла
- •1.8. Закон действующих масс
- •1.8.1. Химический потенциал. Фундаментальное уравнение Гиббса
- •1.8.2. Вывод закона действующих масс
- •1.8.3. Принцип Ле Шателье – Брауна
- •2. Лабораторные работы по термохимии
- •2.1. Общие замечания.
- •2.2. Определение постоянной калориметра
- •2.3. Лабораторная работа 1. Определение парциальной мольной энтальпии растворения вещества
- •Порядок выполнения работы
- •Контрольные вопросы
- •2.4. Лабораторная работа № 2. Определение теплоты реакции нейтрализации сильной кислоты сильным основанием
- •Порядок выполнения работы
- •Контрольные вопросы
- •2.5. Лабораторная работа № 3. Определение теплоты диссоциации слабой кислоты
- •Порядок выполнения работы
- •1. Определяют постоянную калориметра (см. П.2.1).
- •3. Определение теплоты реакции нейтрализации (Qнейтр) проводят по методике предыдущей лабораторной работы или используют табличные данные (по указанию преподавателя).
- •8. Рассчитывают теплоту реакции нейтрализации соляной кислоты гидроксидом натрия (Qнейтр) по методике предыдущей работы, либо используют справочные данные.
- •Контрольные вопросы
- •2.6. Лабораторная работа № 4. Определение теплоты гидратообразования соли
- •Порядок выполнения работы
- •Контрольные вопросы
- •2.7. Лабораторная работа № 5. Определение теплоты реакции окисления щавелевой кислоты перманганатом калия
- •Порядок выполнения работы
- •Контрольные вопросы
- •2.8. Лабораторная работа № 6. Определение теплоты испарения органических жидкостей
- •Порядок выполнения работы
- •Контрольные вопросы
- •5. Рассчитайте изменение внутренней энергии при испарении 1 моль органической жидкости, теплоту испарения которой вы определили экспериментально.
- •3. Рекомендации к практическим занятиям
- •3.1. Рекомендации для успешного решения задач
- •3.2. Материалы к практическим занятиям
- •3.2.1. Уравнения состояния идеальных и реальных газовых систем
- •3.2.2. Первый закон термодинамики. Вычисление внутренней энергии,
- •3.2.3. Тепловой эффект химической реакции. Закон Гесса. Зависимость теплового эффекта от температуры. Формула Кирхгофа
- •3.2.4. Второй закон термодинамики. Вычисление изменения энтропии в различных процессах. Расчёт абсолютной энтропии веществ
- •3.2.5. Термодинамические потенциалы. Соотношения Максвелла
- •3.2.6. Закон действующих масс. Расчёт равновесного состава
- •3.2.7. Уравнение изотермы химической реакции
- •3.2.8. Зависимость константы равновесия от температуры. Уравнения
- •3.2.9. Методы расчета константы равновесия и энергии Гиббса реакции
- •4. Методические рекомедации и справочные материалы
- •4.1. Основные правила работы при проведении лабораторных работ по термохимии
- •4.2. Основные правила построения и оформления графиков
- •4.3. Рекомендации по применению международной системы единиц си
- •4.4.Таблицы физико-химических данных
- •Литература
- •Дополнительная
- •Часть 1 Издательство ОмГу
- •644077, Г. Омск, пр. Мира, 55а, госуниверситет
Порядок выполнения работы
1. Определяют постоянную калориметра, используя термометр Бекмана (см. п. 2.1).
2. Определяют изменение температуры реакционной смеси при проведении реакции окисления щавелевой кислоты перманганатом калия. Для этого:
- настраивают термометр Бекмана в пределах от 00 до 10;
- в калориметрический стакан из бюретки вносят 68 мл H2O, 50 мл 30%-ного раствора H2SO4 и 32 мл 0,5 н раствора KMnO4. Включают мешалку;
- фиксируют показания термометра через каждые 30 с в течение 5 минут;
- после 10 отсчётов через воронку, вставленную в отверстие крышки калориметра, всыпают 1,2 г H2C2O4, взвешенную на аналитических весах, и продолжают записывать изменения температуры через каждые 30 секунд в течение 5 минут;
- результаты заносят в таблицу (табл. 2.1);
- повторяют эксперимент, но для реакции берут навеску щавелевой кислоты 0,8 г.
2. Определяют истинное изменение температуры в ходе каждого опыта графическим методом.
3. Вычисляют молярную теплоту реакции окисления щавелевой кислоты для обоих опытов по уравнению:
Q = [(m1 + m2)c +K]ΔtМ/m2 - QраствΔ m/ m2
где m1 – масса раствора, г; m2– масса щавелевой кислоты, г; с – теплоемкость образующегося раствора, Дж(гК); M – молярная масса щавелевой кислоты; К – постоянная калориметра, t – действительное изменение температуры, Δ m – избыток щавелевой кислоты (в первом случае равен 0,4, ,во втором – нулю); Qраств = -35,31 кДж/моль - теплота растворения щавелевой кислоты.
4. Делают вывод о полноте протекания реакции окисления щавелевой кислоты перманганатом калия, сопоставив тепловые эффекты обоих опытов.
Контрольные вопросы
1. Что означает термин «тепловой эффект химической реакции» ?
2.Что понимают под «стандартной теплотой образования» вещества?
3. Что понимают под «стандартной теплотой сгорания» вещества?
4. Сформулируйте закон Гесса и следствия из него.
5. Докажите, что закон Гесса является следствием первого закона термодинамики.
6. Покажите связь между тепловыми эффектами реакции при постоянном давлении и постоянном объёме.
7. Вычислите энтальпию реакции окисления щавелевой кислоты перманганатом калия по закону Гесса через энтальпии образования реагентов и продуктов. Используйте следующие данные:
а) ΔfH перманганата и сульфата калия можно считать независящими от концентрации: ΔHKMnO4= -769,65 кДж/моль и ΔHK2SO4= - 1408,96 кДж/моль;
б) ΔfHC2H2O4 (тв.)= – 1426,33 кДж/моль, ΔfH H2O = – 285,85 кДж/моль;
в) энтальпии образования растворов H2SO4 и MnSO4 определите из значений интегральных энтальпий растворения;
г) углекислый газ, выделяющийся в результате реакции окисления, можно считать, находится в газообразном состоянии: ΔfH CO2(г)= –94,015 ккал/моль;
д) энтальпия растворения C2H2O4∙2H2O равна – 35,31 кДж/моль.
2.8. Лабораторная работа № 6. Определение теплоты испарения органических жидкостей
Цель работы: познакомиться с методом определения теплоты испарения жидкостей.
Определение теплоты испарения основано на измерении количества подведённой теплоты, необходимой для испарения вещества, и взвешивании конденсата.
Тепло, сообщённое жидкости нагревателем, идёт на её испарение и излучение:
U·J·τ = g·L + x,
где U – напряжение, В; J – сила тока, А; τ – время, с; g – масса собранного конденсата, г; L – удельная теплота испарения, Дж/г; х – потери тепла (на излучение и прочее), Дж.
Так как потеря тепла по закону Ньютона пропорциональна разности температур жидкости и окружающей среды, а температура кипящей жидкости постоянна, то потери тепла в обоих опытах можно считать одинаковыми.
Тогда для первого опыта U1J1τ = g1L+x, для второго: U2J2τ = g2L+x.
Отсюда удельная теплота испарения:
L= τ·(U2J2 –U1J1 )/(g2 – g1) (2-3)
Реактивы и оборудование: органические жидкости (ацетон, гексан, пропиловый спирт и др.). Прибор для определения теплоты испарения (рис. 2.3), вольтметр, амперметр, источник постоянного тока (выпрямитель), три конические колбы на 25-50 мл с притёртыми пробками, секундомер.
П рибор
для определения теплоты испарения
состоит из кипятильника 1 и холодильника
2 . Через отверстие в пришлифованной
пробке 3 с помощью толстых медных проводов
в кипятильник вставлен нихромовый
спиральный нагреватель 4 сопротивлением
около 30 Ом, присоединённый к источнику
постоянного тока (выпрямителю) 7 (рис.3).
рибор
для определения теплоты испарения
состоит из кипятильника 1 и холодильника
2 . Через отверстие в пришлифованной
пробке 3 с помощью толстых медных проводов
в кипятильник вставлен нихромовый
спиральный нагреватель 4 сопротивлением
около 30 Ом, присоединённый к источнику
постоянного тока (выпрямителю) 7 (рис.3).
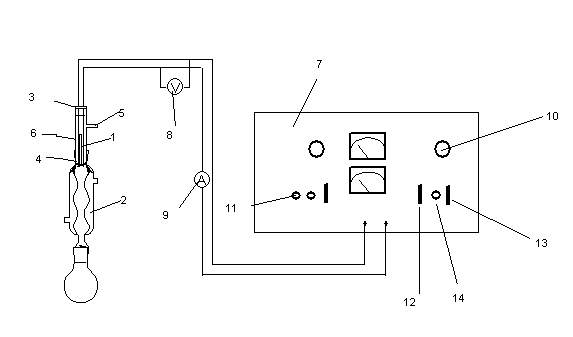
Рис.2.3. Схема установки для определения теплоты испарения органических жидкостей. 1-кипятильник, 2- холодильник, 3- пробка, 4- нихромовый спиральный нагреватель, 5 - патрубок для заливания жидкостей, 6- патрубок, соединяющий кипятильник и холодильник, 7- выпрямитель, 8- вольтметр, 9- амперметр
