
- •По вопросам приобретения книги
- •Глава 1
- •Глава 2 физиология мышц
- •Глава 3 физиология синаптической передачи
- •Глава 4 процессы управления в живых системах
- •Глава 5
- •Глава 6
- •Глава 7 физиология вегетативной нервной системы
- •Глава 8 сенсорные системы мозга
- •Глава 9 учение о высшей нервной деятельности
- •Глава 10
- •1. Механизм действия стероидных гормонов.
- •2. Механизм действия тнреондных гормонов.
- •3. Механизм действия белковых гормонов, катехоламинов, серотоннна, гистамвна.
- •Глава 11
- •Глава 12
- •11 .Физиология человека
- •Глава 13 физиология крови
- •1) Фагоцитоз; 2) внутриклеточное переваривание; 3) цитотоксическое действие; 4) дег-рануляция с выделением лизосомальных ферментов.
- •Азкц — антителозависимая клеточная цитотоксичность — реализуется с участием к-клеток, т-лимфоцитов, макрофагов, нейтрофилов и при наличии антител к данной чуже родной клетке.
- •Глава 14 группы крови. Свертывание крови
- •А нтигены
- •Кровезаменители дезинтоксикационного действия: гемодез, полидез или неогемодез,
- •Препараты для белкового парентерального питания: гидролиэат казеина, гидроли- эин, аминопептид, аминокровин, аминокислоты в смеси (полиамин, левамин, амнион).
- •Глава 15 физиология сердца. Гемодинамика
- •Глава 16
- •15. Физиология человека
- •16. Физиология человека
- •Глава 17 регуляция кровообращения
- •2. Гетерометрический и гомеометрические механизмы саморегуляция: деятельности сердца. А. Закон сердца, или закон Франка-Старлинга: чем больше растянута мышца сердца,
- •2. Пример, поясняющий роль вазокардиальных рефлексов: при повышении кровяного давления в области дуги аорты или в области каротидного синуса, где имеется большое
- •17. Физиология чедежка
- •Глава 18 органное кровообращение
- •Глава 19
- •2) При форсированном (глубо ком) вдохе человек может допол нительно вдохнуть определенный
- •После максимального выдоха в легких остается определенный объем, который ни при каких условиях не покидает легкие, — остаточный объем легких (оол), в среднем он. Ра вен 1200 мл.
- •18. Физиология человека
- •Дыхательная апраксия. Наблюдается при поражении нейронов лобных долей. Боль* ной не способен произвольно менять ритм и глубину дыхания, но обычный паттерн дыха ния у него не нарушен.
- •Нейрогенная гипервентиляция. Дыхание частое и глубокое. Возникает при стрессе, при физической работе, а также при нарушениях структур среднего мозга.
- •Глава 20
- •19. Физиология человека
- •Глава 21
- •Глава 22
- •20. Физиология человека
- •1. Сократительный термогенез — продукция тепла в результате сокращения скелетных мышц:
- •2. Несократительный термогенез, или недрожательный термогенез (продукция тепла в результате активации гликолиза, Лшкогенолиза и липолиза):
- •Паровые бани, например, русская баня. Иногда их называют «парильнями» (темпера тура 45—60°с, влажность — 90—100%);
- •Суховоздушные бани, например, финская баня или сауна (температура среды 90— 120°с, влажность —10—15%).
- •Глава 23
- •21. Физиология человека
- •Глава 24
- •22. Физиология человека
- •Глава 25
- •Желчные кислоты,
- •Желчные пигменты,
- •Холестерин.
- •Смешанные мицеллы. Такие мицеллы содержат холестерин, желчные кислоты и фос- фатидилхолин (мицеллярная фракция).
- •Внемицеллярный жидкостно-кристаллический холестерин в водном окружении желчи.
- •3) Твердокристаллический холестерин (осадок). Жидкостно-кристаллический холестерин нестабилен, он стремится перейти в одну из
- •Оценка гидролиза и всасывания
- •Глава 26 физиология питания
- •3) Физиологическое распределение количества пищи по ее приемам в течение дня (см. Выше).
- •2) Особенности пищевых рационов для работников умственного труда.
- •Глава 27 выделение. Физиология почки
- •25. Физиология человека
- •Глава 28
- •Глава 29
- •26. Физиология человека
- •Глава 30 время и функции организма
- •Ритмы высокой часто ты. К ним относятся все ко лебания с длительностью цик ла не более 0,5 часа.
- •Ритмы средней частоты: ультрадвый (ультрадианный)
- •3. Ритмы низкой частоты: циркавижинтанный (с 20- дневной длительностью), циркатригинтанный (соответ ствует лунному месяцу — около 30 дней), цирканнуаль- ный (годичный).
- •Глава 31 физиология трудовых процессов
- •28. Физиология человека
- •Глава 32 экология человека
- •Демографической структуры национальной и этнической структуры состояния здоровья населения
- •Глава 33 экология и продолжительность жизни
- •250 Тыс._ младенцев рождаются ежедневно. 1040 — в час, 3 — в секунду. За 21 день рождается столько, сколько составляет население большого города, за 8 месяцев — фрг, за 7 лет — Африки.
- •Глава 34 возрастная физиология*
- •31. Физиология человека
- •32. Физиология человека
- •Глава 35 физиология старения*
- •Оглавление
- •Глава 1 V 5
- •Глава 2 и
- •Глава 4 34
- •Глава 6 so
- •Глава 8 76
- •Глава 9 „ юз
- •Глава 11 131
- •Глава 12 ш
- •Глава 13 — из
- •Глава 14 ; 194
- •Глава 15 204
- •Глава 16 224
- •Глава 17 244
- •Глава 18 259
- •Глава 19 271
- •Глава 20 279
- •Глава 21 294
- •Глава 22 зог
- •Глава 24 .; 329
- •Глава 25 340
- •Глава 26 354
- •Глава 27 , 370
- •Глава 28 зев
- •Глава 29 „ - 396
- •Глава 30 407
- •Глава 31 , 418
- •Глава 32 : 4зв
- •Глава 33 4so
- •Глава 34 .... . «. 458
А нтигены
С овременный вариант: Rho (D): rh'(C): rhu(E): Нго (d): hr'(c): hr"(e)
Н аиболее
активным в антигенном отношении является
антиген D,
в меньшей степени — С
и Е, а тем более d,
с, е. Реципиент имеет резус-положительную
кровь, если его эритроциты
обязательно содержат антиген D.
Антиген D
выявляется у 86% людей, С — у 70,8%, Е
— у 31,0%, d
— у 99%, с -*■у 84%; е — у 86%. Учитывая, что
антиген D
определяет принадлежность
людей к группе резус-положительных,
таких людей среди европейцев много —
86%, у представителей монгольской расы
— 100%. ■•
аиболее
активным в антигенном отношении является
антиген D,
в меньшей степени — С
и Е, а тем более d,
с, е. Реципиент имеет резус-положительную
кровь, если его эритроциты
обязательно содержат антиген D.
Антиген D
выявляется у 86% людей, С — у 70,8%, Е
— у 31,0%, d
— у 99%, с -*■у 84%; е — у 86%. Учитывая, что
антиген D
определяет принадлежность
людей к группе резус-положительных,
таких людей среди европейцев много —
86%, у представителей монгольской расы
— 100%. ■•
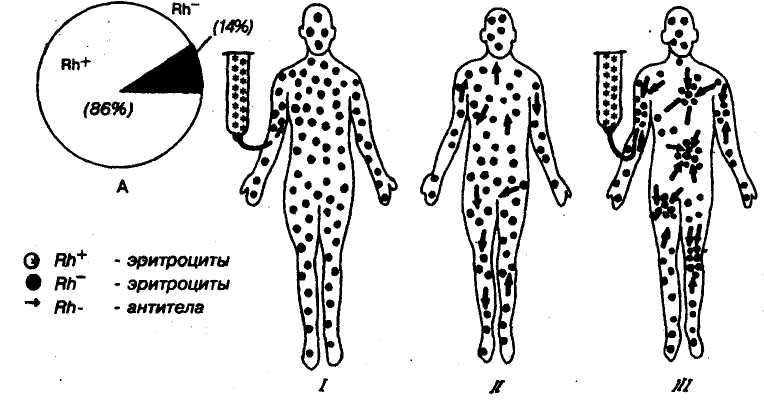
Рис. 55. Резус-фактор крови у людей (Rh).
А—распределение (Rh+) и (Rh~) (среднеевропейские данные),
Б — реакция агглютинации, возникающая у Rlv реципиента при повторном переливании
ему Rh+ донорской крови.
А нтиген
D
является основной причиной сенсибилизации
(иммунизации) во время беременности
и гемолитической болезни новорожденных,
он легко проникает через плаценту.
нтиген
D
является основной причиной сенсибилизации
(иммунизации) во время беременности
и гемолитической болезни новорожденных,
он легко проникает через плаценту.
В настоящее время известны и другие факторы резус-системы. Из них особый интерес представляет вариант фактора D, который обозначается D . Он не всегда определяется в эритро-
196
цитах, но в ответ на его введение у резус-отрицательного человека вырабатывается анти-D. Поэтому у резус-отрицательного человека необходимо определить и отсутствие антигена D".
В эритроците антигены системы резус находятся в виде группы антигенов. Наиболее частые комбинации такие: CDE — 16%, CDe — 53%, cDE — 15%, cde — 12%. У аборигенов Австралии в эритроцитах не выявлен ни один представитель системы резус. Такой вариант называют резус-нуль.
Для определения резус-принадлежности, т.е. выявления антигенов системы резус в эритроцитах используют стандартные сыворотки (реагенты) антирезус, различные по специфичности, т.е. содержащие антитела к разным антигенам этой системы. Для определения антигена D чаще всего применяют сыворотку антирезус с добавлением 10% раствора желатина или используют стандартный реагент антирезус, приготовленный заранее с 33% раствором полиглкжина.
РЕЗУС-НЕСОВМЕСГИМОСГЬ В СИСТЕМЕ МАТЬ — ПЛОД
Если у матери с резус-отрицательной кровью развивается резус-положительный плод, то при первой беременности вероятность иммунизации матери эритроцитами плода зависит от объема проникающих в русло матери этих эритроцитов. Обычно до 8-й недели эритроциты не способны проходить плацентарный барьер, в последующие недели беременности они в небольших количествах могут проникать в русло матери. Значительное поступление эритроцитов плода в организм матери наблюдается в период родовой деятельности. Ответ материнского организма зависит от объема проходящих эритроцитов: если входят малые количества, то развивается толерантность, т.е. материнский организм не синтезирует антитела к резус-фактору. Если проходят большие количества (более 0,1—0,5 мл), то вырабатываются антитела — иммуноглобулины IgG, которые проникают через плаценту и вызывают внутрисосудистый гемолиз эритроцитов плода. Обычно при первой беременности до родов массивного проникновения эритроцитов не происходит, поэтому антитела появляются лишь после родов, вызывая агглютинацию за счет перехода из материнского молока в организм ребенка. При повторной беременности (если не было иммунопрофилактики) за счет клеток-памяти продукция антител идет интенсивнее.
У10% резус-отрицательных женщин беременность протекает без образования антител. Это происходит за счет толерантности. Самые ранние признаки резус-конфликта при первой беременности — после 24 недель.
С целью иммунопрофилактики Финн Р. и соавт. (1961) предложили вводить женщине внутримышечно сразу же после родов или аборта в первые 72 часа анти-D антитела в дозе 250— 300 мкг. Эта доза нейтрализует 30 мл крови плода, попадающей при родах в материнский кровоток. Это позволило снизить детскую смертность из-за гемолитической болезни с 10% до 0. Предполагают, что в основе защитного действия такой процедуры лежит образование комплекса антигена D с анти-D, в результате чего этот комплекс выводится из организма, поэтому антигены D не успевают иммунизировать мать. Не исключено, что механизм защиты иной: вводимые антитела блокируют антигенчувстительность Т-хелперов и тем самым предотвращают иммунизацию. Возможно, что вводимые антитела активируют Т-супрессоры.
Во время беременности наблюдается несовместимость по АВО, Кидд, Даффи и другими системам, но они составляют 1—2% всех случаев несовместимости.
ДРУГИЕ СИСТЕМЫ
В практике трансплантации органов и тканей имеют значения и другие антигенные системы эритроцитов. Как правило, каждая система представлена двумя и более антигенами, сила которых обычно небольшая, поэтому вызывать образование антител они не могут. Лишь некоторые из них имеют значение в развитии гемотрансфузионных осложнений или несовместимости крови матери и плода. Итак, это система Левис, система Р-р, система Келл (достаточно активные антигены, проявляющие себя при гемотрансфузии и беременности), системы Даффи, Кидд, Лутеран, Аи, Диего, Оберже, Домброк. Детальное описание этих систем дается в монографиях, например «Групповые системы крови человека и гемотрансфузиониые осложения» (1989).
197
Антигены лейкоцитов. Лейкоциты имеют более 90 антигенов. Часть из них — это эрит-роцитарные антигены систем АВО, Кидд, Даффи и других, за исключением резус-системы. Кроме того, лейкоциты содержат антигены главного локуса HLA (Humen Leycocit antigen), которым принадлежит ведущая роль в трансплантационном иммунитете. Они получили название антигенов гистосовместимости.
СВЕРТЫВАНИЕ КРОВИ. СИСТЕМА PACK. ГЕМОСТАЗ
Кровь обладает текучестью, зависящей от уровня гематокрита, содержания в плазме белков и других факторов. Основная роль принадлежит системе PACK (регуляции агрегатного состояния крови). В интактном организме текучесть крови максимальная, что способствует оптимальному кровообращению. При травме кровь должна свертываться. Это — гемостаз. В основе гемостаза лежат сложнейшие механизмы, в которых принимают участие многочисленные факторы свертывающей, противосвертывающей и фибринолитической систем.
Первые шаги по пути раскрытия механизмов свертывания крови сделал более 100 лет тому назад дерптский физиолог А. А. Шмидт. Он обнаружил некоторые факторы свертывания, признал ферментативную природу реакций и их фазность.
В ответ на повреждение сосуда развертываются два последовательных процесса — сосу-дисто-тромбоцитарный гемостаз и коагуляционный гемостаз.
СОСУДИСТО-ТРОМБОЦИТАРНЫЙ ГЕМОСТАЗ
Эндотелий сосудов, или интима, препятствует свертыванию крови путем секреции про-стациклина ПГИ2 — ингибитора агрегации тромбоцитов, а также секреции антикоагулянта антитромбина-Ш. Важную роль в этом играет способность интимы сорбировать на своей поверхности гепарин, являющийся мощным антикоагулянтом. Кроме того, эндотелий сосудов способен секретировать мощные активаторы фибринолиза.
В отличие от эндотелия, субэндотелиальный слой сосуда, наоборот, способствует коагуляции, в том числе за счет наличия в этом слое коллагена — активатора тромбоцитов и фактора Хагемана (ХНф), от активности которого зависит процесс коагуляции.
При повреждении сосуда (нарушении целостности эндотелия и субэндотелия) происходит образование тромба, чему способствуют свойства субэндотелия. Одновременно, в ответ на повреждение сосуда возникает спазм гладких мышц под влиянием серотонина. Все это уменьшает кровоток из поврежденного сосуда.
Тромбоциты развиваются из стволовой кроветворной клетки (СКК -> КОЕ смешанная -> КОЕ мегакариоцитарная -> мегакариобласт -> мегакариоцит -^ тромбоцит). Концентрация их в крови достигает 180—32Ох 109/л. Они выполняют 4 основные функции:
совершают ангиотрофику, т. е. питание сосудистой стенки;
образуют тромбоцитарную пробку;
поддерживают в спазмированном состоянии гладкие мышцы поврежденного сосуда;
участвуют в свертывании крови и фибринолизе.
Ангиотрофическая функция проявляется в том, что тромбоциты «вливают» свое содержимое в эндотелий, «подпитывают» его. На эти нужды используется около 15% циркулирующих в крови тромбоцитов. При тромбоцитопении (снижении уровня тромбоцитов ниже 150х10'/л), развивается дистрофия эндотелия, в результате чего эндотелий начинает пропускать через себя эритроциты, возникает диапедез, кровоизлияние, выход эритроцитов в лимфу. При этом наблюдается повышенная ломкость сосудов.
Адгезивно-агрегационная функция тромбоцитов заключается в том, что тромбоциты способны приклеиваться в местах повреждения сосудистой стенки и образовывать здесь тромбоцитарную пробку, благодаря которой мелкие сосуды могут полностью прекратить кровить. Образование тромбоцитарной пробки происходит в две фазы: вначале идет адгезия тромбоцитов к субэндотелиальным структурам, т.е. к базальной мембране. Этому процессу способствует коллаген. Адгезия завершается в пределах 3—10 с от момента повреждения сосуда. Затем происходит внутрисосудистая агрегация — скучивание и склеивание тромбоцитов и
198
 образование
конгломератов из 10—20 тромбоцитов,
которые приклеиваются к месту повреждения.
В целом, тромбоцитарная пробка формируется
в пределах 1—3 минут от момента
повреждения.
Образованию тромбоцитарной пробки
способствуют фактор Виллебранда
(продуцируется сосудистой стенкой),
коллаген, АДФ, адреналин, тромбин,
серотонин. Тормозят этот процесс
простациклин 111И2
(продуцируется эндотелием), токоферолы
и другие факторы.
образование
конгломератов из 10—20 тромбоцитов,
которые приклеиваются к месту повреждения.
В целом, тромбоцитарная пробка формируется
в пределах 1—3 минут от момента
повреждения.
Образованию тромбоцитарной пробки
способствуют фактор Виллебранда
(продуцируется сосудистой стенкой),
коллаген, АДФ, адреналин, тромбин,
серотонин. Тормозят этот процесс
простациклин 111И2
(продуцируется эндотелием), токоферолы
и другие факторы.
В микроциркулярном русле тромбоцитарная пробка обеспечивает надежную остановку кровотока. После образования тромба происходит ряд процессов, которые увеличивают надежность гемостаза: образование мостиков между тромбоцитами, входящими в состав пробки (стадия мягкого метаморфоза), и процесс сжатия, укорочения, уплотнения, который осуществляется под влиянием тромбостенина тромбоцитов за счет сокращения актин-миозинового комплекса тромбоцитов (стадия необратимого метаморфоза).
Тромбоциты играют важную роль и в гемокоагуляции, т. е. свертывании крови: они содержат собственные факторы, способствующие свертыванию крови, в том числе:
ПФ-3 — пластинчатый фактор 3, представляющий из себя липидно-белковый комплекс, на котором как на матрице происходит гемокоагуляция;
ПФ-4 — пластинчатый фактор 4, или антигепариновый факторi белковой природы;
ПФ-5 — фибриноген, благодаря которому тромбоциты обладают способностью к агде-зии и агрегации;
ПФ-6 — тромбостенин, т.е. актиномиозиновый комплекс, обеспечивающий сжатие и уплотнение тромба;
ПФ-10 — серотонин;
ПФ-11 — фактор агрегации, представляющий собой комплекс АТФ и тромбоксана.
ГЕМОКОАГУЛЯЦИЯ—ФЕРМЕНТАТИВНЫЕ ПРОЦЕССЫ
Процесс заключается в ферментативном превращении фибриногена (растворимого белка) в фибрин — нерастворимый белок, в результате чего образуется кровяной сгусток, или тромб, закупоривающий выход из сосуда. Для реализации коагуляции необходимо участие различных факторов, которые получили название факторов свертывания, или факторов свертывающей системы крови. В настоящее время известно 15 таких факторов, часть которых имеет название, связанное с фамилией больного, у которого впервые обнаружен дефицит соответствующего фактора. Согласно Международной номенклатуре, каждый из 15 факторов имеет римскую нумерацию (см. таблицу ниже).
Таблица 7. Номенклатура факторов свертывания крови
N
 фак-ра Название фактора
фак-ра Название фактора
фибриноген (норма 2—4 г/л)
протромбин
тканевой тромбопластин
ионы кальция
проакцелерин, или Ас-глобулин (он же VI фактор)
конаертин
антигемофильный глобулин А
антигемофильный глобулин В, или фактор Кристмасса
фактор Стюарта-Прауэра
антигемофильный глобулин С, или плазменный предшественник протромбиназы
фактор Хагемана, или фактор контакта
фибринстабилизирующий фактор
фактор флетчера (прокалликреин)
фактор Фитцжеральда (кининоген)
П
 ояснение
к таблице: прртромбиназа, или тромбопластин
— не
имеет номера, так как является
комплексным ферментам, образованным
многими факторами.
ояснение
к таблице: прртромбиназа, или тромбопластин
— не
имеет номера, так как является
комплексным ферментам, образованным
многими факторами.
199
Свертывание проходит в четыре фазы. В первой фазе образуется протромбиназа—сложный комплекс — фермент, способствующий переходу протромбина в тромбин (вторая фаза). Третья фаза — образование фибрина из фибриногена под влиянием тромбина. Затем происходит 4-я фаза — ретракция или уплотнение сгустка.
Рис.
56. Основные этапы и фазы свертывания
крови.
Первоначально
формируется тромбоцитарная «пробка».
Первая
фаза ферментативного процесса завершается
образованием
протромбиназы.
Вторая—образованием
тромбина.
Третья
— образованием фибрина-сгустка. За
этим следует ретра-ция
сгустка.
Отсутствие какого-либо из этих факторов приводит к нарушению 1-й фазы гемокоагу-ляции, т. е. к гемофилии, в том числе гемофилии А, В и С.
200
2-я фаза заключается в переходе протромбина в активный фермент тромбин. Для этого требуется протромбиназа. Процесс идет очень быстро и, как правило, лимитирующим является лишь появление в крови протромбиназы.
3-я фаза — образование фибрина. Под влиянием тромбина и ионов кальция от фибриногена отщепляются фибринопептиды В и А, и он превращается в растворимый белок — фибрин (фибрин S). Под влиянием ХШф, или фибринстабилизирующего фактора, происходит объединение фибрина-мономера в фибрин-полимер, т. е. образование нерастворимого в воде фибрина (фибрин I). В его сгустках оседают эритроциты и другие форменные элементы, в результате чего возникает кровяной тромб, или красный тромб. Для эффективной закупорки раны под влиянием тромбостенина тромбоцитов происходит ретракция сгустка.
Если фибрин-мономер не полимеризуется, то он образует комплексы с фибриногеном, чем препятствует переходу растворимого фибрина в нерастворимый. Это лежит в основе ДВС-синдрома (диссеминированного внутрисосудистого свертывания).
ФИБРИНОЛИЗ
Фибринолиз — это ферментативное разрушение фибрина на отдельные полипептидные цепи или фрагменты X, Y, Д, Е. Совершается он при участии группы факторов, которые объединены в понятие «фибринолитическая система», или «плазминовая система».
Разрушает фибрин фермент плазмин, или фибринолизин. В крови он находится в неактивном состоянии — в виде профибринолизина, или плазминогена, в концентрации 210 мг/л. Переход в активную форму осуществляется под влиянием различных активаторов, получивших общее название — активаторы плазминогена. В эту группу входят такие факторы как тканевой активатор, находящийся в составе сосудистой стенки, кровяной активатор, тромбин, урокиназа, кислая и щелочная фосфатаза, калликреин-кининовая система совместно с фактором Хагемана, т. е. XII, XIV и XV факторы. Наиболее сильным из них является кровяной активатор. Он обычно находится в крови в неактивном состоянии и активируется под влиянием адреналина, стрептокиназы и лизокиназы.
Фибринолиз может активно тормозиться. Это происходит под влиянием таких веществ как ингибиторы фибринолизина, ингибиторы активатора.
Помимо фибринолиза может происходить растворение, или аутолиз фибрина, под влиянием ферментов эритроцитов и лейкоцитов — это так называемый асептический аутолиз, либо — растворение ферментами стафилококков и стрептококков — септический аутолиз.
Если нет условий для фибринолиза и аутолиза, то возможна организация тромба (замещение его соединительной тканью), либо образование внутри тромба канала для прохождения крови (реканализация тромба). В ряде случаев тромб, не успев подвергнуться фибрино-лизу, аутолизу, организации или реканализации, отрывается от места своего образования и вызывает закупорку сосудистого русла в другом месте (эмболия), что приводит в определенном числе случаев к смертельным исходам.
ПРОТИВОСВЕРТЫВАЮЩИЕ СИСТЕМЫ ИЛИ МЕХАНИЗМЫ
Это вещества, которые растворяют тромб, оказывая фибринолитическое действие, и вещества, препятствующие свертыванию крови, которые называются антикоагулянтами.
Антикоагулянты естественного происхождения бывают двух видов: первичные — они имеются в крови до начала свертывания (гепарин, антитромбин-Ш, антитрипсин, ингибитор С, компонента комплемента, штпромбопластины), и антикоагулянты вторичные, образующиеся в процессе свертывания крови и в период фибринолиза (антитромбин-1, или фибрин, продукты деградации фибрина).
Самый мощный антикоагулянт организма — это антитромбин III, который содержится в крови в концентрации 0,3—0,4 г/л. Он ингибирует активность всех факторов внутреннего
201
механизма образования протромбиназы. Полагают, что антитромбин-Ш необходим для активности гепарина (в его отсутствие гепарин не проявляет свой эффект). Антитромбин-Ш синтезируется эндотелием сосудов. Гепарин вырабатывается в печени, а также в базофилах и тучных клетках. В норме его концентрация в крови составляет 30—70 мг/л. Гепарин активирует антитромбин-Ш и совместно с ним обеспечивает мощный противосвертывающий эффект. Фибрин активно адсорбирует на себя и инактивирует тромбин и поэтому препятствует свертыванию крови, т. е. дальнейшему образованию фибрина из фибриногена. Вероятно, такой же механизм действия и у других производных фибриногена — фибринопептидов А и В, продуктов деградации фибрина, которые являются мощными антикоагулянтами. Это имеет определенное значение в возникновении ДВС-синдрома.
Для практических целей используются искусственные антикоагулянты, в том числе прямого действия, непосредственно нарушающие свертывание крови (например, цитрат натрия) и непрямого действия, блокирующие в печени синтез коагулянтов (например, препараты дикумарин, пелентан).
РЕГУЛЯЦИЯ ТЕКУЧЕСТИ КРОВИ
Многие специалисты утверждают, что системы свертывания и протйвосвертывания, а также системы фибрйнолиза и антифибринолиза описаны еще далеко не полно. Против каждого фактора имеется противофактор и т.д. Поэтому коагуляционный гемостаз требует дальнейшего изучения. Это тем более справедливо в отношении механизмов регуляции жидкого состояния крови. Предполагается существование местных и нейрогуморальных механизмов. Местные механизмы: фибрин и продукты деградации фибрина, фибринопеп-тиды А и В — после появления в крови они способствуют сохранению жидкого состояния крови и выступают в роли антисвертывающих факторов, с одной стороны, и в роли активатора фибрйнолиза — с другой. Нейрогуморальные механизмы связаны с активацией симпатического и парасимпатического отделов нервной системы. Симпатическая система, адреналин, норадреналин повышают свертывающую способность крови и одновременно увеличивают возможности антисвертывающей системы, т. е. увеличивают возможности системы коагуляции в двух направлениях. Парасимпатическая система (ацетилхолин), вероятно, вызывает противоложные изменения в системе коагуляции.
ОЦЕНКА ГЕМОСТАЗА
Общие методики: проба на резистенстность (ломкость) капилляров, проба щипка (при патологии появляются петехии, кровоподтеки), проба жгута (создание в течение S минут давления 60 мм рт. ст. — при патологии в локтевой ямке появляются петехии), оценка уров ня тромбоцитов в крови методами Фонио или Джавадяна, определение способности тром боцитов к агрегации и адгезии, проба Дыока, или определение спонтанной остановки кро вотечения из механического повреждения кожи, длительность кровотечения по Айви (при использовании дополнительного давления в 40 мм рт. ст.).
Оценка гемокоагуляции
Определение времени свертывания крови по методикам разных авторов.
Тромбоэластография.
Коагулография.
Определение времени рекальцификации плазмы (свертывание при добавлении к плазме хлористого кальция — норма 60—120 с).
Протромбиновое время или протромбиновый индекс (свертывание при добавле нии в цитратную кровь хлористого кальция и тканевого тромбопластина — норма времени свертывания 14—16 с, норма индекса 100 ± 5% от нормы свертывания).
Определение концентации фибриногена в плазме крови весовым методом или с использованием тест-тромбина.
202
КРОВЕЗАМЕЩАЮЩИЕ ЖИДКОСТИ
Они предназначены для различных целей. Поэтому их состав варьирует. Предложено выделять четыре основные группы кровезаменителей.
