
- •Аналитическая химия и физико-химические методы анализа
- •Часть I содержит вопросы качественного анализа катионов и анионов.
- •Синий осадок «берлинской лазури»
- •Классификация анионов
- •Анализ качественного состава раствора
- •Предварительные испытания
- •Осадок PbCrO4 легко растворяет в растворах щелочей:
- •Хроматографический качественный анализ
- •Работа № 2 Качественное определение ионов железа, меди, кобальта и никеля в молоке методом тонкослойной хроматографии
- •Работа № 3 обнаружение анионов дробным методом
- •Вопросы для самопроверки
- •Часть II. К о л и ч е с т в е н н ы й а н а л и з
- •Работа № 4 Определение содержания серной кислоты
- •Перманганатометрия
- •Перманганатометрия работа№ 5 Определение содержания железа (II) в растворе соли Мора
- •Приготовление первичного стандартного раствора щавелевой
- •Установление концентрации раствора перманганата калия
- •Определение содержания железа (II) в растворе соли Мора
- •Иодометрия
- •Иодометрия работа № 6 Определение содержания меди (II) в растворе медного купороса
- •Приготовление первичного стандартного раствора дихромата калия.
- •Установление концентрации раствора тиосульфата натрия
- •3. Определение содержания Cu(II) в растворе медного купороса
- •Осадительное титрование
- •Аргентометрия
- •Работа № 7
- •Определение содержания NaCl в в растворе
- •(Обратное титрование по Фольгарду)
- •Работа № 8 Определение жесткости воды
- •Приготовление первичного стандартного раствора MgSo4
- •Вопросы для самопроверки
- •Часть III. Физико-химические методы анализа
- •Работа 9.1. Определение рН вина, сока (активной кислотности)
- •Работа № 9.2. Потенциометрическое определение титруемой кислотности вина (сока)
- •Ионометрический метод анализа
- •Работа № 10 Определение нитратов в экстрактах пищевого сырья
- •Работа № 11 определение содержания кислоты в растворе Приборы и материалы
- •Выполнение работы
- •Техника определения
- •Вопросы для самопроверки
- •Оптические методы анализа Спектральный анализ
- •Работа № 12 Определение содержания хрома и марганца на стилоскопе
- •Выполнение работы
- •Отождествление спектральных линий с помощью дисперсионной кривой
- •Полуколичественный спектральный анализ
- •Полуколичественный спектральный анализ
- •Количественный спектральный анализ
- •Работа № 13 Определение содержания ионов натрия, калия и кальция пламенно-фотометрическим методом
- •Выполнение работы
- •Приготовление эталонных растворов
- •Фотоэлектроколориметрический метод анализа
- •Работа № 14 Фотоколориметрические определение железа в белых винах
- •Выполнение работы
- •Построение градуированной кривой
- •Анализ вина
- •Люминесцентный анализ Флуориметрический метод
- •Работа № 15 определение витамина в2 (рибофламина) в драже или таблетках флуориметрическим методом
- •Построение градуировочной кривой
- •Измерение флуоресценции на флуориметре эф – зма
- •Расчет содержания рибофлавина в таблетках
- •Рефрактометрический анализ
- •Величину n2(отн.) называют относительным коэффициентом преломления второй среды по отношению к первой. Показатель преломления по отношению к вакууму называют абсолютным показателем преломления:
- •Работа № 16 Определение сухих веществ в сахарном сиропе на рефрактометре
- •Выполнение работы
- •Построение градуировочной кривой
- •Концентрация сухих веществ с%
- •Хроматографический количественный анализ
- •Работа № 17 Анализ смеси полисахарида и нитрата кобальта методом гельхроматографии
- •Выполнение работы
- •Спектрометрический анализ полисахарида на спектрофотометре
- •Вопросы для самопроверки:
- •Литература
- •Дополнительная литература:
Работа № 9.2. Потенциометрическое определение титруемой кислотности вина (сока)
Величина титруемой кислотности вина, соков, плодов и ягод зависит от общего содержания в них свободных сильных и слабых кислот и их кислых солей. Такая кислотность определяется титрованием щелочью образца вина, сока, водной вытяжки плодов (ягод), либо с помощью индикатора (визуально), либо потенциометрически.
Потенциометрический метод позволяет титровать и устанавливать точку эквивалентности даже сильно окрашенных: объектов (вин, соков), когда применение обычных кислотно-основных индикаторов (фенолфталеина, метилоранжа к др.) невозможно. Благодаря этому потенциометрический метод получает все более широкое применение в заводских аналитических лабораториях.
При титровании щелочью кислот вина (сока) происходит как кислотно-основное взаимодействие (увеличение рН вина), так и окислительно-восстановительные реакции (восстановление вина и уменьшение его потенциала).
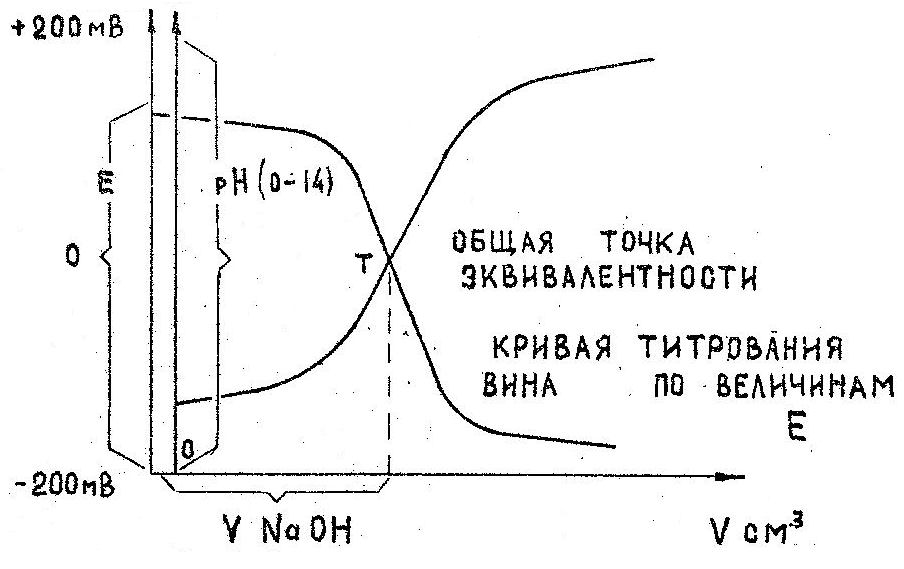
Рис. 8 Кривые титрования кислот вина (сока).
Каждую из этих реакций можно выразить графически в виде соответствующей кривой титрования – кривой изменения рН или кривой изменения потенциала Е.
Точки эквивалентности каждой из них, лежащие на серединах скачков титрования, при пересечении кривых совмещаются в одну, что и соответствует практическим результатам (см. рис.8).
Действительно, независимо от метода фиксации точки эквивалентности, ее положение относительно оси абсцисс должно быть неизменно, т.к. на нейтрализацию кислот исследуемого образца затрачивается строго определенный объем титранта (щелочи).
Измерение потенциометром либо значений Е, либо значений рН и последующее графическое построение любой из двух кривых приводит к нахождению точки эквивалентности и объема израсходованной щелочи (см. рис.8 ).
По найденному объему щелочи рассчитывают по правилу эквивалентов концентрацию кислот в объекте, а затем и общую кислотность.
Применение хингидронного электрода дает возможность измерять более широкий диапазон значений Е, что повышает точность графического определения объема титранта, а значит и общего результата.
Титруемую кислотность вин выражают либо в г/дм3 (промилле) в пересчете на винную кислоту, либо в г-экв/дм3 всех кислот вина, в том числе органических.
Значение потенциала вина в ходе его титрования порциями щелочи определяют по показаниям нижней шкалы потенциометра (милливольтметра) ЛПУ - 01.
Выполнение работы
Потенциометр включен в общую электросхему с электродами - хингидронннм (I рода) и хлорсеребряным (II рода), погруженными в образец исследуемого вина, помещенный на магнитную мешалку. На отдельном штативе закреплена бюретка с 0,1 н.раствором щелочи для титрования вина.
Приборы:
1. Потенциометр ЛЛУ-01, электроды - хлорсеребряный (сравнения), хингидронный (индикаторный).
2. Электромагнитная мешалка.
Реактивы:
0,1 н.водный раствор NаОН.
П осуда:
осуда:
I. Стакан для титрования на 150 см3
2. Мерный цилиндр на 50 см3 1 шт
3. Пипетка на 10 см3
4. Бюретка на 25 см3 или на 50 см3
Техника определения
В стакан для титрования отмеряют пипеткой 10 см3 вина (сока), 50 см3 дистиллированной воды и раствор нагревают до кипения для удаления углекислоты во избежание повышенного расхода щелочи на титрование.
Охладив раствор, опускают в стакан мешалку для перемешивания, добавляют туда на кончике ножа хингидрон, опускают электроды и ставят стакан на магнитную мешалку; включают последнюю и приступают к титрованию вина (сока) 0,1 н раствором NаОН, приливая его из бюретки по 0,5 см3. После каждого прибавления порции щелочи для выравнивания концентрации раствор перемешивают в течение 0,5 мин., после чего снимают показания прибора в мВ. После резкого скачка потенциала добавляют еще несколько порций раствора NаОН по I см3 и ведут титрование до показания прибора 200 мВ.
Результаты титрования вносят в таблицу 1.
Таблица 1
Д анные
для построения кривой титрования в
координатах Е-V
анные
для построения кривой титрования в
координатах Е-V
V – объем щелочи (см3)
– объем щелочи (см3)
Е – показания прибора (мВ)
– показания прибора (мВ)
По полученным данным строят кривую титрования (рис.7.) в следующих координатах: на оси ординат откладывается разность потенциалов в мВ, а на оси абсцисс число см3 раствора NаОН (его получают путем суммирования отдельных порций по 0,2 см3). Примерный вид кривой потенциометрического титрования приведен на рис.7.
Количество см3 щелочи, пошедшее на титрование, определяется графически.
Для этого к кривой титрования в точках перегиба А и Б строят касательные, параллельные друг другу. Восстанавливают между ними перпендикуляр ВБ находят его середину (точка Е) и проводят через нее прямую, параллельную двум касательным, до пересечения с кривой-титрования в точке D. Из точки D опускают перпендикуляр DМ на ось абсцисс. Отрезок прямой СМ равен количеству см3 щелочи, пошедшей на титрование.
Расчет
Так как I см3 0,1н раствора щелочи соответствует 0,0075 г винной кислоты, то титруемая кислотность рассчитывается по формуле:
А = 0,75× а × в,
где А - содержание винной кислоты, г/дм3 ;
а - количество см3 0,1 н раствора щелочи, пошедшее на титрование
10 см3 вина (по графику);
в - поправочный коэффициент к величине нормальности щелочи (в случае точно 0,1 н раствора в = 1).
При выражении результатов определения в г-экв/дм3 кислотность вычисляется по формуле:
В = 0,0001 × а × в × 100 = 0,01× а × в.
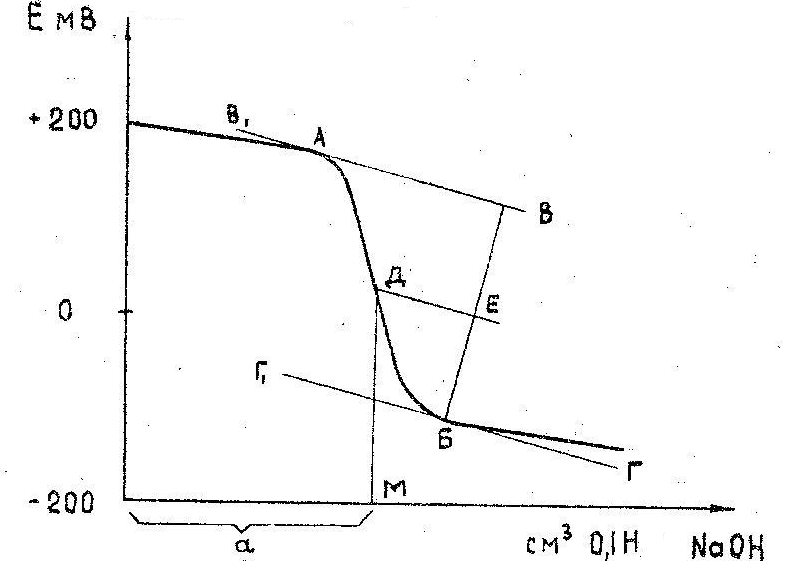
Рис.7 Кривая потенциометрического титрования кислот вина (сока).
где ВВ1 и ГГ1 – касательные к точкам перегиба кривой.
Подготовка прибора
Включают прибор в электросеть, переключатель «Виды работ» устанавливают в положение 200÷ +1400 МВ и после 30 мин прогревания приступают к титрованию вина.
