
- •Аналитическая химия и физико-химические методы анализа
- •Часть I содержит вопросы качественного анализа катионов и анионов.
- •Синий осадок «берлинской лазури»
- •Классификация анионов
- •Анализ качественного состава раствора
- •Предварительные испытания
- •Осадок PbCrO4 легко растворяет в растворах щелочей:
- •Хроматографический качественный анализ
- •Работа № 2 Качественное определение ионов железа, меди, кобальта и никеля в молоке методом тонкослойной хроматографии
- •Работа № 3 обнаружение анионов дробным методом
- •Вопросы для самопроверки
- •Часть II. К о л и ч е с т в е н н ы й а н а л и з
- •Работа № 4 Определение содержания серной кислоты
- •Перманганатометрия
- •Перманганатометрия работа№ 5 Определение содержания железа (II) в растворе соли Мора
- •Приготовление первичного стандартного раствора щавелевой
- •Установление концентрации раствора перманганата калия
- •Определение содержания железа (II) в растворе соли Мора
- •Иодометрия
- •Иодометрия работа № 6 Определение содержания меди (II) в растворе медного купороса
- •Приготовление первичного стандартного раствора дихромата калия.
- •Установление концентрации раствора тиосульфата натрия
- •3. Определение содержания Cu(II) в растворе медного купороса
- •Осадительное титрование
- •Аргентометрия
- •Работа № 7
- •Определение содержания NaCl в в растворе
- •(Обратное титрование по Фольгарду)
- •Работа № 8 Определение жесткости воды
- •Приготовление первичного стандартного раствора MgSo4
- •Вопросы для самопроверки
- •Часть III. Физико-химические методы анализа
- •Работа 9.1. Определение рН вина, сока (активной кислотности)
- •Работа № 9.2. Потенциометрическое определение титруемой кислотности вина (сока)
- •Ионометрический метод анализа
- •Работа № 10 Определение нитратов в экстрактах пищевого сырья
- •Работа № 11 определение содержания кислоты в растворе Приборы и материалы
- •Выполнение работы
- •Техника определения
- •Вопросы для самопроверки
- •Оптические методы анализа Спектральный анализ
- •Работа № 12 Определение содержания хрома и марганца на стилоскопе
- •Выполнение работы
- •Отождествление спектральных линий с помощью дисперсионной кривой
- •Полуколичественный спектральный анализ
- •Полуколичественный спектральный анализ
- •Количественный спектральный анализ
- •Работа № 13 Определение содержания ионов натрия, калия и кальция пламенно-фотометрическим методом
- •Выполнение работы
- •Приготовление эталонных растворов
- •Фотоэлектроколориметрический метод анализа
- •Работа № 14 Фотоколориметрические определение железа в белых винах
- •Выполнение работы
- •Построение градуированной кривой
- •Анализ вина
- •Люминесцентный анализ Флуориметрический метод
- •Работа № 15 определение витамина в2 (рибофламина) в драже или таблетках флуориметрическим методом
- •Построение градуировочной кривой
- •Измерение флуоресценции на флуориметре эф – зма
- •Расчет содержания рибофлавина в таблетках
- •Рефрактометрический анализ
- •Величину n2(отн.) называют относительным коэффициентом преломления второй среды по отношению к первой. Показатель преломления по отношению к вакууму называют абсолютным показателем преломления:
- •Работа № 16 Определение сухих веществ в сахарном сиропе на рефрактометре
- •Выполнение работы
- •Построение градуировочной кривой
- •Концентрация сухих веществ с%
- •Хроматографический количественный анализ
- •Работа № 17 Анализ смеси полисахарида и нитрата кобальта методом гельхроматографии
- •Выполнение работы
- •Спектрометрический анализ полисахарида на спектрофотометре
- •Вопросы для самопроверки:
- •Литература
- •Дополнительная литература:
Установление концентрации раствора перманганата калия
Конценрацию раствора КМnО4 - устанавливают по первичному стандартному 0,02 н раствору щавелевой кислоты (или оксалата натрия). Раствор КМnО4 наливают в бюретку и устанавливают уровень жидкости на нуле по верхнему мениску (окрашенный раствор). В три конические колбы переносят пипеткой по 10 мл стандартного раствора щавелевой кислоты и добавляют мензуркой по 10 мл 4 н Н2SО4. Последовательно каждую из колб нагревают до 80-90º С и раствор медленно при непрерывном помешивании титруют раствором перманганата калия до появления бледно-розового окрашивания.
При титровании идет следующая реакция:
5H2C2O4 + 2KMnO4 + 3H2SO4 → 2MnSO4 + 10CO2 + 8H2O
5C2O42- + 2MnO4- + 16H+ → 2Mn2+ + 10CO2 + 8H2O
Практически эта реакция идет в несколько стадий. Нагревание и повышение концентрации ионов водорода способствует увеличению скорости взаимодействия перманганата с щавелевой кислотой. Ионы марганца (II) оказывает каталитическое действие на реакцию (автокатализ).
Во время титрования раствор перемешивают и каждую следующую каплю добавляют только после исчезновения окраски от предыдущей капли. Титрование проводят не менее 3-х раз до получения сходящихся результатов. Находят среднее значение, по которому рассчитывают точную концентрацию титранта (вторичного стандартного раствора) по формуле:
nщ.к.
= n![]()
Nщ.к. ·Vщ.к. = N · V
N
=
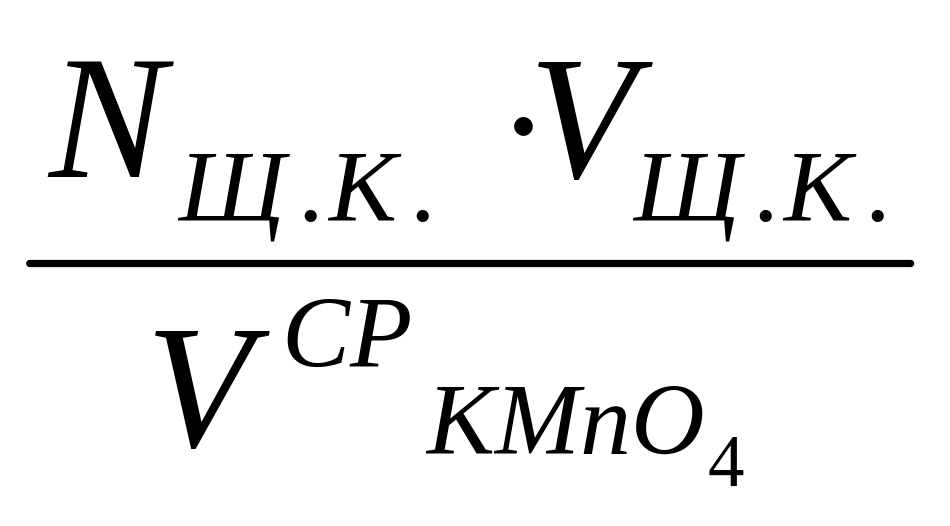 ;
;
Т
=![]() г/мл.
г/мл.
ЭМ =
Определение содержания железа (II) в растворе соли Мора
Полученный в мерной колбе на 100 мл анализируемый раствор соли Мора FeSO4(NH4)2SO4 · 6H2O (задача) разбавляют дистиллированной водой до метки и тщательно перемешивают. В три конические колбы отбирают пипеткой по 10 мл анализируемого раствора и добавляют мензуркой по 10 мл 4 н H2SO4. Полученную смесь перемешивают и титруют раствором перманганата калия до бледно-розового окрашивания. Для вычисления берут среднее значение объема титранта, пошедшего на титрование.
Реакция идет по следующему уравнению:
10FeSO4 + 2KMnO4 + 8H2SO4 → 2MnSO4 +5Fe2(SO4)3 + K2SO4 + 8H2O
5 Fe2+ – 1e → Fe3+
1 MnO-4 + 8H+ + 5e → Mn2+ + 4H2O

MnO-4 + 5Fe2+ + 8H+ → Mn2+ + 5Fe3+ + 4H2O
Отсюда следует, что грамм – эквивалент соли Мора равен ее молекулярной массе.
По результатам титрования рассчитывают концентрацию анализируемого раствора и количество железа (II) в выданном растворе (100 мл) по следующим формулам:
nсоли Мора = n
Nсоли Мора . Vсоли Мора = N . V
QFe(II) = Nсоли Мора . Vк . ЭМFe , (мг)
где QFe(II) – содержание определяемого вещества, мг;
ЭМ – грамм – эквивалент железа
Vк– объем мерной колбы, мл.
Иодометрия
Основная реакция: J2 + 2e ↔ 2J-
Первичный стандартный раствор исходного вещества |
K2Cr2O7 – дихромат калия; 0,02 н. раствор Cr2O72- + 6e + 14H+ → 2Cr3+ + 7H2O E° ЭМ
=
|
Вторичные стандартные растворы |
2S2O2-3
– 2e → S4O62-;
E° ЭМ
=
Е°
|
|
KJ – иодид калия; 0,1 М раствор KJ – вспомогательный раствор |
Фиксирование точки эквивалент-ности (ТЭ) |
Специфический индикатор – крахмал, 5%-ный раствор Образует с иодом сине – черное окрашивание |
Определяемые вещества |
1.) Окислители. Определяют методом замещения n K2Cr2O7 + 6KJ+ 7H2SO4 → Cr2(SO4)3 + 3J2 + 4K2SO4 + 7H2O J2 + 2Na2S2O3 → 2NaJ + Na2S4O6
Na2SO3 + J2 + H2O → 2HJ + Na2SO4 избыток J2 + 2Na2S2O3 → 2NaJ + Na2S4O6 |
