
- •Аналитическая химия и физико-химические методы анализа
- •Часть I содержит вопросы качественного анализа катионов и анионов.
- •Синий осадок «берлинской лазури»
- •Классификация анионов
- •Анализ качественного состава раствора
- •Предварительные испытания
- •Осадок PbCrO4 легко растворяет в растворах щелочей:
- •Хроматографический качественный анализ
- •Работа № 2 Качественное определение ионов железа, меди, кобальта и никеля в молоке методом тонкослойной хроматографии
- •Работа № 3 обнаружение анионов дробным методом
- •Вопросы для самопроверки
- •Часть II. К о л и ч е с т в е н н ы й а н а л и з
- •Работа № 4 Определение содержания серной кислоты
- •Перманганатометрия
- •Перманганатометрия работа№ 5 Определение содержания железа (II) в растворе соли Мора
- •Приготовление первичного стандартного раствора щавелевой
- •Установление концентрации раствора перманганата калия
- •Определение содержания железа (II) в растворе соли Мора
- •Иодометрия
- •Иодометрия работа № 6 Определение содержания меди (II) в растворе медного купороса
- •Приготовление первичного стандартного раствора дихромата калия.
- •Установление концентрации раствора тиосульфата натрия
- •3. Определение содержания Cu(II) в растворе медного купороса
- •Осадительное титрование
- •Аргентометрия
- •Работа № 7
- •Определение содержания NaCl в в растворе
- •(Обратное титрование по Фольгарду)
- •Работа № 8 Определение жесткости воды
- •Приготовление первичного стандартного раствора MgSo4
- •Вопросы для самопроверки
- •Часть III. Физико-химические методы анализа
- •Работа 9.1. Определение рН вина, сока (активной кислотности)
- •Работа № 9.2. Потенциометрическое определение титруемой кислотности вина (сока)
- •Ионометрический метод анализа
- •Работа № 10 Определение нитратов в экстрактах пищевого сырья
- •Работа № 11 определение содержания кислоты в растворе Приборы и материалы
- •Выполнение работы
- •Техника определения
- •Вопросы для самопроверки
- •Оптические методы анализа Спектральный анализ
- •Работа № 12 Определение содержания хрома и марганца на стилоскопе
- •Выполнение работы
- •Отождествление спектральных линий с помощью дисперсионной кривой
- •Полуколичественный спектральный анализ
- •Полуколичественный спектральный анализ
- •Количественный спектральный анализ
- •Работа № 13 Определение содержания ионов натрия, калия и кальция пламенно-фотометрическим методом
- •Выполнение работы
- •Приготовление эталонных растворов
- •Фотоэлектроколориметрический метод анализа
- •Работа № 14 Фотоколориметрические определение железа в белых винах
- •Выполнение работы
- •Построение градуированной кривой
- •Анализ вина
- •Люминесцентный анализ Флуориметрический метод
- •Работа № 15 определение витамина в2 (рибофламина) в драже или таблетках флуориметрическим методом
- •Построение градуировочной кривой
- •Измерение флуоресценции на флуориметре эф – зма
- •Расчет содержания рибофлавина в таблетках
- •Рефрактометрический анализ
- •Величину n2(отн.) называют относительным коэффициентом преломления второй среды по отношению к первой. Показатель преломления по отношению к вакууму называют абсолютным показателем преломления:
- •Работа № 16 Определение сухих веществ в сахарном сиропе на рефрактометре
- •Выполнение работы
- •Построение градуировочной кривой
- •Концентрация сухих веществ с%
- •Хроматографический количественный анализ
- •Работа № 17 Анализ смеси полисахарида и нитрата кобальта методом гельхроматографии
- •Выполнение работы
- •Спектрометрический анализ полисахарида на спектрофотометре
- •Вопросы для самопроверки:
- •Литература
- •Дополнительная литература:
Работа 9.1. Определение рН вина, сока (активной кислотности)
Определение кислотности вин и соков потенциометрическим методом имеет важное значение для пищевой технологии.
По величинам общей (титруемой) и активной кислотности на всех этапах производства можно судить о качестве сырья и продукции, режиме ее хранения.
Все кислоты в водных растворах распадаются (диссоциируют) на ионы водорода и кислотного остатка. Так сильные кислоты (Н2SO4, HCl) диссоциируют почти полностью с высокой степенью диссоциации, а слабые (винная, лимонная, яблочная, уксусная и др.) в очень малой степени, чаще выражаемой константой диссоциации.
Для сильных кислот в водных растворах диссоциация практически необратима:
H Cl
H+
+ Cl-
Cl
H+
+ Cl-
или
Н 2О + Н+ Н3О+
α (степень диссоциации) = число распавшихся молекул ×100
о бщее
число молекул (в %)
бщее
число молекул (в %)
Для слабых кислот диссоциация обратима (равновесие):
С
 Н3СООН
Н+
+ СН3СОО
–
Н3СООН
Н+
+ СН3СОО
–
К СН3СООН
= [Н+]
× [СН3СОО
–]
СН3СООН
= [Н+]
× [СН3СОО
–]
[СН3СООН] = 1,7 × 10-5
В отличие от общей титруемой кислотности, обусловливаемой совместным присутствием сильных и слабых кислот в вине, соке, активная кислотность выражается концентрацией лишь сильных диссоциированных кислот и определяется непосредственно как рН объекта.
В свою очередь, рН раствора отражает не всю номинальную концентрацию растворенных сильных кислот "Сн+", а лишь концентрацию их подвижных ионов "Н+" "α Н", называют активной.
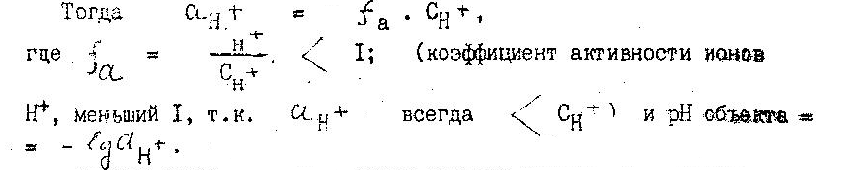
Поэтому активная концентрация сильных кислот, выражаемая рН, оказывает влияние на степень кислотности ("силу кислотного вкуса") вина и соков гораздо больше, чем даже высокое содержание слабых кислот.
Из слабых кислот (лимонная, яблочная и др.) наибольшей кислотностью обладает винная кислота.
рН вина, выражающий его активную кислотность, определяют по показаниям потенциометра (рН-метра), иономера.
Потенциометр включен в общую схему с электродами стеклянным (I рода) и хлорсеребрянным (II рода), погружаемыми в образец исследуемого вина.
Выполнение работы
Приборы: Потенциометр (рН-метр), иономер, электроды - хлорсеребряный (сравнения) и стеклянный (индикаторный).
Посуда: I. Стаканчик на 50 см3 .
II. Мерный цилиндр на 50 см3.
Реактивы: буферный раствор, рН = 4,01.
Подготовка прибора
Включают рН-метр тумблером в электросеть и после 30 мин прогревания настраивают шкалу рН (верхняя шкала прибора) по буферному раствору с рН около 4 (для кислотного диапазона).
Техника определения
Электроды промывают дистиллированной водой, следы ее удаляют фильтровальной бумагой и погружают электроды в стакан на 50 см3 со стандартным буферным раствором; переключатель "Виды работ" устанавливают в положение "рН", переключатель пределов измерения устанавливают на диапазон рН 2-6.
Рукояткой "Настройка по буферному раствору" устанавливают стрелку шкалы на значение рН стандартного буферного раствора, (например, рН = 4,01) и проверяют устойчивость показаний в диапазоне 2÷14 рН.
Затем выливают буферный раствор, промывают электроды и стакан дистиллированной водой, ополаскивают их образцом исследуемого вина, .наливают 25 см3 вина в стакан и погружают электроды. Вначале устанавливают переключателем пределов измерения широкий диапазон измерения рН 2-14, приблизительно оценивают значение рН по показаниям стрелки и после установки переключателем узкого диапазона рН 2-6 фиксируют точное значение рН.
