
- •Аналитическая химия и физико-химические методы анализа
- •Часть I содержит вопросы качественного анализа катионов и анионов.
- •Синий осадок «берлинской лазури»
- •Классификация анионов
- •Анализ качественного состава раствора
- •Предварительные испытания
- •Осадок PbCrO4 легко растворяет в растворах щелочей:
- •Хроматографический качественный анализ
- •Работа № 2 Качественное определение ионов железа, меди, кобальта и никеля в молоке методом тонкослойной хроматографии
- •Работа № 3 обнаружение анионов дробным методом
- •Вопросы для самопроверки
- •Часть II. К о л и ч е с т в е н н ы й а н а л и з
- •Работа № 4 Определение содержания серной кислоты
- •Перманганатометрия
- •Перманганатометрия работа№ 5 Определение содержания железа (II) в растворе соли Мора
- •Приготовление первичного стандартного раствора щавелевой
- •Установление концентрации раствора перманганата калия
- •Определение содержания железа (II) в растворе соли Мора
- •Иодометрия
- •Иодометрия работа № 6 Определение содержания меди (II) в растворе медного купороса
- •Приготовление первичного стандартного раствора дихромата калия.
- •Установление концентрации раствора тиосульфата натрия
- •3. Определение содержания Cu(II) в растворе медного купороса
- •Осадительное титрование
- •Аргентометрия
- •Работа № 7
- •Определение содержания NaCl в в растворе
- •(Обратное титрование по Фольгарду)
- •Работа № 8 Определение жесткости воды
- •Приготовление первичного стандартного раствора MgSo4
- •Вопросы для самопроверки
- •Часть III. Физико-химические методы анализа
- •Работа 9.1. Определение рН вина, сока (активной кислотности)
- •Работа № 9.2. Потенциометрическое определение титруемой кислотности вина (сока)
- •Ионометрический метод анализа
- •Работа № 10 Определение нитратов в экстрактах пищевого сырья
- •Работа № 11 определение содержания кислоты в растворе Приборы и материалы
- •Выполнение работы
- •Техника определения
- •Вопросы для самопроверки
- •Оптические методы анализа Спектральный анализ
- •Работа № 12 Определение содержания хрома и марганца на стилоскопе
- •Выполнение работы
- •Отождествление спектральных линий с помощью дисперсионной кривой
- •Полуколичественный спектральный анализ
- •Полуколичественный спектральный анализ
- •Количественный спектральный анализ
- •Работа № 13 Определение содержания ионов натрия, калия и кальция пламенно-фотометрическим методом
- •Выполнение работы
- •Приготовление эталонных растворов
- •Фотоэлектроколориметрический метод анализа
- •Работа № 14 Фотоколориметрические определение железа в белых винах
- •Выполнение работы
- •Построение градуированной кривой
- •Анализ вина
- •Люминесцентный анализ Флуориметрический метод
- •Работа № 15 определение витамина в2 (рибофламина) в драже или таблетках флуориметрическим методом
- •Построение градуировочной кривой
- •Измерение флуоресценции на флуориметре эф – зма
- •Расчет содержания рибофлавина в таблетках
- •Рефрактометрический анализ
- •Величину n2(отн.) называют относительным коэффициентом преломления второй среды по отношению к первой. Показатель преломления по отношению к вакууму называют абсолютным показателем преломления:
- •Работа № 16 Определение сухих веществ в сахарном сиропе на рефрактометре
- •Выполнение работы
- •Построение градуировочной кривой
- •Концентрация сухих веществ с%
- •Хроматографический количественный анализ
- •Работа № 17 Анализ смеси полисахарида и нитрата кобальта методом гельхроматографии
- •Выполнение работы
- •Спектрометрический анализ полисахарида на спектрофотометре
- •Вопросы для самопроверки:
- •Литература
- •Дополнительная литература:
Иодометрия работа № 6 Определение содержания меди (II) в растворе медного купороса
Реагенты
Дихромат калия K2Cr2O7; 0,02 н раствор (первичный стандартный раствор)
Тиосульфат натрия Na2S2O3.5H2O; 0,02 н раствор (вторичный стандарт- ный раствор, титрант).
Иодид калия KJ; 0,1 М раствор (вспомогательный раствор)
Серная кислота H2SO4; 1 М раствор
Индикатор - 5%-ный раствор крахмала.
Приготовление первичного стандартного раствора дихромата калия.
Стандартный раствор готовят из химически чистого перекристаллизированного K2Cr2O7. Грамм – эквивалент дихромата калия рассчитывают, исходя из реакции взаимодействия с иодидом калия, протекающей по следующему ионно – электронному уравнению:
1 Cr2O2-7 + 6e + 14H+ → 2Cr3+ + 7H2O
3 2J- – 2e → J2
Cr2O2-7 + 6J- + 14H+ → 2Cr3+ +3J2 + 7H2O
Следовательно, грамм – эквивалент K2Cr2O7 равен:
ЭМ![]()
Для приготовления 250 мл 0,02 н. раствора K2Cr2O7 следует взять навеску:
атеор.
=
![]()
Рассчитанное количество дихромата калия взвешивают в бюксе сначала на технических весах, а затем точно на аналитических весах, количественно переносят в мерную колбу, растворяют в холодной дистиллированной воде, добавляют воды до метки и тщательно перемешивают. Пустой бюкс взвешивают на аналитических весах; навеска апракт. определяется по разности взвешиваний.
Нормальность приготовленного первичного стандартного раствора дихромата калия вычисляется по формуле:
N
=
![]()
Установление концентрации раствора тиосульфата натрия
Концентрацию раствора тиосульфата натрия Na2S2O3.5H2O устанавливают по первичному стандартному 0,02 н раствору дихромата калия, пользуясь методом замещения. Раствор тиосульфата натрия наливают в бюретку, устанавливают уровень жидкости на нуле по нижнему мениску.
В коническую колбу пипеткой переносят 10 мл раствора K2Cr2O7, прибавляют 10-15 мл 0,1 раствора иодида калия и 10 мл 1 М серной кислоты; смесь хорошо перемешивают. Колбу закрывают часовым стеклом, дают постоять в темноте около 4-5 минут и выделившийся иод титруют раствором тиосульфата. Когда бурая окраска выделившегося иода перейдет в соломенно-желтую, прибавляют 10 капель свежеприготовленного крахмала и продолжают титровать тиосульфатом натрия до перехода синей окраски в светло-зеленую. Титрование считается законченным, если синее окрашивание после окончания титрования не возвращается в течение 1 минуты. Титрование повторяют не менее 3-х раз. Результаты параллельных проб не должны отличаться друг от друга более чем на 0,1 мл. Вычисляют среднее значение объема титранта.
K2Cr2O7 + 6KJ + 7H2SO4 → Cr2(SO4)3 + 3J2 + 4K2SO4 + 7H2O
Cr2O2-7 + 6J- + 14H+ → 2Cr3+ + 3J2 + 7H2O
1 Cr2O2-7 + 14H+ + 6е → 2Cr3+ + 3J2 + 7H2O
3 2J- – 2e → J2

2S2O32- - 2e →S4O62-
J2 +2e→2J-

J2+2S2O32-→2J-+S4O62-
J2 +2Na2S2O3→2NaJ+Na2S4O6
Из реакции (2) следует, что грамм-эквивалент тиосульфата натрия равен его молекулярной массе, т.е. 248,2.
При расчете концентрации титранта следует помнить, что взятое число мг-эквивалентов дихромата калия после реакции с иодидом калия выделяет равное количества мг-эквивалентов тиосульфата натрия, т.е.
![]()
N
.
V
=
N
.
V
=
N![]() .
V
.
V
Исходя из этого соотношения, нормальность тиосульфата натрия вычисляют по формуле:
N
=
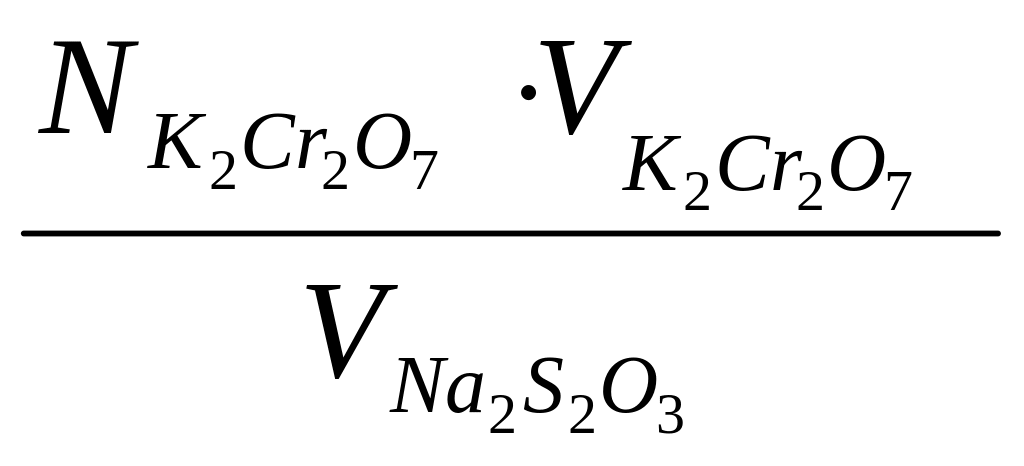
T
=
![]()
ЭМтиосульфата = Мол.масса Na2S2O3 · 5H2О = 248,2
