
- •Аналитическая химия и физико-химические методы анализа
- •Часть I содержит вопросы качественного анализа катионов и анионов.
- •Синий осадок «берлинской лазури»
- •Классификация анионов
- •Анализ качественного состава раствора
- •Предварительные испытания
- •Осадок PbCrO4 легко растворяет в растворах щелочей:
- •Хроматографический качественный анализ
- •Работа № 2 Качественное определение ионов железа, меди, кобальта и никеля в молоке методом тонкослойной хроматографии
- •Работа № 3 обнаружение анионов дробным методом
- •Вопросы для самопроверки
- •Часть II. К о л и ч е с т в е н н ы й а н а л и з
- •Работа № 4 Определение содержания серной кислоты
- •Перманганатометрия
- •Перманганатометрия работа№ 5 Определение содержания железа (II) в растворе соли Мора
- •Приготовление первичного стандартного раствора щавелевой
- •Установление концентрации раствора перманганата калия
- •Определение содержания железа (II) в растворе соли Мора
- •Иодометрия
- •Иодометрия работа № 6 Определение содержания меди (II) в растворе медного купороса
- •Приготовление первичного стандартного раствора дихромата калия.
- •Установление концентрации раствора тиосульфата натрия
- •3. Определение содержания Cu(II) в растворе медного купороса
- •Осадительное титрование
- •Аргентометрия
- •Работа № 7
- •Определение содержания NaCl в в растворе
- •(Обратное титрование по Фольгарду)
- •Работа № 8 Определение жесткости воды
- •Приготовление первичного стандартного раствора MgSo4
- •Вопросы для самопроверки
- •Часть III. Физико-химические методы анализа
- •Работа 9.1. Определение рН вина, сока (активной кислотности)
- •Работа № 9.2. Потенциометрическое определение титруемой кислотности вина (сока)
- •Ионометрический метод анализа
- •Работа № 10 Определение нитратов в экстрактах пищевого сырья
- •Работа № 11 определение содержания кислоты в растворе Приборы и материалы
- •Выполнение работы
- •Техника определения
- •Вопросы для самопроверки
- •Оптические методы анализа Спектральный анализ
- •Работа № 12 Определение содержания хрома и марганца на стилоскопе
- •Выполнение работы
- •Отождествление спектральных линий с помощью дисперсионной кривой
- •Полуколичественный спектральный анализ
- •Полуколичественный спектральный анализ
- •Количественный спектральный анализ
- •Работа № 13 Определение содержания ионов натрия, калия и кальция пламенно-фотометрическим методом
- •Выполнение работы
- •Приготовление эталонных растворов
- •Фотоэлектроколориметрический метод анализа
- •Работа № 14 Фотоколориметрические определение железа в белых винах
- •Выполнение работы
- •Построение градуированной кривой
- •Анализ вина
- •Люминесцентный анализ Флуориметрический метод
- •Работа № 15 определение витамина в2 (рибофламина) в драже или таблетках флуориметрическим методом
- •Построение градуировочной кривой
- •Измерение флуоресценции на флуориметре эф – зма
- •Расчет содержания рибофлавина в таблетках
- •Рефрактометрический анализ
- •Величину n2(отн.) называют относительным коэффициентом преломления второй среды по отношению к первой. Показатель преломления по отношению к вакууму называют абсолютным показателем преломления:
- •Работа № 16 Определение сухих веществ в сахарном сиропе на рефрактометре
- •Выполнение работы
- •Построение градуировочной кривой
- •Концентрация сухих веществ с%
- •Хроматографический количественный анализ
- •Работа № 17 Анализ смеси полисахарида и нитрата кобальта методом гельхроматографии
- •Выполнение работы
- •Спектрометрический анализ полисахарида на спектрофотометре
- •Вопросы для самопроверки:
- •Литература
- •Дополнительная литература:
Работа № 8 Определение жесткости воды
Реагенты
Сульфат магния MgSO4; 0,01 н раствор (первичный стандартный раствор)
Комплексон III; 0,05 н раствор (титрант).
Аммонийная буферная смесь.
Индикатор – кислотный хром темно-кислый
Приготовление первичного стандартного раствора MgSo4
Стандартный раствор 0,01 н MgSO4 готовят по фиксаналу. Для этого содержимое ампулы количественного через воронку смывают дистиллированной водой из промывалки в мерную колбу емкостью 1000 мл, доводят раствор до метки и тщательно перемешивают.
Установление концентрации раствора комплексона III
Концентрацию комплексона III устанавливают по первичному стандартному раствору сульфата магния.
Раствор комплексона III (титранта) наливают в бюретку и устанавливают уровень жидкости на нуле. В коническую колбу емкостью 250 мл пипеткой отмеривают 20 мл стандартного раствора MgSO4, добавляют 20 мл дистиллированной воды, 5 мл аммонийной буферной смеси и 5 капель индикатора. Раствор перемешивают и медленно титруют раствором титранта до перехода розовой окраски в синюю. Титрование повторяют 2-3 раза. Находят среднее значение, по которому рассчитывают точную концентрацию титранта по формуле:
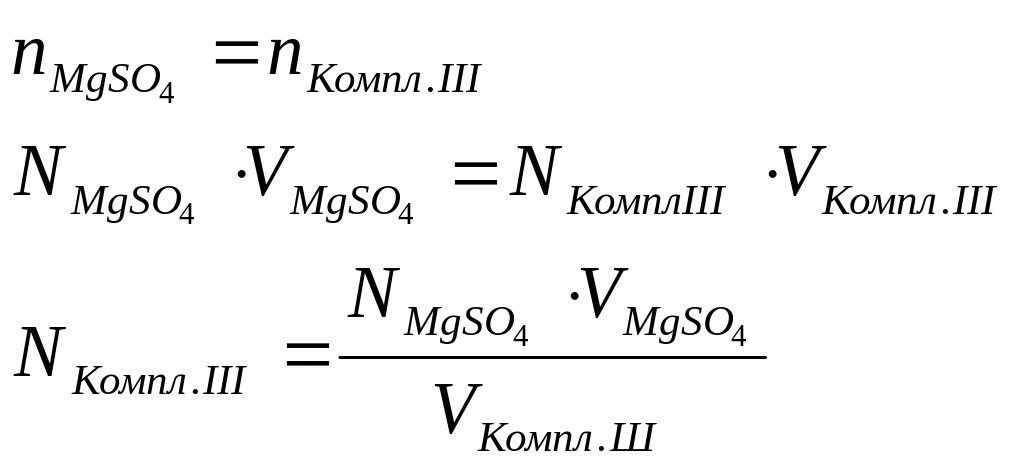
Определение жесткости воды
Полученный для анализа раствор жесткой воды в мерной колбе емкостью 100 мл разбавляют дистиллированной водой до метки и тщательно перемешивают. В коническую колбу емкостью 250 мл пипеткой отмеривают 20 мл жесткой воды, добавляют 20 мл дистиллированной воды, 5 мл аммонийного буферного раствора, 5 капель индикатора и титруют раствором комплексона III до перехода розовой окраски в синюю.
При титровании идет следующая реакция:
Na2H2V + Ca2+ = Na2CaV +2H+
По результатам титрования вычисляют жесткость воды по формуле:
Жесткость
=
![]() , мг – экв/л
, мг – экв/л
Вопросы для самопроверки
На чем основана классификация титриметрических методов анализа? Привести примеры.
Первичные и вторичные стандартные растворы.
Что означает титр раствора по определяемому веществу и как он связан с нормальной концентрацией титранта?
Что лежит в основе расчетов результатов титриметрического анализа?
На титрование 20,00 мл раствора содержащего сульфат железа (II) затрачено 18,54 мл 0,02 н раствора перманганата калия. Вычислить нормальность раствора сульфата железа (II) и титр перманганата калия по железу.
Как рассчитать эквивалентные массы окислителя и восстановителя в редоксиметрии?
Часть III. Физико-химические методы анализа
Электрохимические методы анализа
Потенциометрия
РАБОТА № 9
Определение окислительно-восстановительного потенциала
вина.
Окислительно- восстановительный потенциал системы, измеряемый как разность потенциалов электродов I и II рода, погруженных в исследуемый раствор, фиксируют по показаниям включенного в схему потенциометра ЛПУ -01.
Выполнение работы.
Приборы: потенциометр ( рН-метр), иономер - лабораторный прибор с переключателем "Виды работ" для определения окислительно-восстановительного потенциала по нижней шкале, градуированной в милливольтах (МВ),либо для определения рН по верхней шкале электроды - платиновый (индикаторный) и каломельный (сравнения).
Посуда: I. Специальный стакан с верхним и нижним краном (сифон с краном) - I шт.
II. Термометр - I шт.
Техника определения
Собирают установку для определения 0В - потенциала вина.
Включают прибор в сеть тумблером, переключатель "Виды работ" устанавливают в положение - 200м т ÷ +1400 мВ и после 30 минут прогрева приступают к определению ОВ-потенциала.
Расчет .
0В - потенциал (Eh) определяется по формуле;
Eh = E + 0, 2503 вольт или
Eh = E + 250, 3 милливольт (МВ),
где Е - измеренная разность потенциалов;
250,3 - потенциал насыщенного каломельного электрода па отношению к стандартному водородному электроду, выраженный в мВ.
В случае, если измерение э.д.с. производится не при 18°С, то в значение Еh вносится температурная поправка - 0,0007. (t - 18°С) и Еh определяется по формуле:
Eh = E + 250, 3 – 0,0007 (t -18°С)
Примечание.
Перед каждый погружением в контролируемый раствор электроды необходимо тщательно промыть дистиллированной водой, удалить с них избыток воды фильтровальной бумагой и сполоснуть исследуемым раствором.
После окончания работы электроды необходимо тщательно промыть и опустить в стаканчик с дистиллированной водой.
