
- •Химическая технология неорганических веществ. Основные производства
- •Химическая технология неорганических веществ. Основные производства
- •Предисловие
- •Лекции №1-2 получение синтетического аммиака
- •1. Общие сведения.
- •1.1.Свойства аммиака.
- •1.2. Значение и применение аммиака.
- •2.Физико-химические основы синтеза аммиака.
- •3. Технологическая схема синтеза аммиака при среднем давлении.
- •4. Основные направления развития производства аммиака.
- •Лекции №3-4 химия и технология азотной кислоты.
- •1.Общие сведения.
- •1.1.Физические свойства Диаграммы состояния.
- •1.2. Химические свойства.
- •1.4. Применение азотной кислоты.
- •1.5. Способы получения азотной кислоты.
- •2. Получение неконцентрированной азотной кислоты из аммиака (химические уравнения и стадии).
- •3. Физико-химические основы процесса окисления аммиака.
- •3.1. Химические уравнения процесса окисления аммиака и их анализ.
- •3.2. Выбор оптимальных условий процесса окисления аммиака.
- •3.2.1. Катализаторы процесса окисления аммиака.
- •3.2.2. Скорость окисления аммиака.
- •3.2.3. Определение оптимальной температуры.
- •3.2.4. Определение оптимального давления процесса.
- •3.2.5. Состав газовой смеси.
- •4. Физико-химические основы процесса окисления нитрозных газов (no в no2).
- •5. Физико-химические основы процесса поглощения оксидов азота водой.
- •6. Очистка отходящих газов.
- •Лекция № 5 Получение неконцентрированной азотной кислоты в промышленности.
- •1. Основные операции и принципиальная схема.
- •2. Технологические схемы производства неконцентрированной азотной кислоты.
- •3. Принципиальная технологическая схема получения неконцентрированной азотной кислоты под повышенным давлением
- •Лекция № 6 Получение концентрированной азотной кислоты.
- •1. Общая характеристика методов получения концентрированной азотной кислоты.
- •2. Получение концентрированной азотной кислоты из разбавленных растворов.
- •3. Прямой синтез концентрированной азотной кислоты.
- •3.2. Основные стадии.
- •3.3. Технологическая схема производства концентрированной азотной кислоты прямым синтезом.
- •Лекция № 7 Химическая технология серной кислоты
- •1. Общие сведения.
- •1.1 Значение и применение серной кислоты.
- •1.2 Свойства серной кислоты.
- •1.3 Сырьевые источники.
- •1.4. Промышленные сорта серной кислоты.
- •1.5. Способы получения серной кислоты.
- •2. Производство серной кислоты.
- •2.1. Основные стадии производства серной кислоты.
- •2.2. Получение диоксида серы so2.
- •3. Получение so2 из флотационного колчедана.
- •3.1. Основные стадии получения диоксида серы.
- •3.2. Физико-химические основы процесса обжига флотационного колчедана.
- •3.3. Очистка обжигового газа от пыли.
- •3.4. Специальная тонкая очистка печного газа
- •3.5. Осушка обжигового газа.
- •3.6. Принципиальная схема производства.
- •Лекция №8 Получение диоксида серы из серы.
- •Технологические свойства серы.
- •2. Теоретические основы горения серы.
- •3. Схема установки для сжигания серы в распылённом состоянии.
- •3.6. Схема производства серной кислоты из серы.
- •Лекция № 9 физико-химические основы Контактного окисления диоксида серы
- •Анализ химического уравнения.
- •Выражение для константы равновесия.
- •Кинетическое уравнение.
- •4. Выбор оптимальных условий ведения процесса.
- •4.1. Влияние состава исходной газовой смеси.
- •4.2. Влияние температуры.
- •4.3. Влияние давления.
- •4.4. Катализаторы
- •Лекция №10 абсорбция. Очистка отходящих газов. Производство серной кислоты из сероводорода
- •1. Абсорбция триоксида серы.
- •2. Очистка отходящих газов.
- •3. Производство серной кислоты из сероводорода.
- •4. Основные направления совершенствования сернокислотного производства.
- •Лекция № 11 Электрохимические производства.
- •1. Общие сведения.
- •2. Теоретические основы электролиза.
- •3. Электролиз воды.
- •Лекция №12 Электролиз водного раствора хлорида натрия
- •Общие сведения.
- •2. Электрохимические процессы, протекающие при электролизе водного раствора хлорида натрия.
- •3. Промышленные электрохимические методы получения хлора.
- •4. Электролиз водных растворов хлоридов с применением стального катода.
- •4.1. Приготовление и очистка рассола.
- •4.2. Побочные процессы электролиза.
- •4.4. Технологическая схема производства водорода, хлора и щелочи.
- •4.5. Выпаривание электролитического щёлока.
- •5. Электролиз водного раствора хлорида натрия с ртутным катодом.
- •5.1. Физико-химические основы процесса.
- •5.2. Принципиальная схема электролиза с ртутным катодом.
- •Лекция №13 Производство хлористого водорода и соляной кислоты.
- •1. Свойства и применение хлористого водорода.
- •2. Способы производства хлористого водорода.
- •3. Теоретические основы синтеза хлористого водорода.
- •4. Абсорбция хлороводорода или получение соляной кислоты.
- •5. Схема получения хлороводорода и соляной кислоты.
- •6. Получение жидкого хлороводорода.
- •Лекция № 14 Химическая технология Получения нитрата аммония или аммиачной селитры
- •1. Общие сведения.
- •Физические свойства нитрата аммония.
- •1.2. Химические свойства нитрата аммония.
- •1.3. Технологические свойства.
- •1.4. Применение нитрата аммония.
- •1.5. Характеристика готового продукта.
- •2. Технология производства нитрата аммония.
- •2.1. Физико-химические основы процесса синтеза нитрата аммония.
- •2.2. Технологические схемы производства.
- •3. Техника безопасности в производстве аммиачной селитры.
- •Лекция № 15 Производство карбамида.
- •1. Общие вопросы.
- •1.1. Свойства карбамида.
- •1.2. Применение карбамида.
- •1.3. Сырьё.
- •2. Физико-химические основы процесса синтеза карбамида.
- •2.1. Химические уравнения и их анализ.
- •2.2. Оптимальный технологический режим процесса синтеза карбамида.
- •3. Промышленные схемы производства карбамида.
- •4. Технологическая схема производства карбамида с полным жидкостным рециклом и двухступенчатой дистилляцией плава.
- •5.Стриппинг-процесс.
- •Лекция №16 Производство кальцинированной соды или карбоната натрия.
- •Общие сведения.
- •2. Свойства и нахождение в природе карбоната натрия.
- •3. Получение кальцинированной соды по способу Леблана.
- •4.1. Химические реакции их анализ.
- •4.2. Основные операции (или стадии) производства кальцинированной соды.
- •4.3 Теоретические основы производства кальцинированной соды аммиачным способом.
- •4.4. Принципиальная технологическая схема производства кальцинированной соды по аммиачному способу
- •5. Получение гидрокарбоната натрия
- •Лекция № 17 производство гидроксида натрия или каустической соды химическим способом
- •1. Общие сведения.
- •2. Известковый способ производства гидроксида натрия
- •Химические реакции
- •Физико-химические основы процесса каустификации
- •Основные операции технологического процесса.
- •3.Ферритный способ производства гидроксида натрия.
- •3.1. Сырьё.
- •3.2. Химические реакции.
- •3.3. Основные стадии.
- •3.4. Расходные коэффициенты.
- •3.5. Совершенствование метода.
- •Элементы технологического расчёта реактора.
- •Список рекомендуемой литературы
- •Оглавление
- •650000, Кемерово, ул, Весенняя, 28.
- •650000, Кемерово, ул. Д.Бедного, 4а.
3.2.2. Скорость окисления аммиака.
Из двух реакций (3.2 и 3.3), конкурирующих с целевой реакцией окисления аммиака (3.1), наиболее опасной является реакция (3.3), приводящая к образованию элементарного азота.
Скорость обоих реакций (3.1 и 3.3) может быть описана общим для гетерогенного катализа уравнением:
υ = K·F·∆C
то есть скорость зависит от следующих параметров процесса:
– температура (через К – константу);
– давление (давление и концентрация газа находятся в прямо пропорциональной зависимости);
– состав аммиачно-воздушной смеси, то есть отношение NH3 : O2, (через ∆C);
– время контактирования, то есть время пребывания аммиачно-воздушной смеси в зоне катализатора (время и скорость обратно пропорциональны).
Влияние этих факторов на скорость окисления аммиака до NO (реакция 3.1) и до N2 (реакция 3.3) различно и, следовательно, выход продуктов реакции окисления различен.
ВЫВОД. Отсюда следует, что, регулируя параметры процесса, можно добиться наибольшего выхода продуктов целевой реакции.
А теперь рассмотрим, как различные указанные факторы влияют на скорость реакций (3.1) и (3.3).
3.2.3. Определение оптимальной температуры.
Температура оказывает существенное влияние на выход оксида азота NO. Каталитическая реакция окисления аммиака начинается при относительно низких температурах: на чистой платине – при 195 °С, на платиноидных катализаторах – около 300°С.
При увеличении температуры выход NO увеличивается. Объясняется это тем, что уменьшается проскок аммиака и снижается содержание в продуктах реакции N2 и H2O, то есть за счёт проявления большей селективности катализатора к целевой реакции (3.1).
Максимальный выход NO наблюдается при температуре 900 – 920°С. На чистой платине он достигает 96%, а на сплавах платины, родия и палладия – 99%.
(При этих температурах побочным продуктом окисления аммиака является азот N2)
В промышленных установках процесс ведут при температуре 800°С. Объясняется это тем, что при атмосферном давлении и повышении температуры от 800°С до 900°С выход целевого продукта NO увеличивается незначительно, а потери платины существенно возрастают. Кроме того, при температуре выше 800°С возрастает скорость реакции (3.3) с образованием молекулярного азота.
На рисунке (Рис.8) представлена зависимость выхода аммиака от температуры процесса.
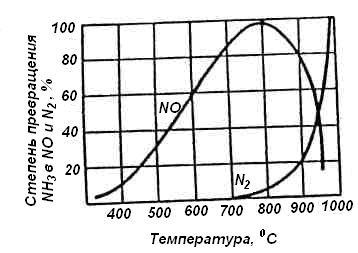
Рис.8. Зависимость степени превращения аммиака при его окислении от температуры
ВЫВОД. Из рисунка видно, что благоприятной температурой для реакции (3.1) является интервал 750 – 800ºС. Однако при повышении температуры от 700 – 800ºС значительно ускоряется реакция (3.3) , идущая с образованием N2.
При средних давлениях (0,3 – 0,5МПа) окисление проводят при 850 – 870°С.
При высоких давлениях (0,7 – 1,0МПа) – при 900 – 920°С.
Почему при повышении давления можно увеличивать температуру процесса?
– При повышении давления уменьшается время контактирования и побочные реакции практически не успевают протекать.
На неплатиновых (оксидных) катализаторах, менее активных, время контактирования необходимо увеличивать в десятки раз по сравнению с платиноидными, при этом температура процесса снижается до 700 – 750 °С.
