
- •Химическая технология неорганических веществ. Основные производства
- •Химическая технология неорганических веществ. Основные производства
- •Предисловие
- •Лекции №1-2 получение синтетического аммиака
- •1. Общие сведения.
- •1.1.Свойства аммиака.
- •1.2. Значение и применение аммиака.
- •2.Физико-химические основы синтеза аммиака.
- •3. Технологическая схема синтеза аммиака при среднем давлении.
- •4. Основные направления развития производства аммиака.
- •Лекции №3-4 химия и технология азотной кислоты.
- •1.Общие сведения.
- •1.1.Физические свойства Диаграммы состояния.
- •1.2. Химические свойства.
- •1.4. Применение азотной кислоты.
- •1.5. Способы получения азотной кислоты.
- •2. Получение неконцентрированной азотной кислоты из аммиака (химические уравнения и стадии).
- •3. Физико-химические основы процесса окисления аммиака.
- •3.1. Химические уравнения процесса окисления аммиака и их анализ.
- •3.2. Выбор оптимальных условий процесса окисления аммиака.
- •3.2.1. Катализаторы процесса окисления аммиака.
- •3.2.2. Скорость окисления аммиака.
- •3.2.3. Определение оптимальной температуры.
- •3.2.4. Определение оптимального давления процесса.
- •3.2.5. Состав газовой смеси.
- •4. Физико-химические основы процесса окисления нитрозных газов (no в no2).
- •5. Физико-химические основы процесса поглощения оксидов азота водой.
- •6. Очистка отходящих газов.
- •Лекция № 5 Получение неконцентрированной азотной кислоты в промышленности.
- •1. Основные операции и принципиальная схема.
- •2. Технологические схемы производства неконцентрированной азотной кислоты.
- •3. Принципиальная технологическая схема получения неконцентрированной азотной кислоты под повышенным давлением
- •Лекция № 6 Получение концентрированной азотной кислоты.
- •1. Общая характеристика методов получения концентрированной азотной кислоты.
- •2. Получение концентрированной азотной кислоты из разбавленных растворов.
- •3. Прямой синтез концентрированной азотной кислоты.
- •3.2. Основные стадии.
- •3.3. Технологическая схема производства концентрированной азотной кислоты прямым синтезом.
- •Лекция № 7 Химическая технология серной кислоты
- •1. Общие сведения.
- •1.1 Значение и применение серной кислоты.
- •1.2 Свойства серной кислоты.
- •1.3 Сырьевые источники.
- •1.4. Промышленные сорта серной кислоты.
- •1.5. Способы получения серной кислоты.
- •2. Производство серной кислоты.
- •2.1. Основные стадии производства серной кислоты.
- •2.2. Получение диоксида серы so2.
- •3. Получение so2 из флотационного колчедана.
- •3.1. Основные стадии получения диоксида серы.
- •3.2. Физико-химические основы процесса обжига флотационного колчедана.
- •3.3. Очистка обжигового газа от пыли.
- •3.4. Специальная тонкая очистка печного газа
- •3.5. Осушка обжигового газа.
- •3.6. Принципиальная схема производства.
- •Лекция №8 Получение диоксида серы из серы.
- •Технологические свойства серы.
- •2. Теоретические основы горения серы.
- •3. Схема установки для сжигания серы в распылённом состоянии.
- •3.6. Схема производства серной кислоты из серы.
- •Лекция № 9 физико-химические основы Контактного окисления диоксида серы
- •Анализ химического уравнения.
- •Выражение для константы равновесия.
- •Кинетическое уравнение.
- •4. Выбор оптимальных условий ведения процесса.
- •4.1. Влияние состава исходной газовой смеси.
- •4.2. Влияние температуры.
- •4.3. Влияние давления.
- •4.4. Катализаторы
- •Лекция №10 абсорбция. Очистка отходящих газов. Производство серной кислоты из сероводорода
- •1. Абсорбция триоксида серы.
- •2. Очистка отходящих газов.
- •3. Производство серной кислоты из сероводорода.
- •4. Основные направления совершенствования сернокислотного производства.
- •Лекция № 11 Электрохимические производства.
- •1. Общие сведения.
- •2. Теоретические основы электролиза.
- •3. Электролиз воды.
- •Лекция №12 Электролиз водного раствора хлорида натрия
- •Общие сведения.
- •2. Электрохимические процессы, протекающие при электролизе водного раствора хлорида натрия.
- •3. Промышленные электрохимические методы получения хлора.
- •4. Электролиз водных растворов хлоридов с применением стального катода.
- •4.1. Приготовление и очистка рассола.
- •4.2. Побочные процессы электролиза.
- •4.4. Технологическая схема производства водорода, хлора и щелочи.
- •4.5. Выпаривание электролитического щёлока.
- •5. Электролиз водного раствора хлорида натрия с ртутным катодом.
- •5.1. Физико-химические основы процесса.
- •5.2. Принципиальная схема электролиза с ртутным катодом.
- •Лекция №13 Производство хлористого водорода и соляной кислоты.
- •1. Свойства и применение хлористого водорода.
- •2. Способы производства хлористого водорода.
- •3. Теоретические основы синтеза хлористого водорода.
- •4. Абсорбция хлороводорода или получение соляной кислоты.
- •5. Схема получения хлороводорода и соляной кислоты.
- •6. Получение жидкого хлороводорода.
- •Лекция № 14 Химическая технология Получения нитрата аммония или аммиачной селитры
- •1. Общие сведения.
- •Физические свойства нитрата аммония.
- •1.2. Химические свойства нитрата аммония.
- •1.3. Технологические свойства.
- •1.4. Применение нитрата аммония.
- •1.5. Характеристика готового продукта.
- •2. Технология производства нитрата аммония.
- •2.1. Физико-химические основы процесса синтеза нитрата аммония.
- •2.2. Технологические схемы производства.
- •3. Техника безопасности в производстве аммиачной селитры.
- •Лекция № 15 Производство карбамида.
- •1. Общие вопросы.
- •1.1. Свойства карбамида.
- •1.2. Применение карбамида.
- •1.3. Сырьё.
- •2. Физико-химические основы процесса синтеза карбамида.
- •2.1. Химические уравнения и их анализ.
- •2.2. Оптимальный технологический режим процесса синтеза карбамида.
- •3. Промышленные схемы производства карбамида.
- •4. Технологическая схема производства карбамида с полным жидкостным рециклом и двухступенчатой дистилляцией плава.
- •5.Стриппинг-процесс.
- •Лекция №16 Производство кальцинированной соды или карбоната натрия.
- •Общие сведения.
- •2. Свойства и нахождение в природе карбоната натрия.
- •3. Получение кальцинированной соды по способу Леблана.
- •4.1. Химические реакции их анализ.
- •4.2. Основные операции (или стадии) производства кальцинированной соды.
- •4.3 Теоретические основы производства кальцинированной соды аммиачным способом.
- •4.4. Принципиальная технологическая схема производства кальцинированной соды по аммиачному способу
- •5. Получение гидрокарбоната натрия
- •Лекция № 17 производство гидроксида натрия или каустической соды химическим способом
- •1. Общие сведения.
- •2. Известковый способ производства гидроксида натрия
- •Химические реакции
- •Физико-химические основы процесса каустификации
- •Основные операции технологического процесса.
- •3.Ферритный способ производства гидроксида натрия.
- •3.1. Сырьё.
- •3.2. Химические реакции.
- •3.3. Основные стадии.
- •3.4. Расходные коэффициенты.
- •3.5. Совершенствование метода.
- •Элементы технологического расчёта реактора.
- •Список рекомендуемой литературы
- •Оглавление
- •650000, Кемерово, ул, Весенняя, 28.
- •650000, Кемерово, ул. Д.Бедного, 4а.
3. Техника безопасности в производстве аммиачной селитры.
В производстве аммиачной селитры при неисправности оборудования или отклонении технологического режима возможно выделение вредных газов и паров. При повышении температуры или в присутствии некоторых примесей может произойти термическое разложение аммиачной селитры и её растворов, протекающее со взрывом и выделением вредных газов.
Возможны проливы и разбрызгивания горячих растворов, что может привести к ожогам.
Во время транспортирования, охлаждения и упаковки выделяется пыль.
Основными мерами защиты от вредного воздействия являются: герметизация аппаратуры и коммуникаций, автоматизация технологического процесса, устройство вентиляции, теплоизоляция горячих поверхностей, наличие средств индивидуальной защиты.
Лекция № 15 Производство карбамида.
ВОПРОСЫ
1. Общие вопросы.
1.1. Свойства карбамида.
1.2. Применение карбамида.
1.3. Сырьё.
2. Физико-химические основы процесса синтеза карбамида.
2.1. Химические реакции и их анализ.
2.2. Оптимальный технологический режим процесса синтеза карбамида.
3. Промышленные схемы получения карбамида.
4. Технологическая схема производства карбамида с полным жидкостным рециклом и двухступенчатой дистилляцией плава.
5.Стриппинг-процесс.
1. Общие вопросы.
1.1. Свойства карбамида.
Карбамид (мочевина) – диамид угольной кислоты или амид карбаминовой кислоты H2N–CО–NH2 имеет следующую структурную формулу:
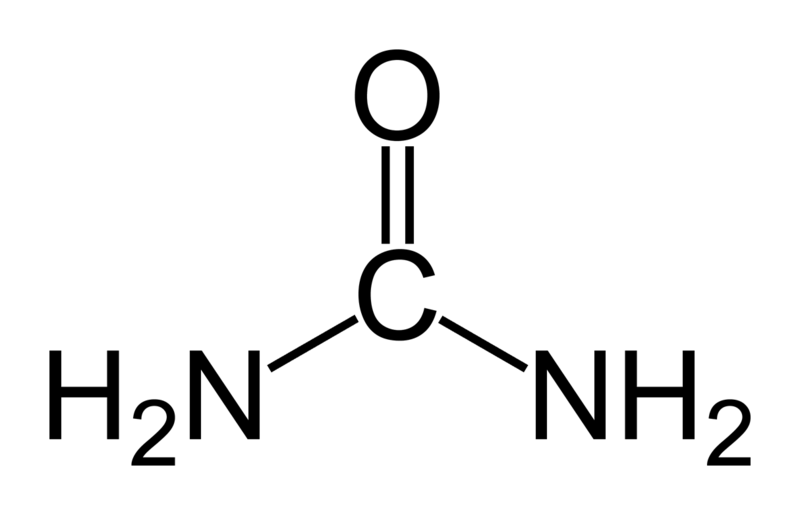
Карбамид представляет собой твёрдое кристаллическое вещество, хорошо растворимое в воде.
Его температура плавления 132,7 ºС.
Карбамид – гигроскопическое вещество.
При нагревании выше 130ºС разлагается сообразованием биурета и выделением аммиака:
H2N–CО–NH2 → H2N–CО–NH–CО–NH2 + NH3.
Водные растворы карбамида устойчивы до 80ºС, при более высокой температуре превращается в карбонат аммония:
H2NCONH2 + 2H2O ↔ (NH4)2CO3,
который далее разлагается на аммиак и диоксид углерода:
(NH4)2CO3 ↔ 2 NH3 + CO2 + H2O.
1.2. Применение карбамида.
Карбамид – это ценное, нейтральное, концентрированное, водорастворимое удобрение. Под действием микроорганизмов в почве карбамид превращается в карбонат аммония, который затем разлагается на NH3, CO2 и H2O.
Карбамид используется в качестве подкормки для скота.
На основе карбамида (или мочевины) получают мочевинофомальдегидные смолы, которые используются в качестве связующего в производстве пластмасс и древесностружечных плит, для получения синтетических клеев и пропитки тканей.
1.3. Сырьё.
Промышленный способ получения карбамида был предложен А.И. Базаровым в 1868 году.
В качестве сырья для получения карбамида используются аммиак и углекислый газ, которые поступают с установки синтеза аммиака.
2. Физико-химические основы процесса синтеза карбамида.
