
- •Химическая технология неорганических веществ. Основные производства
- •Химическая технология неорганических веществ. Основные производства
- •Предисловие
- •Лекции №1-2 получение синтетического аммиака
- •1. Общие сведения.
- •1.1.Свойства аммиака.
- •1.2. Значение и применение аммиака.
- •2.Физико-химические основы синтеза аммиака.
- •3. Технологическая схема синтеза аммиака при среднем давлении.
- •4. Основные направления развития производства аммиака.
- •Лекции №3-4 химия и технология азотной кислоты.
- •1.Общие сведения.
- •1.1.Физические свойства Диаграммы состояния.
- •1.2. Химические свойства.
- •1.4. Применение азотной кислоты.
- •1.5. Способы получения азотной кислоты.
- •2. Получение неконцентрированной азотной кислоты из аммиака (химические уравнения и стадии).
- •3. Физико-химические основы процесса окисления аммиака.
- •3.1. Химические уравнения процесса окисления аммиака и их анализ.
- •3.2. Выбор оптимальных условий процесса окисления аммиака.
- •3.2.1. Катализаторы процесса окисления аммиака.
- •3.2.2. Скорость окисления аммиака.
- •3.2.3. Определение оптимальной температуры.
- •3.2.4. Определение оптимального давления процесса.
- •3.2.5. Состав газовой смеси.
- •4. Физико-химические основы процесса окисления нитрозных газов (no в no2).
- •5. Физико-химические основы процесса поглощения оксидов азота водой.
- •6. Очистка отходящих газов.
- •Лекция № 5 Получение неконцентрированной азотной кислоты в промышленности.
- •1. Основные операции и принципиальная схема.
- •2. Технологические схемы производства неконцентрированной азотной кислоты.
- •3. Принципиальная технологическая схема получения неконцентрированной азотной кислоты под повышенным давлением
- •Лекция № 6 Получение концентрированной азотной кислоты.
- •1. Общая характеристика методов получения концентрированной азотной кислоты.
- •2. Получение концентрированной азотной кислоты из разбавленных растворов.
- •3. Прямой синтез концентрированной азотной кислоты.
- •3.2. Основные стадии.
- •3.3. Технологическая схема производства концентрированной азотной кислоты прямым синтезом.
- •Лекция № 7 Химическая технология серной кислоты
- •1. Общие сведения.
- •1.1 Значение и применение серной кислоты.
- •1.2 Свойства серной кислоты.
- •1.3 Сырьевые источники.
- •1.4. Промышленные сорта серной кислоты.
- •1.5. Способы получения серной кислоты.
- •2. Производство серной кислоты.
- •2.1. Основные стадии производства серной кислоты.
- •2.2. Получение диоксида серы so2.
- •3. Получение so2 из флотационного колчедана.
- •3.1. Основные стадии получения диоксида серы.
- •3.2. Физико-химические основы процесса обжига флотационного колчедана.
- •3.3. Очистка обжигового газа от пыли.
- •3.4. Специальная тонкая очистка печного газа
- •3.5. Осушка обжигового газа.
- •3.6. Принципиальная схема производства.
- •Лекция №8 Получение диоксида серы из серы.
- •Технологические свойства серы.
- •2. Теоретические основы горения серы.
- •3. Схема установки для сжигания серы в распылённом состоянии.
- •3.6. Схема производства серной кислоты из серы.
- •Лекция № 9 физико-химические основы Контактного окисления диоксида серы
- •Анализ химического уравнения.
- •Выражение для константы равновесия.
- •Кинетическое уравнение.
- •4. Выбор оптимальных условий ведения процесса.
- •4.1. Влияние состава исходной газовой смеси.
- •4.2. Влияние температуры.
- •4.3. Влияние давления.
- •4.4. Катализаторы
- •Лекция №10 абсорбция. Очистка отходящих газов. Производство серной кислоты из сероводорода
- •1. Абсорбция триоксида серы.
- •2. Очистка отходящих газов.
- •3. Производство серной кислоты из сероводорода.
- •4. Основные направления совершенствования сернокислотного производства.
- •Лекция № 11 Электрохимические производства.
- •1. Общие сведения.
- •2. Теоретические основы электролиза.
- •3. Электролиз воды.
- •Лекция №12 Электролиз водного раствора хлорида натрия
- •Общие сведения.
- •2. Электрохимические процессы, протекающие при электролизе водного раствора хлорида натрия.
- •3. Промышленные электрохимические методы получения хлора.
- •4. Электролиз водных растворов хлоридов с применением стального катода.
- •4.1. Приготовление и очистка рассола.
- •4.2. Побочные процессы электролиза.
- •4.4. Технологическая схема производства водорода, хлора и щелочи.
- •4.5. Выпаривание электролитического щёлока.
- •5. Электролиз водного раствора хлорида натрия с ртутным катодом.
- •5.1. Физико-химические основы процесса.
- •5.2. Принципиальная схема электролиза с ртутным катодом.
- •Лекция №13 Производство хлористого водорода и соляной кислоты.
- •1. Свойства и применение хлористого водорода.
- •2. Способы производства хлористого водорода.
- •3. Теоретические основы синтеза хлористого водорода.
- •4. Абсорбция хлороводорода или получение соляной кислоты.
- •5. Схема получения хлороводорода и соляной кислоты.
- •6. Получение жидкого хлороводорода.
- •Лекция № 14 Химическая технология Получения нитрата аммония или аммиачной селитры
- •1. Общие сведения.
- •Физические свойства нитрата аммония.
- •1.2. Химические свойства нитрата аммония.
- •1.3. Технологические свойства.
- •1.4. Применение нитрата аммония.
- •1.5. Характеристика готового продукта.
- •2. Технология производства нитрата аммония.
- •2.1. Физико-химические основы процесса синтеза нитрата аммония.
- •2.2. Технологические схемы производства.
- •3. Техника безопасности в производстве аммиачной селитры.
- •Лекция № 15 Производство карбамида.
- •1. Общие вопросы.
- •1.1. Свойства карбамида.
- •1.2. Применение карбамида.
- •1.3. Сырьё.
- •2. Физико-химические основы процесса синтеза карбамида.
- •2.1. Химические уравнения и их анализ.
- •2.2. Оптимальный технологический режим процесса синтеза карбамида.
- •3. Промышленные схемы производства карбамида.
- •4. Технологическая схема производства карбамида с полным жидкостным рециклом и двухступенчатой дистилляцией плава.
- •5.Стриппинг-процесс.
- •Лекция №16 Производство кальцинированной соды или карбоната натрия.
- •Общие сведения.
- •2. Свойства и нахождение в природе карбоната натрия.
- •3. Получение кальцинированной соды по способу Леблана.
- •4.1. Химические реакции их анализ.
- •4.2. Основные операции (или стадии) производства кальцинированной соды.
- •4.3 Теоретические основы производства кальцинированной соды аммиачным способом.
- •4.4. Принципиальная технологическая схема производства кальцинированной соды по аммиачному способу
- •5. Получение гидрокарбоната натрия
- •Лекция № 17 производство гидроксида натрия или каустической соды химическим способом
- •1. Общие сведения.
- •2. Известковый способ производства гидроксида натрия
- •Химические реакции
- •Физико-химические основы процесса каустификации
- •Основные операции технологического процесса.
- •3.Ферритный способ производства гидроксида натрия.
- •3.1. Сырьё.
- •3.2. Химические реакции.
- •3.3. Основные стадии.
- •3.4. Расходные коэффициенты.
- •3.5. Совершенствование метода.
- •Элементы технологического расчёта реактора.
- •Список рекомендуемой литературы
- •Оглавление
- •650000, Кемерово, ул, Весенняя, 28.
- •650000, Кемерово, ул. Д.Бедного, 4а.
4.3. Влияние давления.
Зависимость равновесной степени окисления SО2 в SО3 от давления отражена на графике (Рис.23).
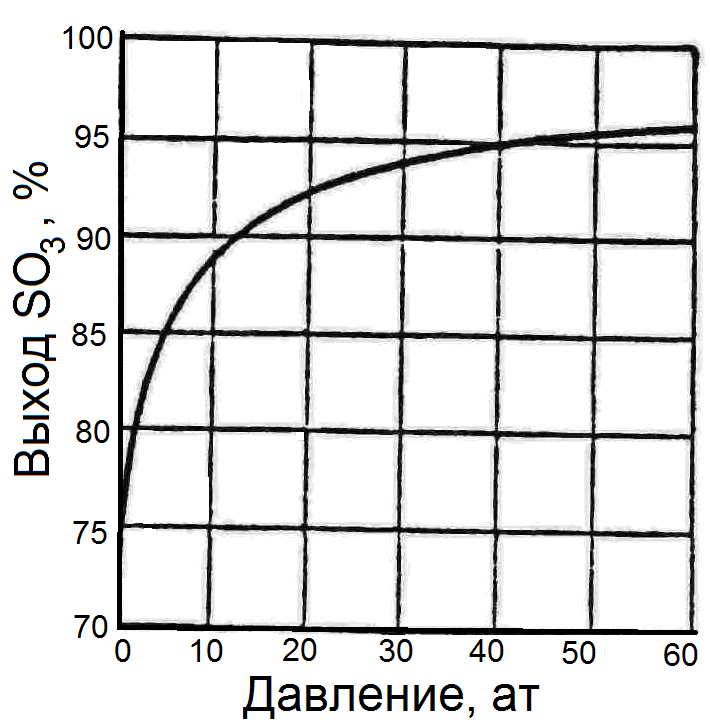
Рис. 23. Зависимость равновесной степени окисления SО2 в SО3 от давления
Из графика можно сделать следующие выводы:
– кривая имеет затухающий характер;
– сильно повышать давление нецелесообразно.
Зависимость равновесной степени окисления SО2 в SО3 от давления также представлена в таблице (состав газовой смеси: 7% SО2; 11% О2 и 82% N2).
t, °C |
Равновесная степень превращения SO2 → SO3 (Xp) |
|||
1 ат. |
10 ат. |
50 ат. |
100 ат. |
|
400 |
99,2 |
99,72 |
99,88 |
99,92 |
450 |
97,5 |
99,2 |
99,6 |
99,7 |
500 |
93,5 |
97,8 |
99,0 |
99,3 |
600 |
73,7 |
89,5 |
95,0 |
96,4 |
Из приведённых данных видно, что:
– при низких температурах (например, 400°С) повышение давления сказывается на степени превращения незначительно,
– при высоких температурах (например, 600°С повышение давления значительно влияет на степень превращения), что расширяет температурный диапазон, при котором можно достигнуть высокой степени превращения.
Небольшое увеличение степени окисления с повышением давления не компенсирует затрат, связанных с удорожанием аппаратуры и коммуникаций и увеличением энергии на сжатие газа.
Окончательный ВЫВОД. Повышать давление на стадии контактирования нецелесообразно.
4.4. Катализаторы
Выше были обоснованы условия, при которых достигается максимальная степень превращения SО2 в SО3. Но даже при таких благоприятных условиях ведения процесса скорость реакции не достаточна для проведения процесса в промышленных условиях.
Для ускорения реакции используются катализаторы. Окисление SО2 в SО3 является гетерогенной каталитической реакцией. Независимо от свойств катализатора реакция протекает в несколько последовательных стадий:
– диффузия газа к поверхности катализатора
– активированная адсорбция кислорода из газа поверхностью катализатора (при этом связь между атомами адсорбированного кислорода нарушается)
– связывание молекул. SО2 с атомами О на поверхности катализатора с образованием комплекса (SО2·О·Кат-р).
– перегруппировка, приводящая к образованию на поверхности катализатора групп SО3
SО2·О·Кат-р → SО3 + Кат-р
– десорбция образовавшихся молекул SО3 с поверхности катализатора в газовый объём
– обратная диффузия.
Ранее на всех заводах сернокислотной промышленности в качестве катализатора применялась тонко измельчённая платина, нанесенная на пористые инертные материалы или «носители» (волокнистый асбест, сернокислый магний, гель кремниевой кислоты). Иногда в качестве катализатора применяли оксид железа.
В настоящее время все заводы работают на ванадиевых катализаторах (работы Г.К.Борескова).
Платина является наиболее активным катализатором, на ней реакция идёт уже при 400°С.
В присутствии оксида железа реакция протекает достаточно быстро только при температуре более 600°С.
Ванадиевые катализаторы по активности несколько уступают платиновым, но более дешевы и менее чувствительны к действию примесей газовой смеси (каталитическим ядам).
Чистый пентаоксид ванадия V2O5 обладает невысокой каталитической активностью по отношению к окислению SО2 в SО3. Активные ванадиевые катализаторы всегда содержат наряду с V2O5 и другие соединения – это, к примеру, сульфованадаты щелочных металлов (K2O·V2O5·SO3). Каталитически активное соединение наносят на поверхность диоксида кремния SiO2.
В промышленности применяют следующие типы ванадиевых катализаторов:
БАВ – бариево-алюмованодиевый катализатор.
СВД – сульфо-ванадиевый на доломите.
СВС – сульфованадат на селикагеле.
СВНТ – сульфованадат низкотемпературный.
В соответствии с ГОСТ каталитическая активность массы БАВ в стандартных условиях (температура 485°С и объёмная скорость 4000ч–1) должна обеспечить степень превращения не менее 86%.
Высокими показателями обладают новые отечественные катализаторы ИК-1, ИК-2, ИК-3, ИК-4 (институт катализа).
Наиболее вредным ядом для ванадиевых катализаторов являются соединения мышьяка в газовой смеси. В присутствии As2O3 и AsH3 в газовой смеси при температуре выше 550°С образуется летучее соединение V2O5·As2O5, что приводит к снижению каталитической активности.
Влага не влияет на активность БАВ при температурах, превышающих температуру конденсации серной кислоты. При более низких температурах образуется серная кислота, вызывающая разрушение контактной массы.
ОБЩИЕ ВЫВОДЫ.
Окисление SO2 в SO3 необходимо вести при следующих условиях:
– начинать процесс при температуре около 450°С,
– вести его далее при понижении температуры,
– высокие давления нецелесообразны,
– соотношение компонентов 7% SO2 : 11% O2 (об.)
– присутствие катализатора.
