
- •Химическая технология неорганических веществ. Основные производства
- •Химическая технология неорганических веществ. Основные производства
- •Предисловие
- •Лекции №1-2 получение синтетического аммиака
- •1. Общие сведения.
- •1.1.Свойства аммиака.
- •1.2. Значение и применение аммиака.
- •2.Физико-химические основы синтеза аммиака.
- •3. Технологическая схема синтеза аммиака при среднем давлении.
- •4. Основные направления развития производства аммиака.
- •Лекции №3-4 химия и технология азотной кислоты.
- •1.Общие сведения.
- •1.1.Физические свойства Диаграммы состояния.
- •1.2. Химические свойства.
- •1.4. Применение азотной кислоты.
- •1.5. Способы получения азотной кислоты.
- •2. Получение неконцентрированной азотной кислоты из аммиака (химические уравнения и стадии).
- •3. Физико-химические основы процесса окисления аммиака.
- •3.1. Химические уравнения процесса окисления аммиака и их анализ.
- •3.2. Выбор оптимальных условий процесса окисления аммиака.
- •3.2.1. Катализаторы процесса окисления аммиака.
- •3.2.2. Скорость окисления аммиака.
- •3.2.3. Определение оптимальной температуры.
- •3.2.4. Определение оптимального давления процесса.
- •3.2.5. Состав газовой смеси.
- •4. Физико-химические основы процесса окисления нитрозных газов (no в no2).
- •5. Физико-химические основы процесса поглощения оксидов азота водой.
- •6. Очистка отходящих газов.
- •Лекция № 5 Получение неконцентрированной азотной кислоты в промышленности.
- •1. Основные операции и принципиальная схема.
- •2. Технологические схемы производства неконцентрированной азотной кислоты.
- •3. Принципиальная технологическая схема получения неконцентрированной азотной кислоты под повышенным давлением
- •Лекция № 6 Получение концентрированной азотной кислоты.
- •1. Общая характеристика методов получения концентрированной азотной кислоты.
- •2. Получение концентрированной азотной кислоты из разбавленных растворов.
- •3. Прямой синтез концентрированной азотной кислоты.
- •3.2. Основные стадии.
- •3.3. Технологическая схема производства концентрированной азотной кислоты прямым синтезом.
- •Лекция № 7 Химическая технология серной кислоты
- •1. Общие сведения.
- •1.1 Значение и применение серной кислоты.
- •1.2 Свойства серной кислоты.
- •1.3 Сырьевые источники.
- •1.4. Промышленные сорта серной кислоты.
- •1.5. Способы получения серной кислоты.
- •2. Производство серной кислоты.
- •2.1. Основные стадии производства серной кислоты.
- •2.2. Получение диоксида серы so2.
- •3. Получение so2 из флотационного колчедана.
- •3.1. Основные стадии получения диоксида серы.
- •3.2. Физико-химические основы процесса обжига флотационного колчедана.
- •3.3. Очистка обжигового газа от пыли.
- •3.4. Специальная тонкая очистка печного газа
- •3.5. Осушка обжигового газа.
- •3.6. Принципиальная схема производства.
- •Лекция №8 Получение диоксида серы из серы.
- •Технологические свойства серы.
- •2. Теоретические основы горения серы.
- •3. Схема установки для сжигания серы в распылённом состоянии.
- •3.6. Схема производства серной кислоты из серы.
- •Лекция № 9 физико-химические основы Контактного окисления диоксида серы
- •Анализ химического уравнения.
- •Выражение для константы равновесия.
- •Кинетическое уравнение.
- •4. Выбор оптимальных условий ведения процесса.
- •4.1. Влияние состава исходной газовой смеси.
- •4.2. Влияние температуры.
- •4.3. Влияние давления.
- •4.4. Катализаторы
- •Лекция №10 абсорбция. Очистка отходящих газов. Производство серной кислоты из сероводорода
- •1. Абсорбция триоксида серы.
- •2. Очистка отходящих газов.
- •3. Производство серной кислоты из сероводорода.
- •4. Основные направления совершенствования сернокислотного производства.
- •Лекция № 11 Электрохимические производства.
- •1. Общие сведения.
- •2. Теоретические основы электролиза.
- •3. Электролиз воды.
- •Лекция №12 Электролиз водного раствора хлорида натрия
- •Общие сведения.
- •2. Электрохимические процессы, протекающие при электролизе водного раствора хлорида натрия.
- •3. Промышленные электрохимические методы получения хлора.
- •4. Электролиз водных растворов хлоридов с применением стального катода.
- •4.1. Приготовление и очистка рассола.
- •4.2. Побочные процессы электролиза.
- •4.4. Технологическая схема производства водорода, хлора и щелочи.
- •4.5. Выпаривание электролитического щёлока.
- •5. Электролиз водного раствора хлорида натрия с ртутным катодом.
- •5.1. Физико-химические основы процесса.
- •5.2. Принципиальная схема электролиза с ртутным катодом.
- •Лекция №13 Производство хлористого водорода и соляной кислоты.
- •1. Свойства и применение хлористого водорода.
- •2. Способы производства хлористого водорода.
- •3. Теоретические основы синтеза хлористого водорода.
- •4. Абсорбция хлороводорода или получение соляной кислоты.
- •5. Схема получения хлороводорода и соляной кислоты.
- •6. Получение жидкого хлороводорода.
- •Лекция № 14 Химическая технология Получения нитрата аммония или аммиачной селитры
- •1. Общие сведения.
- •Физические свойства нитрата аммония.
- •1.2. Химические свойства нитрата аммония.
- •1.3. Технологические свойства.
- •1.4. Применение нитрата аммония.
- •1.5. Характеристика готового продукта.
- •2. Технология производства нитрата аммония.
- •2.1. Физико-химические основы процесса синтеза нитрата аммония.
- •2.2. Технологические схемы производства.
- •3. Техника безопасности в производстве аммиачной селитры.
- •Лекция № 15 Производство карбамида.
- •1. Общие вопросы.
- •1.1. Свойства карбамида.
- •1.2. Применение карбамида.
- •1.3. Сырьё.
- •2. Физико-химические основы процесса синтеза карбамида.
- •2.1. Химические уравнения и их анализ.
- •2.2. Оптимальный технологический режим процесса синтеза карбамида.
- •3. Промышленные схемы производства карбамида.
- •4. Технологическая схема производства карбамида с полным жидкостным рециклом и двухступенчатой дистилляцией плава.
- •5.Стриппинг-процесс.
- •Лекция №16 Производство кальцинированной соды или карбоната натрия.
- •Общие сведения.
- •2. Свойства и нахождение в природе карбоната натрия.
- •3. Получение кальцинированной соды по способу Леблана.
- •4.1. Химические реакции их анализ.
- •4.2. Основные операции (или стадии) производства кальцинированной соды.
- •4.3 Теоретические основы производства кальцинированной соды аммиачным способом.
- •4.4. Принципиальная технологическая схема производства кальцинированной соды по аммиачному способу
- •5. Получение гидрокарбоната натрия
- •Лекция № 17 производство гидроксида натрия или каустической соды химическим способом
- •1. Общие сведения.
- •2. Известковый способ производства гидроксида натрия
- •Химические реакции
- •Физико-химические основы процесса каустификации
- •Основные операции технологического процесса.
- •3.Ферритный способ производства гидроксида натрия.
- •3.1. Сырьё.
- •3.2. Химические реакции.
- •3.3. Основные стадии.
- •3.4. Расходные коэффициенты.
- •3.5. Совершенствование метода.
- •Элементы технологического расчёта реактора.
- •Список рекомендуемой литературы
- •Оглавление
- •650000, Кемерово, ул, Весенняя, 28.
- •650000, Кемерово, ул. Д.Бедного, 4а.
Выражение для константы равновесия.
Через равновесные концентрации компонентов:
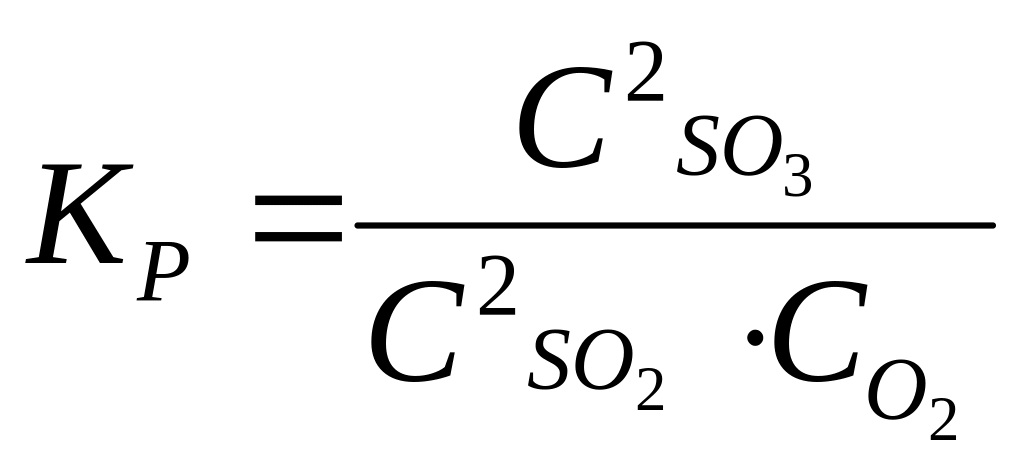 .
.
Через парциальные давления компонентов:
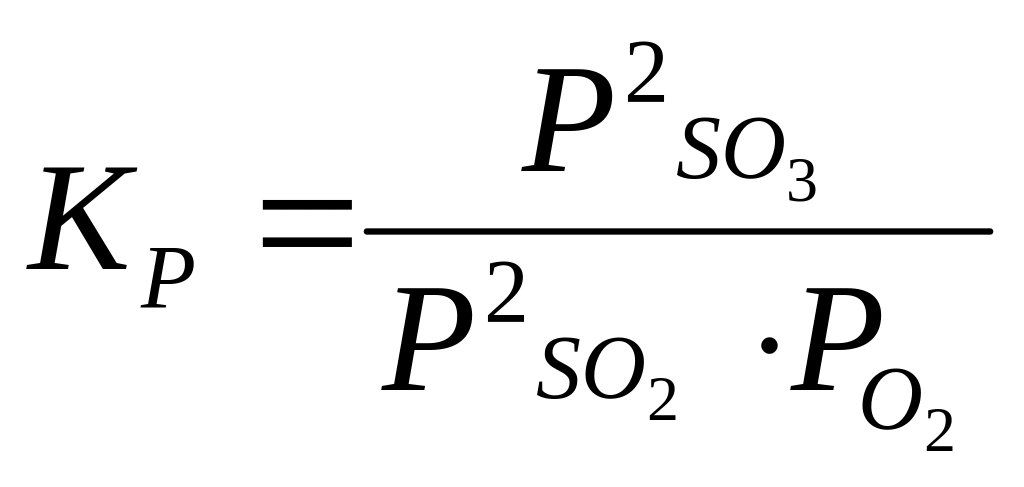 .
.
Кинетическое уравнение.
Зависимость скорости реакции от концентрации выражается законом действующих масс:
![]()
Зависимость скорости реакции от температуры отражено уравнением Аррениуса:
K = k0·e(–E/RT),
Тепловой эффект химической реакции при различных температурах вычисляется по уравнению Кирхгофа. Для некоторых реакций установлены эмпирические уравнения. Существует также эмпирическое уравнение для данной реакции:
Q = 101420 – 9,6T Дж\моль,
где Т = t + 273
Эта формула позволяет определить количество теплоты реакции в интервале температур 400 – 700°С.
Отсюда количество теплоты, выделяющееся при температуре 500°С или 773К равно Q500°C = 94 кДж/моль или ∆Н773К = – 94 кДж/моль
4. Выбор оптимальных условий ведения процесса.
Показателем эффективности промышленного процесса являются:
– высокая степень превращения SО2 в SО3.
– приемлемая скорость процесса.
Состояние равновесия зависит от концентрации реагирующих веществ, от температуры и от давления.
Рассмотрим влияние всех трёх факторов на равновесный выход SО3.
4.1. Влияние состава исходной газовой смеси.
Влияние состава исходной газовой смеси на равновесную степень превращения SО2 в SО3 (Р = 0,1 МПа.; t = 475°С) представлено в табл.
|
5 |
6 |
7 |
8 |
9 |
10 |
|
13,86 |
12,43 |
11 |
9,58 |
8,15 |
6,72 |
Равновесная степень превращения SO2 → SO3 (Xp) |
96,5 |
96,2 |
95,8 |
95,2 |
94,3 |
92,3 |
Из таблицы видно, что оптимальным является следующий состав: 7 – 7,7% SО2; 11% О2 и 82% N2. Расчётная равновесная степень превращения SО2 в SО3 (при указанных условиях) равна 95,8%.
При более высоком содержании SО2 значительно уменьшается равновесная степень превращения (вследствие уменьшения содержания О2 в газе). При меньшем содержании SО2 понижается производительность контактной массы (или уменьшается скорость реакции).
4.2. Влияние температуры.
Смещение равновесия в сторону образования триоксида серы происходит с понижением температуры.
Влияние температуры на равновесную степень превращения SО2 в SО3 для исходной газовой смеси состава (7% SО2; 11% О2 и 82% N2 при Р = 0,1МПа) представлено в табл.
t, °C |
400 |
450 |
475 |
500 |
530 |
550 |
600 |
1000 |
SO2 → SO3 (Xp) |
92,2 |
97,5 |
95,8 |
93,5 |
89,2 |
85,6 |
73,7 |
5,6 |
Из таблицы следует, что при температуре 475°С. степень превращения достаточно высокая (95,8%).
Обратите внимание, что при температуре более низкой (400, 450°С) степень превращения высокая, НО при уменьшении температуры снижается скорость реакции. Увеличение температуры приводит к смещению равновесия влево, выход SО3 значительно уменьшается (при 1000°С практически полная диссоциация).
На рисунке (Рис.22) графически представлена зависимость равновесного выхода SО3 от температуры.
Из приведённых данных (таблица и рисунок) следует, что для достижения высокой степени (до 98%) превращения реакцию необходимо проводить при температурах ниже 440°С, по крайней мере к моменту её завершения.
Для того, чтобы увеличить скорость реакции, поступающий в контактный аппарат газ предварительно подогревается до требуемой температуры.
Для нагревания используется тепло прореагировавших газов, выходящих из контактного аппарата.
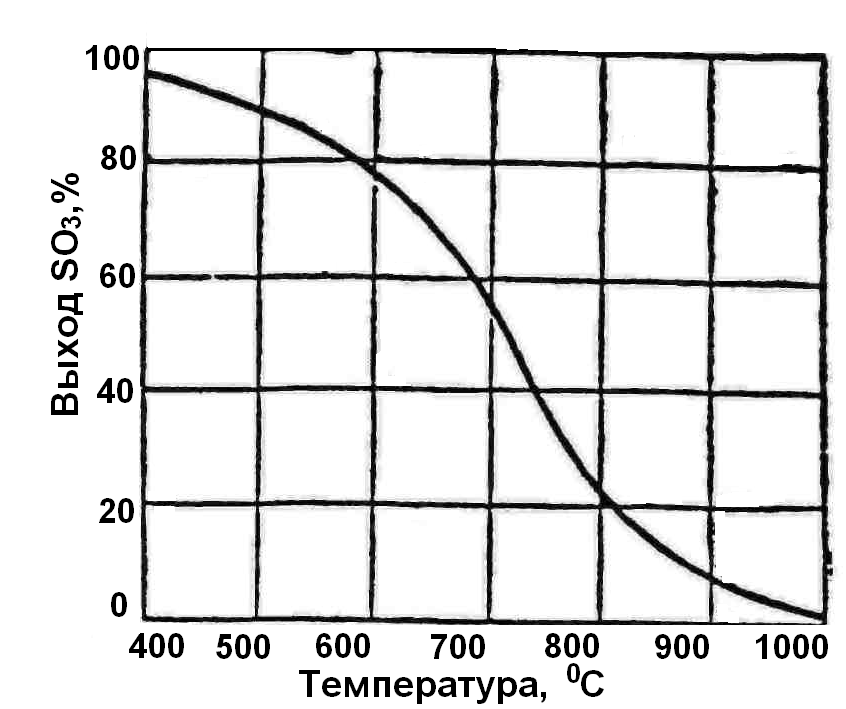
Рис. 22. Зависимость равновесного выхода SО3 от температуры.
Процесс окисления SО2 в SО3 протекает автотермично, то есть без подвода тепла извне, за счёт тепла реакции.
