
- •Химическая технология неорганических веществ. Основные производства
- •Химическая технология неорганических веществ. Основные производства
- •Предисловие
- •Лекции №1-2 получение синтетического аммиака
- •1. Общие сведения.
- •1.1.Свойства аммиака.
- •1.2. Значение и применение аммиака.
- •2.Физико-химические основы синтеза аммиака.
- •3. Технологическая схема синтеза аммиака при среднем давлении.
- •4. Основные направления развития производства аммиака.
- •Лекции №3-4 химия и технология азотной кислоты.
- •1.Общие сведения.
- •1.1.Физические свойства Диаграммы состояния.
- •1.2. Химические свойства.
- •1.4. Применение азотной кислоты.
- •1.5. Способы получения азотной кислоты.
- •2. Получение неконцентрированной азотной кислоты из аммиака (химические уравнения и стадии).
- •3. Физико-химические основы процесса окисления аммиака.
- •3.1. Химические уравнения процесса окисления аммиака и их анализ.
- •3.2. Выбор оптимальных условий процесса окисления аммиака.
- •3.2.1. Катализаторы процесса окисления аммиака.
- •3.2.2. Скорость окисления аммиака.
- •3.2.3. Определение оптимальной температуры.
- •3.2.4. Определение оптимального давления процесса.
- •3.2.5. Состав газовой смеси.
- •4. Физико-химические основы процесса окисления нитрозных газов (no в no2).
- •5. Физико-химические основы процесса поглощения оксидов азота водой.
- •6. Очистка отходящих газов.
- •Лекция № 5 Получение неконцентрированной азотной кислоты в промышленности.
- •1. Основные операции и принципиальная схема.
- •2. Технологические схемы производства неконцентрированной азотной кислоты.
- •3. Принципиальная технологическая схема получения неконцентрированной азотной кислоты под повышенным давлением
- •Лекция № 6 Получение концентрированной азотной кислоты.
- •1. Общая характеристика методов получения концентрированной азотной кислоты.
- •2. Получение концентрированной азотной кислоты из разбавленных растворов.
- •3. Прямой синтез концентрированной азотной кислоты.
- •3.2. Основные стадии.
- •3.3. Технологическая схема производства концентрированной азотной кислоты прямым синтезом.
- •Лекция № 7 Химическая технология серной кислоты
- •1. Общие сведения.
- •1.1 Значение и применение серной кислоты.
- •1.2 Свойства серной кислоты.
- •1.3 Сырьевые источники.
- •1.4. Промышленные сорта серной кислоты.
- •1.5. Способы получения серной кислоты.
- •2. Производство серной кислоты.
- •2.1. Основные стадии производства серной кислоты.
- •2.2. Получение диоксида серы so2.
- •3. Получение so2 из флотационного колчедана.
- •3.1. Основные стадии получения диоксида серы.
- •3.2. Физико-химические основы процесса обжига флотационного колчедана.
- •3.3. Очистка обжигового газа от пыли.
- •3.4. Специальная тонкая очистка печного газа
- •3.5. Осушка обжигового газа.
- •3.6. Принципиальная схема производства.
- •Лекция №8 Получение диоксида серы из серы.
- •Технологические свойства серы.
- •2. Теоретические основы горения серы.
- •3. Схема установки для сжигания серы в распылённом состоянии.
- •3.6. Схема производства серной кислоты из серы.
- •Лекция № 9 физико-химические основы Контактного окисления диоксида серы
- •Анализ химического уравнения.
- •Выражение для константы равновесия.
- •Кинетическое уравнение.
- •4. Выбор оптимальных условий ведения процесса.
- •4.1. Влияние состава исходной газовой смеси.
- •4.2. Влияние температуры.
- •4.3. Влияние давления.
- •4.4. Катализаторы
- •Лекция №10 абсорбция. Очистка отходящих газов. Производство серной кислоты из сероводорода
- •1. Абсорбция триоксида серы.
- •2. Очистка отходящих газов.
- •3. Производство серной кислоты из сероводорода.
- •4. Основные направления совершенствования сернокислотного производства.
- •Лекция № 11 Электрохимические производства.
- •1. Общие сведения.
- •2. Теоретические основы электролиза.
- •3. Электролиз воды.
- •Лекция №12 Электролиз водного раствора хлорида натрия
- •Общие сведения.
- •2. Электрохимические процессы, протекающие при электролизе водного раствора хлорида натрия.
- •3. Промышленные электрохимические методы получения хлора.
- •4. Электролиз водных растворов хлоридов с применением стального катода.
- •4.1. Приготовление и очистка рассола.
- •4.2. Побочные процессы электролиза.
- •4.4. Технологическая схема производства водорода, хлора и щелочи.
- •4.5. Выпаривание электролитического щёлока.
- •5. Электролиз водного раствора хлорида натрия с ртутным катодом.
- •5.1. Физико-химические основы процесса.
- •5.2. Принципиальная схема электролиза с ртутным катодом.
- •Лекция №13 Производство хлористого водорода и соляной кислоты.
- •1. Свойства и применение хлористого водорода.
- •2. Способы производства хлористого водорода.
- •3. Теоретические основы синтеза хлористого водорода.
- •4. Абсорбция хлороводорода или получение соляной кислоты.
- •5. Схема получения хлороводорода и соляной кислоты.
- •6. Получение жидкого хлороводорода.
- •Лекция № 14 Химическая технология Получения нитрата аммония или аммиачной селитры
- •1. Общие сведения.
- •Физические свойства нитрата аммония.
- •1.2. Химические свойства нитрата аммония.
- •1.3. Технологические свойства.
- •1.4. Применение нитрата аммония.
- •1.5. Характеристика готового продукта.
- •2. Технология производства нитрата аммония.
- •2.1. Физико-химические основы процесса синтеза нитрата аммония.
- •2.2. Технологические схемы производства.
- •3. Техника безопасности в производстве аммиачной селитры.
- •Лекция № 15 Производство карбамида.
- •1. Общие вопросы.
- •1.1. Свойства карбамида.
- •1.2. Применение карбамида.
- •1.3. Сырьё.
- •2. Физико-химические основы процесса синтеза карбамида.
- •2.1. Химические уравнения и их анализ.
- •2.2. Оптимальный технологический режим процесса синтеза карбамида.
- •3. Промышленные схемы производства карбамида.
- •4. Технологическая схема производства карбамида с полным жидкостным рециклом и двухступенчатой дистилляцией плава.
- •5.Стриппинг-процесс.
- •Лекция №16 Производство кальцинированной соды или карбоната натрия.
- •Общие сведения.
- •2. Свойства и нахождение в природе карбоната натрия.
- •3. Получение кальцинированной соды по способу Леблана.
- •4.1. Химические реакции их анализ.
- •4.2. Основные операции (или стадии) производства кальцинированной соды.
- •4.3 Теоретические основы производства кальцинированной соды аммиачным способом.
- •4.4. Принципиальная технологическая схема производства кальцинированной соды по аммиачному способу
- •5. Получение гидрокарбоната натрия
- •Лекция № 17 производство гидроксида натрия или каустической соды химическим способом
- •1. Общие сведения.
- •2. Известковый способ производства гидроксида натрия
- •Химические реакции
- •Физико-химические основы процесса каустификации
- •Основные операции технологического процесса.
- •3.Ферритный способ производства гидроксида натрия.
- •3.1. Сырьё.
- •3.2. Химические реакции.
- •3.3. Основные стадии.
- •3.4. Расходные коэффициенты.
- •3.5. Совершенствование метода.
- •Элементы технологического расчёта реактора.
- •Список рекомендуемой литературы
- •Оглавление
- •650000, Кемерово, ул, Весенняя, 28.
- •650000, Кемерово, ул. Д.Бедного, 4а.
4.2. Побочные процессы электролиза.
Основные электрохимические процессы, протекающие на электродах, были рассмотрены выше.
Необходимо учесть следующие моменты, которые могут привести к нежелательным побочным реакциям.
- Потенциал разряда с течением времени изменяется и становится возможным разрядка на аноде ионов ОН- и молекул Н2О с образованием О2.
4ОН- – 4ē = О2 + 2Н2О φ 0 = + 0,40В
2Н2О – 4ē = О2 + 4Н+ φ 0 = +1,23В
- Выделяющийся на аноде хлор в растворе частично гидролизуется:
Cl2 + H2O = HCl + HClO.
- Если не принять мер против смешивания продуктов анодного и катодного пространств, то возможны следующие побочные реакции:
HClO + ОН- = H2O + ClO-
или
HClO + NaOH = NaOCl +H2O,
далее
2HClO + NaOCl = NaClO3 + 2HCl
2NaOCl = NaClO2 + NaCl
- В промышленности используются графитовые электроды, в том числе и аноды, которые могут принимать участие в химических реакциях. Выделяющийся на аноде кислород может реагировать с материалом анода:
2С + О2 = 2СО
2СО + О2 = 2СО2
При этом наблюдается разрушение анода.
Таким образом, вторичные реакции приводят к образованию нежелательных побочных веществ, непроизводительному расходу электроэнергии и разрушению анода.
- Кроме того, если не разделять анодное и катодное пространства, то смешивание хлора и водорода приводит к образованию взрывоопасных смесей (4 – 96% водорода в хлоре).
Итак, для того чтобы предотвратить образование вторичных продуктов и взрывоопасных смесей, необходимо отделять катодные продукты электролиза (Н2 и NaOH) от анодных (Cl2). Для этого в электролизёре устанавливают фильтрующую диафрагму.
На рис. 26 представлена схема диафрагменного электролизёра.
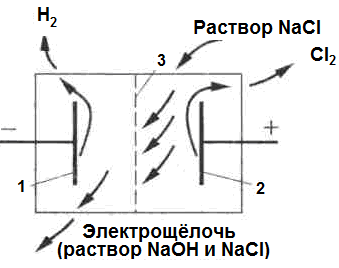
Рис. 26. Схема диафрагменного электролизёра.
1 – катод; 2 – анод; 3 – диафрагма.
4.3. Промышленный электролиз.
Напряжение разложения.
Теоретически потенциал разложения насыщенного водного раствора хлорида натрия с образованием Н2, NaOH и Cl2 равен:
Ет = φ 0а – φ 0к = 1,36 – (– 0,8) = + 2,18 В.
Фактически напряжение разложения всегда больше теоретического. В зависимости от условий процесса оно составляет (3,35 – 3,80) В.
Степень разложения хлорида натрия.
При электролизе водных растворов хлорида натрия только часть его превращается в NaOH. Не разложившаяся часть NaCl удаляется из электролизёра вместе с раствором NaOH. Этот раствор называют электролитическим щёлоком.
Отношение количества NaCl, превратившегося в NaOH, к количеству NaCl, поступившему в виде раствора на электролиз, называют степенью разложения хлорида натрия (α).
При нормальном режиме работы электролизёра с диафрагмой степень разложения хлорида натрия α = (45 – 55)%.
Выбор оптимальных условий электролиза.
Необходимо вести процесс так, чтобы уменьшить удельный расход электроэнергии, то есть расход на единицу получаемого продукта. Стремятся создать такие условия процесса, при которых достигается максимальный выход по току и минимальное рабочее напряжение.
О том, как снизить напряжение разложения рассматривалось ранее.
Для достижения высокого выхода по току необходимо следующее:
обеспечить как можно более полное разделение анодных и катодных продуктов электролиза, то есть предотвратить течение побочных реакций, для чего ставится фильтрующая диафрагма;
использовать растворы хлорида натрия концентрации близкой к насыщению (310 – 315 г/дм3), то есть, чем концентрированнее раствор, тем меньше растворимость хлора, кроме того, в концентрированных растворах затруднён перенос ОН--групп в анодное пространство, следовательно, тем меньше вероятность протекания побочных реакций;
целесообразно проведение процесса при высокой температуре электролита (85 – 97ºС), так как это снижает растворимость хлора в электролите и уменьшает проникновение ОН--групп в анодное пространство;
кроме того, как рассматривалось ранее, повышение температуры и повышение концентрации электролита уменьшает сопротивление электролита, что способствует уменьшению перенапряжения при разрядке ионов; для уменьшения перенапряжения необходимо подбирать материал электрода таким образом, чтобы оно было наименьшим для разрядки хлора на аноде и для разрядки водорода на катоде.
