
- •Химическая технология неорганических веществ. Основные производства
- •Химическая технология неорганических веществ. Основные производства
- •Предисловие
- •Лекции №1-2 получение синтетического аммиака
- •1. Общие сведения.
- •1.1.Свойства аммиака.
- •1.2. Значение и применение аммиака.
- •2.Физико-химические основы синтеза аммиака.
- •3. Технологическая схема синтеза аммиака при среднем давлении.
- •4. Основные направления развития производства аммиака.
- •Лекции №3-4 химия и технология азотной кислоты.
- •1.Общие сведения.
- •1.1.Физические свойства Диаграммы состояния.
- •1.2. Химические свойства.
- •1.4. Применение азотной кислоты.
- •1.5. Способы получения азотной кислоты.
- •2. Получение неконцентрированной азотной кислоты из аммиака (химические уравнения и стадии).
- •3. Физико-химические основы процесса окисления аммиака.
- •3.1. Химические уравнения процесса окисления аммиака и их анализ.
- •3.2. Выбор оптимальных условий процесса окисления аммиака.
- •3.2.1. Катализаторы процесса окисления аммиака.
- •3.2.2. Скорость окисления аммиака.
- •3.2.3. Определение оптимальной температуры.
- •3.2.4. Определение оптимального давления процесса.
- •3.2.5. Состав газовой смеси.
- •4. Физико-химические основы процесса окисления нитрозных газов (no в no2).
- •5. Физико-химические основы процесса поглощения оксидов азота водой.
- •6. Очистка отходящих газов.
- •Лекция № 5 Получение неконцентрированной азотной кислоты в промышленности.
- •1. Основные операции и принципиальная схема.
- •2. Технологические схемы производства неконцентрированной азотной кислоты.
- •3. Принципиальная технологическая схема получения неконцентрированной азотной кислоты под повышенным давлением
- •Лекция № 6 Получение концентрированной азотной кислоты.
- •1. Общая характеристика методов получения концентрированной азотной кислоты.
- •2. Получение концентрированной азотной кислоты из разбавленных растворов.
- •3. Прямой синтез концентрированной азотной кислоты.
- •3.2. Основные стадии.
- •3.3. Технологическая схема производства концентрированной азотной кислоты прямым синтезом.
- •Лекция № 7 Химическая технология серной кислоты
- •1. Общие сведения.
- •1.1 Значение и применение серной кислоты.
- •1.2 Свойства серной кислоты.
- •1.3 Сырьевые источники.
- •1.4. Промышленные сорта серной кислоты.
- •1.5. Способы получения серной кислоты.
- •2. Производство серной кислоты.
- •2.1. Основные стадии производства серной кислоты.
- •2.2. Получение диоксида серы so2.
- •3. Получение so2 из флотационного колчедана.
- •3.1. Основные стадии получения диоксида серы.
- •3.2. Физико-химические основы процесса обжига флотационного колчедана.
- •3.3. Очистка обжигового газа от пыли.
- •3.4. Специальная тонкая очистка печного газа
- •3.5. Осушка обжигового газа.
- •3.6. Принципиальная схема производства.
- •Лекция №8 Получение диоксида серы из серы.
- •Технологические свойства серы.
- •2. Теоретические основы горения серы.
- •3. Схема установки для сжигания серы в распылённом состоянии.
- •3.6. Схема производства серной кислоты из серы.
- •Лекция № 9 физико-химические основы Контактного окисления диоксида серы
- •Анализ химического уравнения.
- •Выражение для константы равновесия.
- •Кинетическое уравнение.
- •4. Выбор оптимальных условий ведения процесса.
- •4.1. Влияние состава исходной газовой смеси.
- •4.2. Влияние температуры.
- •4.3. Влияние давления.
- •4.4. Катализаторы
- •Лекция №10 абсорбция. Очистка отходящих газов. Производство серной кислоты из сероводорода
- •1. Абсорбция триоксида серы.
- •2. Очистка отходящих газов.
- •3. Производство серной кислоты из сероводорода.
- •4. Основные направления совершенствования сернокислотного производства.
- •Лекция № 11 Электрохимические производства.
- •1. Общие сведения.
- •2. Теоретические основы электролиза.
- •3. Электролиз воды.
- •Лекция №12 Электролиз водного раствора хлорида натрия
- •Общие сведения.
- •2. Электрохимические процессы, протекающие при электролизе водного раствора хлорида натрия.
- •3. Промышленные электрохимические методы получения хлора.
- •4. Электролиз водных растворов хлоридов с применением стального катода.
- •4.1. Приготовление и очистка рассола.
- •4.2. Побочные процессы электролиза.
- •4.4. Технологическая схема производства водорода, хлора и щелочи.
- •4.5. Выпаривание электролитического щёлока.
- •5. Электролиз водного раствора хлорида натрия с ртутным катодом.
- •5.1. Физико-химические основы процесса.
- •5.2. Принципиальная схема электролиза с ртутным катодом.
- •Лекция №13 Производство хлористого водорода и соляной кислоты.
- •1. Свойства и применение хлористого водорода.
- •2. Способы производства хлористого водорода.
- •3. Теоретические основы синтеза хлористого водорода.
- •4. Абсорбция хлороводорода или получение соляной кислоты.
- •5. Схема получения хлороводорода и соляной кислоты.
- •6. Получение жидкого хлороводорода.
- •Лекция № 14 Химическая технология Получения нитрата аммония или аммиачной селитры
- •1. Общие сведения.
- •Физические свойства нитрата аммония.
- •1.2. Химические свойства нитрата аммония.
- •1.3. Технологические свойства.
- •1.4. Применение нитрата аммония.
- •1.5. Характеристика готового продукта.
- •2. Технология производства нитрата аммония.
- •2.1. Физико-химические основы процесса синтеза нитрата аммония.
- •2.2. Технологические схемы производства.
- •3. Техника безопасности в производстве аммиачной селитры.
- •Лекция № 15 Производство карбамида.
- •1. Общие вопросы.
- •1.1. Свойства карбамида.
- •1.2. Применение карбамида.
- •1.3. Сырьё.
- •2. Физико-химические основы процесса синтеза карбамида.
- •2.1. Химические уравнения и их анализ.
- •2.2. Оптимальный технологический режим процесса синтеза карбамида.
- •3. Промышленные схемы производства карбамида.
- •4. Технологическая схема производства карбамида с полным жидкостным рециклом и двухступенчатой дистилляцией плава.
- •5.Стриппинг-процесс.
- •Лекция №16 Производство кальцинированной соды или карбоната натрия.
- •Общие сведения.
- •2. Свойства и нахождение в природе карбоната натрия.
- •3. Получение кальцинированной соды по способу Леблана.
- •4.1. Химические реакции их анализ.
- •4.2. Основные операции (или стадии) производства кальцинированной соды.
- •4.3 Теоретические основы производства кальцинированной соды аммиачным способом.
- •4.4. Принципиальная технологическая схема производства кальцинированной соды по аммиачному способу
- •5. Получение гидрокарбоната натрия
- •Лекция № 17 производство гидроксида натрия или каустической соды химическим способом
- •1. Общие сведения.
- •2. Известковый способ производства гидроксида натрия
- •Химические реакции
- •Физико-химические основы процесса каустификации
- •Основные операции технологического процесса.
- •3.Ферритный способ производства гидроксида натрия.
- •3.1. Сырьё.
- •3.2. Химические реакции.
- •3.3. Основные стадии.
- •3.4. Расходные коэффициенты.
- •3.5. Совершенствование метода.
- •Элементы технологического расчёта реактора.
- •Список рекомендуемой литературы
- •Оглавление
- •650000, Кемерово, ул, Весенняя, 28.
- •650000, Кемерово, ул. Д.Бедного, 4а.
Лекция № 7 Химическая технология серной кислоты
Вопросы.
1.Общие сведения.
1.1. Значение и применение серной кислоты.
1.2. Свойства серной кислоты.
1.3. Сырьевые источники.
1.4. Промышленные сорта серной кислоты.
1.5. Способы получения серной кислоты.
2. Производство серной кислоты.
2.1. Основные стадии производства серной кислоты.
2.2. Получение диоксида серы SO2.
3. Получение SO2 из флотационного колчедана.
3.1. Основные стадии получения диоксида серы..
3.2. Физико-химические основы обжига пирита.
3.3. Очистка обжигового газа от пыли.
3.4. Специальная (тонкая) очистка обжигового газа.
3.5. Осушка газа.
3.6. Принципиальная схема производства.
1. Общие сведения.
1.1 Значение и применение серной кислоты.
Серная кислота – это один из самых крупнотоннажных продуктов промышленного производства. Серной кислоты получают больше, чем азотной, соляной, уксусной и других кислот вместе взятых.
Во всём мире более полутора тысяч установок серной кислоты и производят они около 160 млн. т серной кислоты.
Серная кислота применяется практически во всех отраслях промышленности. Наибольшее её количество расходуется на следующие производства:
минеральные удобрения (40 – 50%)
взрывчатые вещества
минеральные кислоты и соли.
Она применяется:
для очистки нефтепродуктов
в металлообработке
в производстве органических соединений
красителей
химических волокон и т.д.
Крупными производителями серной кислоты являются Япония и Германия.
1.2 Свойства серной кислоты.
Большое разнообразие областей применения связано с комплексом её свойств. Серная кислота самая дешевая из кислот, она не дымит, не имеет запаха. При обычных условиях это жидкость. В концентрированном состоянии она не способна разрушать черные металлы, что удобно для её использования и транспортировки.
В технике под «серной кислотой» подразумеваются любые смеси триоксида серы с водой:
mSO3 + nH2O = H2SO4.
При m = n = 1 получается моногидрат, или 100%-я H2SO4 (плотность 1850 т/м3 или 1,85 г/см3 или 1850 кг/дм3).
Если m < n, то образуется разбавленная серная кислота,
если m > n, то – олеум.
Изучите диаграммы состояния «состав – свойства» (Рис. 15 и 16).
На рисунке (Рис.15) представлена диаграмма кристаллизации системы H2O – SO3.
Часть диаграммы (слева) представляет зависимость температуры кристаллизации серной кислоты от её концентрации, другая часть (справа) представляет зависимость температуры кристаллизации олеума от содержания в нём триоксида серы.
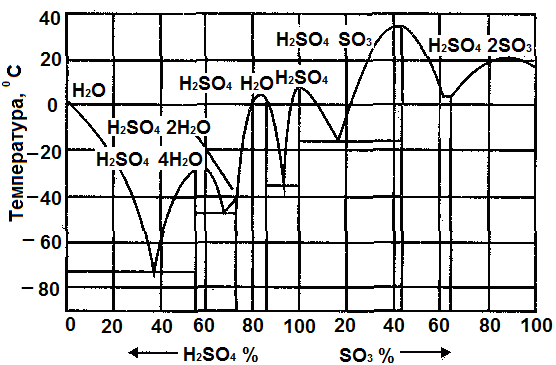
Рис.15. Диаграмма кристаллизации системы H2O – SO3
Из рисунка видно, что на кривой имеется несколько экстремумов. Наличие максимумов свидетельствует о том, что с водой триоксид серы образует ряд соединений. Каждая максимальная точка соответствуют определённому соединению. Точки минимумов показывают, при каком соотношении H2O и SO3 имеет место минимальная температура замерзания смеси.
С учётом этих данных товарные сорта серной кислоты и олеума производят в виде эвтектических смесей, имеющих меньшую температуру кристаллизации. Благодаря этому уменьшается вероятность замерзания готового продукта при снижении температуры в условиях производства, хранения и транспортировки.
Чтобы уменьшить возможность кристаллизации серной кислоты при перевозке и хранении, товарные сорта должны иметь такую концентрацию, которая соответствует достаточно низкой температуре её кристаллизации (левая часть диаграммы). Так, башенная кислота (75% H2SO4) имеет температуру замерзания (–41ºС), а контактная кислота (92,5% H2SO4) имеет температуру замерзания (–35 ºС).
Аналогично выбирают товарные сорта олеума (правая часть диаграммы). Так 20%-й олеум имеет температуру кристаллизации (–11ºС), а 65%-й олеум имеет (–0,35ºС).
Эти данные имеют большое практическое значение, так как во многих процессах и в производстве самой серной кислоты используется серная кислота различной концентрации. Кроме того, необходимо учитывать, что поскольку оборудование цехов в большинстве случаев размещено на открытой площадке, имеется опасность кристаллизации серной кислоты.
Температура кипения серной кислоты также зависит от её концентрации. На рисунке (Рис. 16) представлена диаграмма кипения раствора серной кислоты (левая часть диаграммы) и олеума (правая часть диаграммы).
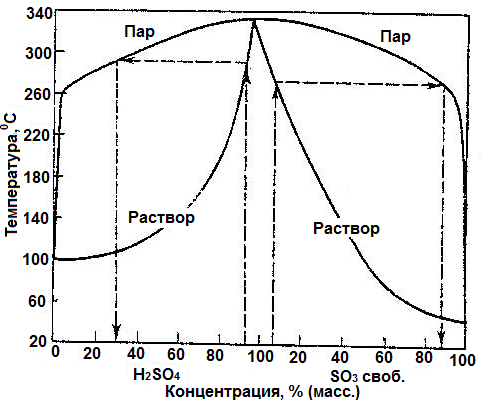
Рис.16 Диаграмма кипения раствора серной кислоты и олеума
Из рисунка видно, что смесь, содержащая 98,3% H2SO4, является азеотропной (состав её жидкой и паровой фаз одинаковый). При небольших отклонениях концентрации серной кислоты от азеотропной точки, состав её жидкой и газовой фаз значительно отличается.
Серная кислота является сильным окислителем.
Концентрированная и разбавленная кислоты с металлами взаимодействует по-разному.
Концентрированная серная кислота пассивирует некоторые металлы.
При повышенных температурах пары серной кислоты диссоциируют
H2SO4 ↔ SO3 + Н2О,
а выше 400 ºС диссоциация почти полная.
При дальнейшем нагревании триоксид серы разлагается по реакции
2SO3 → 2SO2 + O2,
а при температуре выше 1000 ºС – почти полностью, что используется для получения серной кислоты из отработанной.
