
- •Тема: гідроген
- •Проста речовина
- •Лабораторна робота № 1 одержання та властивості гідрогену.
- •Контрольні питання
- •Тема: лужні метали
- •Лабораторна робота № 2 властивості лужних металів та їх сполук.
- •Контрольні питання
- •Тема: елементи іі-а групи
- •Лабораторна робота № 3 властивості магнію, лужноземельних металів та їх сполук
- •Лабораторна робота № 4 визначення жорсткості води.
- •Контрольні питання
- •Тема: елементи ііі – а групи
- •Лабораторна робота № 5 властивості алюмінію та його сполук.
- •Контрольні питання
- •Тема: елементи іv – а групи
- •Лабораторна робота № 6 властивості карбону, силіцію та їх сполук.
- •Контрольні питання
- •Лабораторна робота № 7 властивості стануму, плюмбуму та їх сполук.
- •Контрольні питання
- •Тема: елементи V – а групи
- •Лабораторна робота № 8 властивості нітрогену, фосфору та їх сполук.
- •Контрольні питання
- •Лабораторна робота № 9 розпізнавання нітратних та фосфорних добрив.
- •Контрольні питання
- •Тема: халькогени
- •Лабораторна робота № 10 властивості сульфуру та її сполук.
- •Контрольні питання
- •Тема: галогени
- •Лабораторна робота № 11 одержання та властивості галогенів.
- •Контрольні питання.
- •Лабораторна робота № 12 властивості галогеноводневих кислот. Якісні реакції на галоген-іони.
- •Контрольні питання.
- •Тема: елементи підгрупи хрому
- •Лабораторна робота № 13 властивості хрому та його сполук
- •Контрольні питання.
- •Тема: елементи підгрупи мангану
- •Лабораторна робота № 14 властивості мангану та його сполук
- •Контрольні питання
- •Тема: елементи родини феруму
- •Лабораторна робота № 15 властивості феруму та його сполук
- •Контрольні питання.
- •Тема: елементи підгрупи купруму
- •Лабораторна робота № 16 властивості купруму та його сполук
- •Контрольні питання.
- •Тема: елементи підгрупи цинку
- •Лабораторна робота № 17 властивості цинку та його сполук. Визначення іонів ртуті
- •Контрольні питання
- •Список рекомендованої літератури
Контрольні питання
Які сполуки нітрогену, фосфору використовуються у якості мінеральних добрив?
________________________________________________________________________________________________________________________________________
У вигляді яких іонів нітроген потрапляє до рослин?
____________________________________________________________________
Чому суперфосфат не повністю розчиняється у воді?
________________________________________________________________________________________________________________________________________
Суперфосфат не можна змішувати з вапном. Чому? Відповідь підтвердить рівнянням реакції.
________________________________________________________________________________________________________________________________________
Чому фосфорити як добрива використовують лише для кислих ґрунтів?
____________________________________________________________________
Назвіть, які добрива називають комплексними?
________________________________________________________________________________________________________________________________________
Тема: халькогени
-
R (A)
I1, эВ
Еа, эВ
Ступені окислення
O
0.60
13.6
1.467
-1, -2
S
0.90
10.4
2.077
-2, 0, +2,+4,+6
Se
1.16
9.75
2.02
-“-
Te
1.35
9.1
2.0
-“-
Po
1.64
8.43
0, +2, +4
До елементів VІ А групи належать Оксиген, Сульфур, селен, телур та радіоактивний полоній. Групова назва цих елементів - халькогени, тобто "що народжують мідні руди", обумовлено тим, що у природі вони зустрічаються частіше у вигляді сполук Купруму (сульфідів, оксидів, селенідів). Атоми халькогенів мають електронну конфігурацію s2p4 з двома неспареними р-електронами.
При переході від Оксигену до полонію розмір атомів та їх можливі координаційні числа зростають, а енергія іонізації (Еіон) та електронегативність зменшуються. В сполуках Сульфуру, селену, телуру з Оксигеном і галогенами реалізуються ступені окислення +6, +4 і +2. З більшістю інших елементів вони утворюють халькогеніди, де находяться в ступені окислення -2. Стійкість сполук з вищим ступенем окислення зменшується від телуру до полонію. В сполуках з негативними ступенями окислення від Сульфуру до телуру зростають відновні, а в сполуках з позитивними ступенями окислення – окисні властивості.
Одне з характерних властивостей атомів халькогенів - їх здатність зв’язуватися один з одним у кільця та ланцюги. Це явище називають катенацією, яка яскраво спостерігається у Сульфуру, селену и телуру. Для них відомі багаточислені лінійні та циклічні молекулярні форми, утворені ланцюгами. З катенацією зв’язані алотропія і поліморфізм простих речовин.
В ідомо
декілька поліморфних модифікацій
Сульфуру: ромбічна (<960С),
моноклінна (96-1190С),
пластична. Остання нестійка і при
зберіганні поступово переходить до
ромбічної модифікації. Алотропія
Сульфуру обумовлена не різним числом
атомів в молекулі, як у Оксигену, а різною
будовою восьмиатомних молекул. По мірі
нагрівання кільця розриваються і
утворюються молекули з відкритим
ланцюгом атомів.
ідомо
декілька поліморфних модифікацій
Сульфуру: ромбічна (<960С),
моноклінна (96-1190С),
пластична. Остання нестійка і при
зберіганні поступово переходить до
ромбічної модифікації. Алотропія
Сульфуру обумовлена не різним числом
атомів в молекулі, як у Оксигену, а різною
будовою восьмиатомних молекул. По мірі
нагрівання кільця розриваються і
утворюються молекули з відкритим
ланцюгом атомів.
Стабільність водневих сполук халькогенів зменшується в групі. Сірководень можливо отримати як і решту халькогеноводнів за реакцією: FeЭ + H2SO4 ® FeSO4 + Н2Э
Халькогеноводні – слабкі кислоти, сила яких зростає у групі. Вони виявляють відновні властивості. Сірководень горить на повітрі:
H2S + O2® H2O + SO2
Сірководень утворює кислі та середні солі. Більшість сульфідів нерозчинні у воді за виключенням сульфідів лужних металів та амонію.
Сульфур реагує з флуором: S + F2 ® SF6; (SF4 , S2F10). З Хлором утворюються лише низькі хлориди і оксихлориди: S2Cl2, SCl2. Селен та телур утворюють ЭГ4 - галогенангідриди, які з солями лужних металів утворюють комплекси K[SeF5], K2[SeCl6], Cs2[TeI6].
Оксид Сульфуру (ІV) отримують в лабораторіях за реакцією:
Na2SO3 + 2HCl = SO2 + 2NaCl + H2O
При розчиненні утворює сульфітну кислоту (Н2SO3). Вона нестійка, існує лише у водних розчинах, утворює солі – гідросільфіти і сульфіти. Сірчиста кислота досить активний відновник, який окислюється у розчинах Хлору, перманганату, біхромату калію. В результаті окислення утворюється сульфатна кислота. Проте, при взаємодії з більш активними відновниками виявляє окисні властивості.
Н2SO3 + 2Н2S = 3S + 3H2O
Оксид Сульфуру (VІ) жадібно з’єднуються з водою, розчиняючись утворює сульфатну кислоту (Н2SO4). Пари триоксиду Сульфуру не можуть безпосередньо поглинатися водою в наслідок високого парціального тиску останньої і утворює туман, який не конденсується. Проте, пари SO3 повністю поглинаються концентрованою сірчаною кислотою. Оксид Сульфуру (VІ) та сульфатна кислота сильні окисники. З розведеної кислоти, метали, що стоять в ряду напруг до Гідрогену, витісняють Гідроген. Концентрована сульфатна кислота при нагріванні окислює практично всі метали, відновлюючись до оксиду Сульфуру (ІV), або вільної Сульфуру чи сірководню.
Cu + 2H2SO4 = SO2 + CuSO4 + 2H2O
3Zn +4H2SO4 = S + 3ZnSO4 + 4H2O
4Zn +5H2SO4 = H2S + 4ZnSO4 + 4H2O
С![]() ульфатна
кислота утворює нормальні солі –
сульфати
та кислі солі – гідросульфати.
ульфатна
кислота утворює нормальні солі –
сульфати
та кислі солі – гідросульфати.
П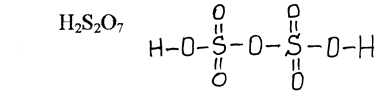 ри
умовному заміщенні в сірчаній кислоті
або її солях одного атома Оксигену на
атом Сульфуру утворюється відповідно
тіосульфатна
кислота
(H2S2O3)
та її солі тіосульфати.
Останні можуть бути отримані кип’ятінням
розчинів сульфітів з сіркою. За дії
сильних окисників (Хлору) тіосульфати
окислюються до сульфатної кислоти.
Сульфур входить до складу піросульфатної
кислоти
(H2S2O7),
яка утворює солі – піросульфати
та надсульфатної
кислоти
(H2S2O8),
яка утворює солі – персульфати.
Над сульфатна кислота містить пероксидний
ланцюг, що обумовлює її сильні окисні
властивості. Солі піросульфатної та
надсульфатної кислот також є сильними
окисниками.
ри
умовному заміщенні в сірчаній кислоті
або її солях одного атома Оксигену на
атом Сульфуру утворюється відповідно
тіосульфатна
кислота
(H2S2O3)
та її солі тіосульфати.
Останні можуть бути отримані кип’ятінням
розчинів сульфітів з сіркою. За дії
сильних окисників (Хлору) тіосульфати
окислюються до сульфатної кислоти.
Сульфур входить до складу піросульфатної
кислоти
(H2S2O7),
яка утворює солі – піросульфати
та надсульфатної
кислоти
(H2S2O8),
яка утворює солі – персульфати.
Над сульфатна кислота містить пероксидний
ланцюг, що обумовлює її сильні окисні
властивості. Солі піросульфатної та
надсульфатної кислот також є сильними
окисниками.
