
- •Тема: гідроген
- •Проста речовина
- •Лабораторна робота № 1 одержання та властивості гідрогену.
- •Контрольні питання
- •Тема: лужні метали
- •Лабораторна робота № 2 властивості лужних металів та їх сполук.
- •Контрольні питання
- •Тема: елементи іі-а групи
- •Лабораторна робота № 3 властивості магнію, лужноземельних металів та їх сполук
- •Лабораторна робота № 4 визначення жорсткості води.
- •Контрольні питання
- •Тема: елементи ііі – а групи
- •Лабораторна робота № 5 властивості алюмінію та його сполук.
- •Контрольні питання
- •Тема: елементи іv – а групи
- •Лабораторна робота № 6 властивості карбону, силіцію та їх сполук.
- •Контрольні питання
- •Лабораторна робота № 7 властивості стануму, плюмбуму та їх сполук.
- •Контрольні питання
- •Тема: елементи V – а групи
- •Лабораторна робота № 8 властивості нітрогену, фосфору та їх сполук.
- •Контрольні питання
- •Лабораторна робота № 9 розпізнавання нітратних та фосфорних добрив.
- •Контрольні питання
- •Тема: халькогени
- •Лабораторна робота № 10 властивості сульфуру та її сполук.
- •Контрольні питання
- •Тема: галогени
- •Лабораторна робота № 11 одержання та властивості галогенів.
- •Контрольні питання.
- •Лабораторна робота № 12 властивості галогеноводневих кислот. Якісні реакції на галоген-іони.
- •Контрольні питання.
- •Тема: елементи підгрупи хрому
- •Лабораторна робота № 13 властивості хрому та його сполук
- •Контрольні питання.
- •Тема: елементи підгрупи мангану
- •Лабораторна робота № 14 властивості мангану та його сполук
- •Контрольні питання
- •Тема: елементи родини феруму
- •Лабораторна робота № 15 властивості феруму та його сполук
- •Контрольні питання.
- •Тема: елементи підгрупи купруму
- •Лабораторна робота № 16 властивості купруму та його сполук
- •Контрольні питання.
- •Тема: елементи підгрупи цинку
- •Лабораторна робота № 17 властивості цинку та його сполук. Визначення іонів ртуті
- •Контрольні питання
- •Список рекомендованої літератури
Лабораторна робота № 8 властивості нітрогену, фосфору та їх сполук.
Мета роботи: отримання та дослідження властивостей водневих та кисневих сполук Нітрогену та фосфору.
Прилади та реактиви. Спиртівка або сухе пальне, пробірки, скляна паличка, мікрошпатель, пробка, газовідвідна трубка, штатив, тигель. Лакмусовий папір. Кусочки Цинку, Купруму. Нітрат калію, сульфат амонію, гашене вапно, червоний фосфор. Розчини: конц. хлороводневої кислоти, конц. та розведена нітратна кислота, сульфатна кислота, бромної води, перманганату, біхромату, йодиду калію, молібдату Амонію, дигідрофосфату, гідрофосфату, фосфату Натрію.
Техніка безпеки. Всі досліди, що супроводжуються виділенням аміаку і оксидів Нітрогену, проводити під тягою. Всі солі нітрітної кислоти отруйні, тому не допускати попадання на слизові оболонки. Не допускати попадання на шкіру концентрованої нітратної кислоти, у разі необхідності змити великою кількістю води та протерте розчином гідрокарбонату Натрію місце обпіку.
ДОСЛІД 1. Отримання аміаку, його взаємодія з водою та хлороводневої кислотою
Помістити до фарфорового тиглю 3-4 мікрошпателю сульфату амонію і гашене вапно. Скляною паличкою ретельно перемішати суміш та невелику її кількість перенести до пробірки (близько ½ об’єму). Пробірку закріпити у штативі та закрити газовідвідною трубкою, кінець якої опустити до конічної пробірки з водою (див. малюнок). Суміш нагріваємо 3-5 хв., пропускаючи аміак крізь воду, після чого пробірку з отриманим розчином залишити, закрити пробкою і зберігати до наступного досліду. Піднести до отвору газовідвідної трубки скляну паличку змочену концентрованою хлороводневою кислотою та вологий лакмусовий папір. Перевірити лакмусовим папером реакцію середовища розчину аміаку у воді.
З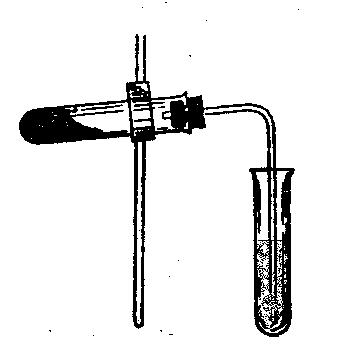 авдання.
авдання.
Описати явища, що спостерігаються;
написати рівняння реакцій отримання аміаку:
____________________________________________ взаємодії аміаку з хлороводневою кислотою:
____________________________________________________________________ взаємодії аміаку з водою: ______________________________________________
ДОСЛІД 2. Відновні властивості аміаку
В три пробірки внести розрізнено 3-4 краплі розчинів: а) бромної води, б) перманганату калію, в) біхромату калію. До кожної пробірки додати 3-5 крапель 25%-го розчину аміаку та підігріти.
Завдання.
Написати рівняння відповідних реакцій, враховуючи, що аміак в основному окислюється до вільного Нітрогену, перманганат калію відновлюється до оксиду мангану (ІV), біхромат калію до оксиду хрому (ІІІ). Відмітити зміну забарвлення розчинів.
а)___________________________________________________________________б)___________________________________________________________________в)___________________________________________________________________
ДОСЛІД 3. Дія нітратної кислоти на метали
3.1. Дія концентрованої нітратної кислоти на метали.
До одної пробірки внести кусочок цинку, до другої пробірки – купруму. Додати 3-5 крапель концентрованої нітратної кислоти. За забарвленням визначити газ, що виділяється.
________________________________________________________________________________________________________________________________________
3.2. Дія дуже розведеної нітратної кислоти на метали.
До одної пробірки внести кусочок цинку, до другої пробірки – купруму. Додати 3-5 крапель дуже розведеної нітратної кислоти (0,5 н). Струшувати рідину декілька хвилин, потім злити розчини та довести наявність у розчині іонів амонію за реакцією з гідроксидом натрію.
Завдання.
Написати рівняння відповідних реакцій, що відбуваються.
________________________________________________________________________________________________________________________________________Зробити висновок про особливості взаємодії нітратної кислоти з металами.
________________________________________________________________________________________________________________________________________
ДОСЛІД 4. Окисно-відновні властивості нітритів
До трьох пробірок внести 3-4 краплі розчинів: йодиду калію, перманганату калію, біхромату калію, відповідно. В усі три пробірки додати 2 н розчин сульфатної кислоти та 4-5 крапель розчину нітриту калію.
Завдання.
Написати рівняння реакцій враховуючи, що в першій пробірці нітрит калію відновлюється до монооксиду нітрогену,
____________________________________________________________________у другій – перманганат калію переходить до сульфату мангану (ІІ),
____________________________________________________________________у третій – біхромат калію – до сульфату хрому (ІІІ).
____________________________________________________________________ В яких випадках нітрит калію виявляється відновником або окисником?
____________________________________________________________________
ДОСЛІД 5. Термічне розкладення нітрату калію
До пробірки внести декілька кристалів нітрату калію та прожарити пробірку до розплавлення солі та виділення бульбашок газу. Продовжувати нагрівання до зупинки виділення бульбашок. Довести утворення нітриту з нітрату. Для цього розчинити сухий залишок у воді та додати розчин йодиду калію або перманганату калію, які підкислені 2 н сірчаною кислотою.
Завдання.
Написати рівняння реакцій. Який газ виділяється при розкладенні нітрату калію?
____________________________________________________________________
ДОСЛІД 6. Отримання ортофосфосфатної кислоти
Внести мікрошпатель червоного фосфору до пробірки та додати 3-5 крапель конц. нітратної кислоти. Пробірку закріпити у штативі нахиливши та підігріти до початку появи бульбашок газу. Після охолодження пробірки провести якісну реакцію на фосфат-іон. Для чого до чистої пробірки внести 5-6 крапель насиченого розчину молібдату амонію підкисленого нітратною кислотою і додати до нього краплю отриманого у досліді розчину. Пробірку нагріти на водяній бані. Випадіння жовтого осаду підтверджує отримання ортофосфорної кислоти.
Завдання.
Написати реакцію утворення ортофосфосфатної кислоти, враховуючи, що виділяється оксид нітрогену(ІІ).
____________________________________________________________________
ДОСЛІД 7. Гідроліз солей ортофосфорної кислоти
На універсальний індикаторний папір нанести краплину розчинів дигідрофосфату натрію, гідрофосфату натрію, фосфату натрію.
Завдання.
Визначити рН цих розчинів за зміною кольору індикаторного паперу. Скласти рівняння гідролізу солей. Зробити висновок про силу фосфорної кислоти.
____________________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________
