
- •Тема: гідроген
- •Проста речовина
- •Лабораторна робота № 1 одержання та властивості гідрогену.
- •Контрольні питання
- •Тема: лужні метали
- •Лабораторна робота № 2 властивості лужних металів та їх сполук.
- •Контрольні питання
- •Тема: елементи іі-а групи
- •Лабораторна робота № 3 властивості магнію, лужноземельних металів та їх сполук
- •Лабораторна робота № 4 визначення жорсткості води.
- •Контрольні питання
- •Тема: елементи ііі – а групи
- •Лабораторна робота № 5 властивості алюмінію та його сполук.
- •Контрольні питання
- •Тема: елементи іv – а групи
- •Лабораторна робота № 6 властивості карбону, силіцію та їх сполук.
- •Контрольні питання
- •Лабораторна робота № 7 властивості стануму, плюмбуму та їх сполук.
- •Контрольні питання
- •Тема: елементи V – а групи
- •Лабораторна робота № 8 властивості нітрогену, фосфору та їх сполук.
- •Контрольні питання
- •Лабораторна робота № 9 розпізнавання нітратних та фосфорних добрив.
- •Контрольні питання
- •Тема: халькогени
- •Лабораторна робота № 10 властивості сульфуру та її сполук.
- •Контрольні питання
- •Тема: галогени
- •Лабораторна робота № 11 одержання та властивості галогенів.
- •Контрольні питання.
- •Лабораторна робота № 12 властивості галогеноводневих кислот. Якісні реакції на галоген-іони.
- •Контрольні питання.
- •Тема: елементи підгрупи хрому
- •Лабораторна робота № 13 властивості хрому та його сполук
- •Контрольні питання.
- •Тема: елементи підгрупи мангану
- •Лабораторна робота № 14 властивості мангану та його сполук
- •Контрольні питання
- •Тема: елементи родини феруму
- •Лабораторна робота № 15 властивості феруму та його сполук
- •Контрольні питання.
- •Тема: елементи підгрупи купруму
- •Лабораторна робота № 16 властивості купруму та його сполук
- •Контрольні питання.
- •Тема: елементи підгрупи цинку
- •Лабораторна робота № 17 властивості цинку та його сполук. Визначення іонів ртуті
- •Контрольні питання
- •Список рекомендованої літератури
МІНІСТЕРСТВО АГРАРНОЇ ПОЛІТИКИ УКРАЇНИ
ТАВРІЙСЬКИЙ ДЕРЖАВНИЙ АГРОТЕХНОЛОГІЧНИЙ УНІВЕРСИТЕТ
КАФЕДРА ЗАГАЛЬНОГО ЗЕМЛЕРОБСТВА

РОБОЧИЙ ЗОШИТ
ДО ЛАБОРАТОРНИХ ЗАНЯТЬ З КУРСУ
„ХІМІЯ З ОСНОВАМИ БІОГЕОХІМІЇ”
Частина 2
для студентів денного відділення
спеціальності 6.070.800
„Екологія та охорона навколишнього середовища”
МЕЛІТОПОЛЬ – 2011
Укладач: доцент, к.с.г.н. КОЛЕСНІКОВ М.О.
Рецензенти: д.с.г.н., доцент Данченко О.О.
(Мелітопольський державний педагогічний університет,
кафедра неорганічної хімії та хімічної технології)
Відповідальний за випуск: проф., д.с.г.н. Калитка В.В.
Розглянуто та схвалено на засіданні кафедри загального землеробства.
Протокол № ___ від „___” _________ 2011 року.
Розглянуто та рекомендовано до друку методичною комісією факультету агротехнології та екології ТДАТУ.
Протокол № ___ від „___” _________ 2011 року.
© ТДАТУ, 2011
ВСТУП
Неорганічна хімія – це наука, що вивчає хімічні елементи, їх сполуки та властивості. Головна задача курсу неорганічної хімії: вивчення будови неорганічних сполук, встановлення зв’язку їх будови з властивостями та реакційною здатністю, засвоєння основних методів та прийомів проведення хімічного експерименту.
Для формування у майбутніх спеціалістів природничого профілю системи знань про основні закономірності взаємодії між живою речовиною та інертною матерією Землі, особливості міграції та розподілу хімічних елементів в біосфері особливе значення має така навчальна дисципліна як „Біогеохімія”. Основна мета вивчення біогеохімії – оволодіння її теоретичними основами та формування навичок оцінювання ролі живих організмів в процесі формування ґрунтів та при виробництві аграрної продукції.
Даний робочий зошит призначений для допомоги студентам при самостійній підготовці до заняття і виконанні лабораторних робіт з курсу хімії з основами БГХ. Загалом, представлений матеріал сприяє засвоєнню студентами загальних закономірностей хімічних явищ, розвитку у них хімічного мислення.
Робочий зошит складено у відповідності до програм з курсу «Хімія з основами біогеохімії» для студентів аграрних ВНЗ ІІІ – ІV рівнів акредитації за спеціальністю 6.070.800 „Екологія та охорона навколишнього середовища”. Матеріал викладено за темами. Кожна тема містить теоретичне введення, мету лабораторної роботи, техніку безпеки при її виконанні, опис дослідів, контрольні питання і задачі. До кожного досліду наведено завдання для виконання в аудиторії. Відповіді на контрольні питання студенти надають заздалегідь при підготовці до заняття.
В результаті проведення лабораторних занять студенти повинні уміти:
сформулювати мету експерименту;
провести хімічний експеримент;
провести спостереження, пояснити їх та зробити обґрунтовані висновки;
записати рівняння реакцій проведених дослідів;
використати знання і навички, отримані на лабораторних заняттях для рішення дослідницьких задач в курсах суміжних хімічних та біологічних дисциплін.
Тема: гідроген
![]()
Атом Гідрогену в порівнянні з іншими атомами елементів найбільш простий за структурою: 1s1. Основна особливість атома Гідрогену полягає в тому, що на відміну від всіх інших елементів (крім гелію) його валентний електрон знаходиться безпосередньо в сфері дії атомного ядра - у нього немає проміжного електронного шару. Позитивний іон Гідрогену Н+ представляє собою елементарну частку - протон.
Енергія іонізації атома Гідрогену (13,6 еВ, 1312 кДж/моль) досить велика, тому сполуки Гідрогену (I) навіть з такими сильними окисниками, як флуор і Оксиген, не можуть бути іонними. Специфіка будови атома Гідрогену обумовлює особливий, притаманний тільки сполукам Гідрогену (I) вид хімічного зв’язку - водневий зв’язок.
Процес утворення негативного іона H- з атома екзотермічний, тому для Гідрогену в ступеню окислення -1 можливі іонні сполуки.
Таким чином, Гідроген - неметалічний елемент. В сполуках він може мати ступені окислення -1 и +1. Для нього, як і для галогенів, характерні іонні сполуки, в яких він виступає в якості простого аніона H-. При позитивному ступеню окислення Гідроген утворює лише ковалентні сполуки і може грати роль комплексоутворювача в аніонних комплексах.
Гідроген має три ізотопу с масовими числами відповідно 1, 2 и 3:
----1H -----------------2D(2H)----------------------3T(3H)
-----p(e)----------------(p+n)e-----------------------(p+2n)e
----протій-------------дейтерій---------------------тритій
Протій и дейтерій - стабільні ізотопи. Нормальний ізотопний склад природних сполук Гідрогену відповідає відношенню D : H = 1 : 6800 (за числом атомів).
Проста речовина
Маючи один електрон, Гідроген утворює лише двохатомні молекули. При цьому можливі молекули легкого Гідрогену - протію H2, важкого Гідрогену - дейтерію D2, тритію T2.
Молекули Гідрогену характеризуються великою міцністю та малою поляризуємістю незначними розмірами і малою масою, а відтоді, і більшою рухомістю. Тому у Гідрогену дуже низькі температури плавлення (-259,1оС) и кипіння (-252,6оС); він поступається в цьому відношенні лише гелію. В зв’язку з високою енергією дисоціації (435 кДж/моль) розпад молекул H2 на атоми відбувається лише при температурі вище 2000оС.
Гідроген проявляє і відновні, і окисні властивості. За звичайних умов, завдяки, міцність молекул він відносно малоактивний і безпосередньо взаємодіє лише зі флуором. При нагріванні вступає у взаємодію з багатьма неметалами - Хлором, бромом, Оксигеном та ін. Відновні здатності Гідрогену використовуються для отримання деяких простих речовин з оксидів і галідів:
CuO + H2 = Cu + H2O
В якості окисника Гідроген взаємодіє з активними металами:
2Na + H2 = 2NaH
Отримання Гідрогену
В промисловості Гідроген отримують в основному із природних і супутніх газів, продуктів газифікації палива (водяного и пароповітряного газів) і коксового газу. В основі виробництва Гідрогену лежить каталітичні реакції взаємодії з водяним паром (конверсії) відповідних вуглеводнів (головним образом метану) і оксиду (II) Карбону, наприклад:
CH4 + H2O --800oC--> CO + 3H2
CO + H2O --600oC--> CO2 + H2
Гідроген отримують також неповним окисленням вуглеводнів, наприклад:
2CH4 + O2 = 2CO + 4H2
В зв’язку зі зменшенням запасів вуглеводної сировини велику зацікавленість має метод отримання Гідрогену відновленням водяного пара розжареним вуглецем:
C + H2O = CO + H2
При цьому утворюється генераторний газ. Витрати енергії на його отримання можливо компенсувати за рахунок реакції неповного окислення Карбону:
2C + O2 = 2CO
При комбінуванні цих двох процесів одержують водяний газ, до складу якого входить суміш H2 и CO.
Гідроген виробляють також електролізом води. В лабораторних умовах Гідроген отримують взаємодією Цинку з соляною або сірчаною кислотою.
Сполуки з ступенем окислення Гідрогену -1
В залежності від природи зв’язаного з ним елемента атоми Гідрогену в сполуках можуть бути поляризовані позитивно (ступінь окислення +1) або негативно (ступінь окислення -1):
-
LiH
BeH2
B2H6
CH4
H3N
H2O
HF
NaH
MgH2
AlH3
SiH4
H3P
H2S
HCl
KH
CaH2
GaH3
GeH4
AsH3
H2Se
HBr
RbH
SrH2
InH3
SnH4
SbH3
H2Te
HI
CsH
BaH2
сполуки H(-1)-----------пром. сполуки ----------сполуки H(+1)
Коли Гідроген виступає в якості окисника, він веде себе як галоген, утворюючи аналогічні галідам - гідриди. За окисною активністю Гідроген істотно поступається галогенам. З цієї ж причини виразний іонний характер проявляють лише гідриди найбільш активних металів – лужних і лужноземельних, наприклад KH и CaH2. До ковалентних відносяться, наприклад, гідриди складу SiH4 и BH3. Гідриди неметалів являються кислотними сполуками.
Характерною особливістю гідролізу гідридів являється виділення Гідрогену. Реакція протікає за окисно-відновному механізму. Негативно поляризований атом H(-1) в гідриді та позитивно поляризований атом H(+1) в воді переходять до стану з нульовим ступенем окислення:
KH + HOH = KOH + H2; -----------SiH4 + 3HOH = H2SiO3 + 4H2
За рахунок виділення Гідрогену гідроліз протікає повністю і не зворотно. При цьому основні гідриди утворюють луги, а кислотні - кислоту.
В якості амфотерної сполуки можна розглядати гідрид Алюмінію AlH3:
AlH3 (основний) + 3BH3 = Al(BH4)3
KH + AlH3(кислотний) = K[AlH4]
Стандартний потенціал системи 1/2H2/H- дорівнює -2,23 В. Тому, іон H- - один з самих сильних відновників. Відповідно, іонні, та комплексні гідриди - сильні відновники.
Сполуки Гідрогену (I)
За звичайних умов це гази (HCl, H2S, H3N), рідини (H2O, HF, HNO3), тверді речовини (H3PO4, H2SiO3). Властивості цих сполук сильно залежать від природи елемента, з яким безпосередньо зв’язаний Гідроген. Внаслідок здатності утворювати водневі зв’язки і вступати в донорно-акцепторну взаємодію рідкі HF, H2O і H3N являються гарними іонізуючими розчинниками.
Атоми Гідрогену входять також до складу гідросолей типу NaHS, NaHCO3, NaHSO4. Групи HS-, HCO-3, HSO-4 можуть існувати в розчинах у вигляді вільних іонів, що називають відповідно гідросульфід-, гідроКарбонат- и гідросульфат-іонами. Структура таких солей в твердому стані також обумовлена водневим зв’язком.
Пероксид Гідрогену
Молекула перекису Гідрогену характеризується сильною полярністю (=2,13D), що обумовлене особливостями її будови.
106о
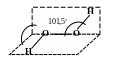
Отримати пероксид Гідрогену можливо дією розведеної сульфатної кислоти на пероксид барію, електролізом розчинів сульфатної кислоти або її суміші з сільфатом амонію за низьких температур, дією атомарного Гідрогену на Оксиген, окисленням металів в водному середовищі. Пероксид Гідрогену утворюється як проміжний продукт при горінні Гідрогену.
Чистий перекис Гідрогену – нестійка сполука і розкладається з вибухом.
2H2O2 = O2 + 2H2O
Водні розчини більш стійки і зберігаються в прохолодних темних місцях досить довго. Їх розкладення прискорюється при нагріванні, дії світла, каталізаторів.
H2O2 – слабка двохосновна кислота.
H2O2 ↔ H+ + HO2-
HO2- ↔ H+ + O22-
Перекис Гідрогену взаємодіє з основами з утворенням відповідних пероксидів.
H2O2 + Ba(OH)2 = BaO2 + 2H2O
Ступень окислення Гідрогену в пероксиді дорівнює -1, тому він може проявляти як окисні, так і відновні властивості. З сильними відновниками H2O2 проявляє окисні властивості (може окисляти речовини з φ < 1,78 в)
H2O2 + 2КІ = І2 + 2КОН
З сильними окисниками (φ > 0,68 в) пероксид Гідрогену проявляє відновні властивості.
H2O2 + Ag2O = 2Ag + H2O + O2
